果园脐腹小蠹伴生(共生)真菌群落组成及功能分析
2022-04-12朱晓锋蔡淑琳苏卓文张殿朋徐兵强阿布都克尤木卡德尔
朱晓锋,蔡淑琳,苏卓文,张殿朋,宋 博,徐兵强,阿布都克尤木·卡德尔,杨 森
(1.农业部西北荒漠绿洲作物有害生物综合治理重点实验室/特色林果产业国家地方联合工程研究中心/新疆农业科学院植物保护研究所,乌鲁木齐 830091;2.北京市农林科学院植物保护环境保护研究所,北京 100097)
0 引 言
【研究意义】小蠹虫与真菌伴生(共生)是长期协同进化的结果,二者所形成的关系是众多共生体系中的典型代表之一[1]。在植物-小蠹虫-伴生菌系统中,小蠹虫与伴生菌形成了依赖性和稳定性的关系:一方面小蠹虫作为媒介传播、扩散伴生菌,实现伴生菌在寄主树体内入侵和繁殖;另一方面小蠹虫依赖伴生菌克服寄主树木抗性,实现小蠹虫在寄主树木上有效定殖。伴生菌可导致寄主树木韧皮部中脂类物质的增加,改变韧皮部中树脂含量和愈伤组织的产生,决定小蠹虫能否成功定殖;伴生菌在削弱寄主树木抗性、协助小蠹虫侵害寄主方面起着重要作用[2, 3]。研究小蠹虫与其伴生菌的相互关系已成为系统研究小蠹虫综合控制策略与技术的重要组成部分[4, 5]。脐腹小蠹ScolytusschevyrewiSemenov(又名多毛小蠹ScolytusseulensisMurayama)记录于新疆天山东部[6]。脐腹小蠹是新疆果树特别是杏ArmeniacavulgarisLam.、西梅PrunusdomesticaL.、桃AmygdaluspersicaL.和扁桃(巴旦木)AmygdaluscommunisL.等蔷薇科果树的重大害虫,常造成果树枝、株的大量死亡[7-9]。【本研究切入点】近年来在新疆脐腹小蠹仍然普遍为害,并未有减轻的趋势。亟需研究新疆南部地区果园脐腹小蠹伴生真菌种类,分析其功能。【拟解决的关键性问题】在新疆疏勒、英吉沙等地采集被害果树上的脐腹小蠹成虫,利用MiSeq高通量测序技术和室内分离培养的方法,鉴定其伴生真菌种类或类群,研究新疆果树脐腹小蠹是否携带、传播植物病原性真菌,为新疆果树脐腹小蠹的综合防控提供参考。
1 材料与方法
1.1 材 料
在新疆南部地区疏勒、疏附、英吉沙、阿克陶县的杏、桃、扁桃、西梅等果园,每个果园随机选择3个采样点,每采样点随机选择被脐腹小蠹为害的枝干(长40~50 cm,直径7~10 cm)1~2枝,带回实验室。在实验室内(25 ± 2)℃饲养,直至成虫羽化。表1
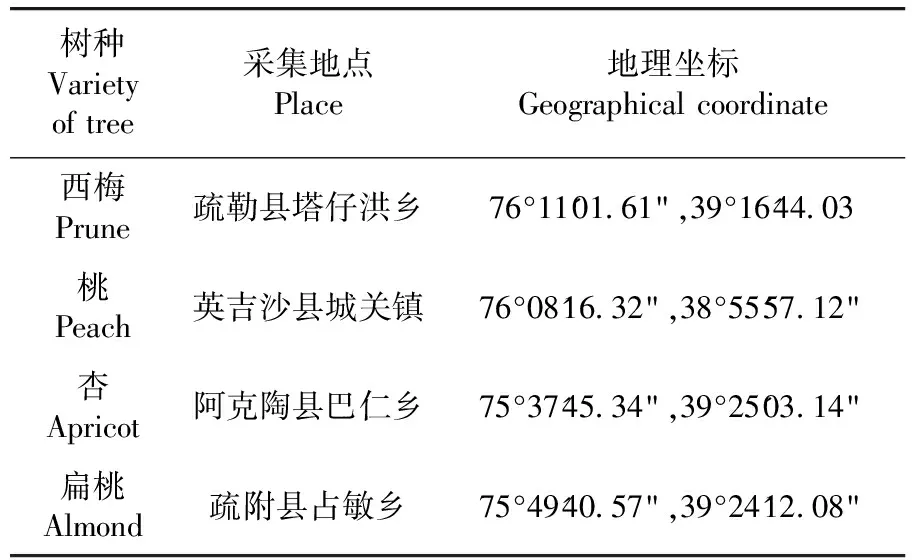
表1 样品采集地信息
体表伴生真菌样品制备:实验室内,取从不同果树枝干羽化的健康成虫5 头,分别放入含有5 mL灭菌水的无菌试管中,盖紧瓶盖后,放在振荡器上剧烈震荡5~10 min,静置后取上清液3 mL备用,重复3次。
肠道伴生真菌样品制备:取从不同果树枝干羽化的健康成虫5头,分别放入75%的酒精中灭菌1 min,再用蒸馏水冲洗 3 次。立即在无菌条件下解剖,取出肠道,放在含有5 mL的灭菌水的无菌试管中,盖紧瓶盖后,放在振荡器上剧烈震荡5~10 min,静置后取上清液3 mL备用,重复3次。
1.2 方 法
1.2.1 样品总DNA提取和PCR扩增
采用E.Z.N.A.®soil试剂盒(Omega Bio-tek, Norcross, GA, U.S.)对4种果树脐腹小蠹体表与肠道伴生真菌样品的 DNA进行提取,并重复3次。利用 NanoDrop2000进行检测DNA 浓度和纯度,利用1%琼脂糖凝胶电泳检测DNA提取质量;用真菌引物ITS1 F(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和 ITS2 R(5’-GCTGCGTTCTTCATCGATGC-3’);对V3-V4可变区进行PCR扩增,扩增程序为:95℃预变性3 min,循环数(35个)×(95℃变性30s,55℃退火30s, 72℃延伸45s),最后72℃延伸10 min(PCR 仪:ABI GeneAmp®9700 型)。再用 2%琼脂糖凝胶回收 PCR 产物,利用 AxyPrep DNA Gel Extraction Kit(Axygen Biosciences, Union City, CA, USA)进行纯化,Tris-HCl 洗脱,2%琼脂糖电泳检测。利用QuantiFluorTM-ST(Promega,USA)进行检测定量。根据 Illumina MiSeq 平台(Illumina,San Diego,USA)标准操作规程将纯化后的扩增片段构建 PE 2×300 的文库。
构建文库步骤:(1)连接“Y”字形接头;(2)使用磁珠筛选去除接头自连片段;(3)利用 PCR扩增进行文库模板的富集;(4)氢氧化钠变性, 产生单链 DNA 片段。最后用 Illumina 公司的 Miseq PE300 平台进行测序。
1.2.2 室内伴生真菌的分离与鉴定
1.2.2.1 培养基制备
试验所需各种培养基如下:酵母浸出粉胨葡萄糖琼脂(YPD)培养基、马铃薯葡萄糖琼脂(PDA)培养基、牛肉膏培养基、LB培养基。
1.2.2.2 伴生真菌的分离与纯化
在超净工作台上,分别取50 μL 体表和肠道伴生真菌样品均匀涂布在各种培养基上,并重复 3 次。体表伴生真菌分离平板直接放在室温25 ℃条件下,肠道伴生真菌分离平板放入密封培养盒中(盒内分别放入微需氧产气袋和厌氧产气袋)再放在室温条件下,培养48~72 h,待有菌落长出后,挑取单菌落纯化培养。并参考《真菌鉴定手册》等进行伴生真菌形态特征鉴定[10]。
1.2.2.3 分子生物学鉴定
将分离纯化的伴生真菌,通过菌落特征,初步分类后,对5.8S rRNA序列进行扩增。引物采用ITS1 : 5’-TCCGTAGGTGAACCTGCGG-3’,ITS4 : 5’-TCCTCCGCTTATTGATATGC-3’;基因组提取用 DNeasy Blood&Tissue Kit(QIAGEN,T50)试剂盒按照说明进行提取;PCR仪器为BIO-Rad(MyCycler),PCR 程序如下所述:
序列扩增PCR反应体系:基因组模板2.0 μL、10 × PCR buffer(mg2+free)2.5 μL、dNTP(2.5 mM each)1.0 μL、上游引物0.5 μL、下游引物0.5 μL、EXTaq(2.5 u/μL)0.5 μL、ddH2O 18.0 μL,共25 μL。
反应条件:94℃预变性10 min;然后 94℃保持60 s,55℃保持45 s,72℃保持60 s,35个循环;72℃保持10 min,1个循环;4℃保温。
PCR产物纯化及测序:将PCR产物放在1%的琼脂糖凝胶中进行电泳,电泳缓冲液为1 × TAE。电泳结束后将凝胶于10 μg/μL溴化乙淀中染色15~20 min,于Alpha凝胶成像仪中观察并记录结果,然后将反应体系送至北京天一辉远公司进行测序。将获得的菌株序列在NCBI网址https://blast.ncbi.nlm.nih.gov/Blast.cgi进行BLAST(Basic Local Alignmentsearch Tool)比对,结合病原菌的形态学特征,对病原菌进行鉴定分类。
1.3 数据处理
原始测序序列使用 Trimmomatic 软件质控,使用 FLASH 软件进行拼接:(1)设置 50 bp 的窗口,如果窗口内的平均质量值低于 20,从窗口开始截去后端碱基,去除质控后长度低于 50 bp 的序列;(2)barcode 需精确匹配,引物允许 2 个碱基的错配,去除模糊碱基;(3)根据重叠碱基 overlap 将两端序列进行拼接,overlap 需大于 10 bp。去除无法拼接的序列。使用的 UPARSE 软件(version 7.1 http://drive5.com/uparse/),根据 97%的相似度对序列进行 OTU 聚类;使用 UCHIME 软件剔除嵌合体。利用 RDP classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对 Silva 数据库(SSU123),设置比对阈值为 70%。基于 OTU 计算稀释曲线、群落丰富度指数(Chao1、ACE)和群落多样性指数(Shannon、Simpson)等。高通量测序结果采用 FUNGuild v1.0 软件分析真菌功能分类。将获得 OTU 上传到 FUNGuild 分析平台(http://www.funguild.org/)进行分析;下载运行结果后对结果进行筛选。
2 结果与分析
2.1 伴生真菌多样性
研究表明,脐腹小蠹肠道真菌的OTU数量、ACE指数、Chao指数、Shannon指数均高于体表,各项指数均未达显著性差异(P<0.05),果树脐腹小蠹肠道伴生菌多样性略高于体表,但未达到显著性差异。表2
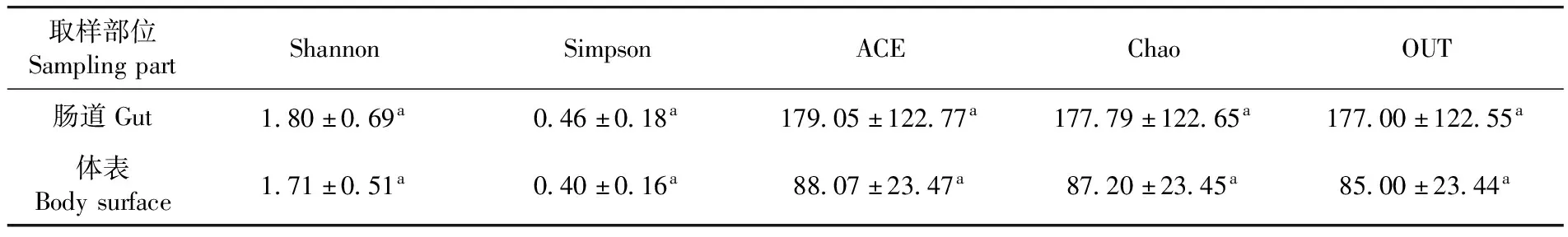
表2 脐腹小蠹伴生菌Alpha多样性指数
2.2 伴生真菌群落组成
研究表明,脐腹小蠹体表、肠道伴生真菌主要由7个门、24个纲、66个目、124个科的221个属组成;其中肠道优势菌群为Geosmithia、Pleosporales和Gibellulopsis,在群落组成中的占比分别为42.14%、15.61%和6.97%;体表优势菌群为Geosmithia、Saccharomycetales、Byssochlamys和Wickerhamomyces占比分别为29.55%、19.50%、8.20%和6.07%。表3,图1
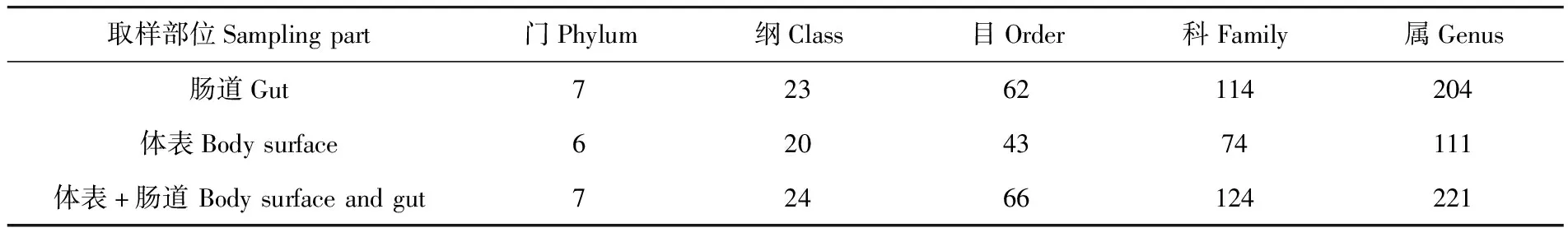
表3 脐腹小蠹体伴生真菌群落组成

注:a肠道,b体表
2.3 伴生真菌FUNGuild 功能预测
研究表明,脐腹小蠹伴生真菌营养型组成较为相似,以腐生营养型(saprotroph)、植物致病型(plant pathogen)、病理-腐生营养型(pathotroph-saprotroph)和动物致病型(animal pathogen)为主;在伴生菌群落中,腐生营养型和病理-腐生营养型的真菌比例较高,其中未定义的腐生真菌比例最高,在体表和肠道中分别占71.57%和50.46%;其次是功能未知的真菌,在体表中占8.60%,在肠道中占21.35%;而体表携带植物致病真菌的比例为6.25%,肠道为9.92%;动物致病真菌在体表和肠道中的比例分别为0.31%和0.65%(图2a);在为害不同果树的脐腹小蠹伴生菌中,仍以腐生营养型和病理-腐生营养型的真菌为主,其中未定义的腐生真菌占比较高,在为害西梅树、杏树、桃树和扁桃树的脐腹小蠹携带比例依次降低,分别为71.86%、65.95%、54.85%和42.86%;此外,为害4种果树的脐腹小蠹均携带植物致病真菌,其中为害桃树的脐腹小蠹携带植物致病真菌比例最高,为19.06%,其次是为害杏树的脐腹小蠹,占9.46%,再次是扁桃和西梅,分别为3.25%和1.58%;而为害桃树、杏树和西梅的脐腹小蠹携带有动物致病真菌,分别占1.28%、0.56%和0.10%(图2b)。图2
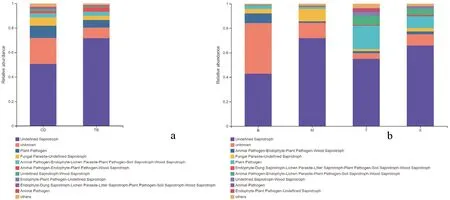
注:CD:肠道,TB:体表,B:扁桃树,M:西梅树,T:桃树,X:杏树
2.4 室内伴生真菌的分离与鉴定
研究表明,为脐腹小蠹伴生真菌分别为10个属的13种真菌,分别为新疆假丝酵母(Candidaxinjiangensis)、Candidapeoriensis、汉姆酵母(Wickerhamomycessilvicola)、威克汉姆西弗酵母(Wickerhamomycesciferrii)、季也蒙毕赤酵母(Meyerozymaguilliermondii)、胶红酵母(Rhodotorulamucilaginosa)、Yamadazymamexicana、Naganishiaalbida、出芽短梗霉菌(Aureobasidiumpullulans)、Geosmithiapallida和大孢枝孢菌(Cladosporiummacrocarpum),以及假丝酵母1种(疑似新种)(Candidasp.)和拟青霉1种(Paecilomycessp.);脐腹小蠹体表伴生真菌有12种,肠道伴生真菌有8种。表3
2.5 室内鉴定的伴生真菌功能
研究表明,在已鉴定脐腹小蠹伴生真菌中,7种伴生真菌有相关功能报道,根据已报道相关功能,可分为2类,一类为植物致病真菌,有Y.mexicana、G.pallida和大孢枝孢菌;另一类为有益菌,对多种植物病原菌有杀菌、抑制或拮抗作用,有汉姆酵母、季也蒙毕赤酵母、胶红酵母和出芽短梗霉菌;而C.xinjiangensis、C.peoriensis、威克汉姆西弗酵母和N.albida4种真菌无相关功能的报道。表4
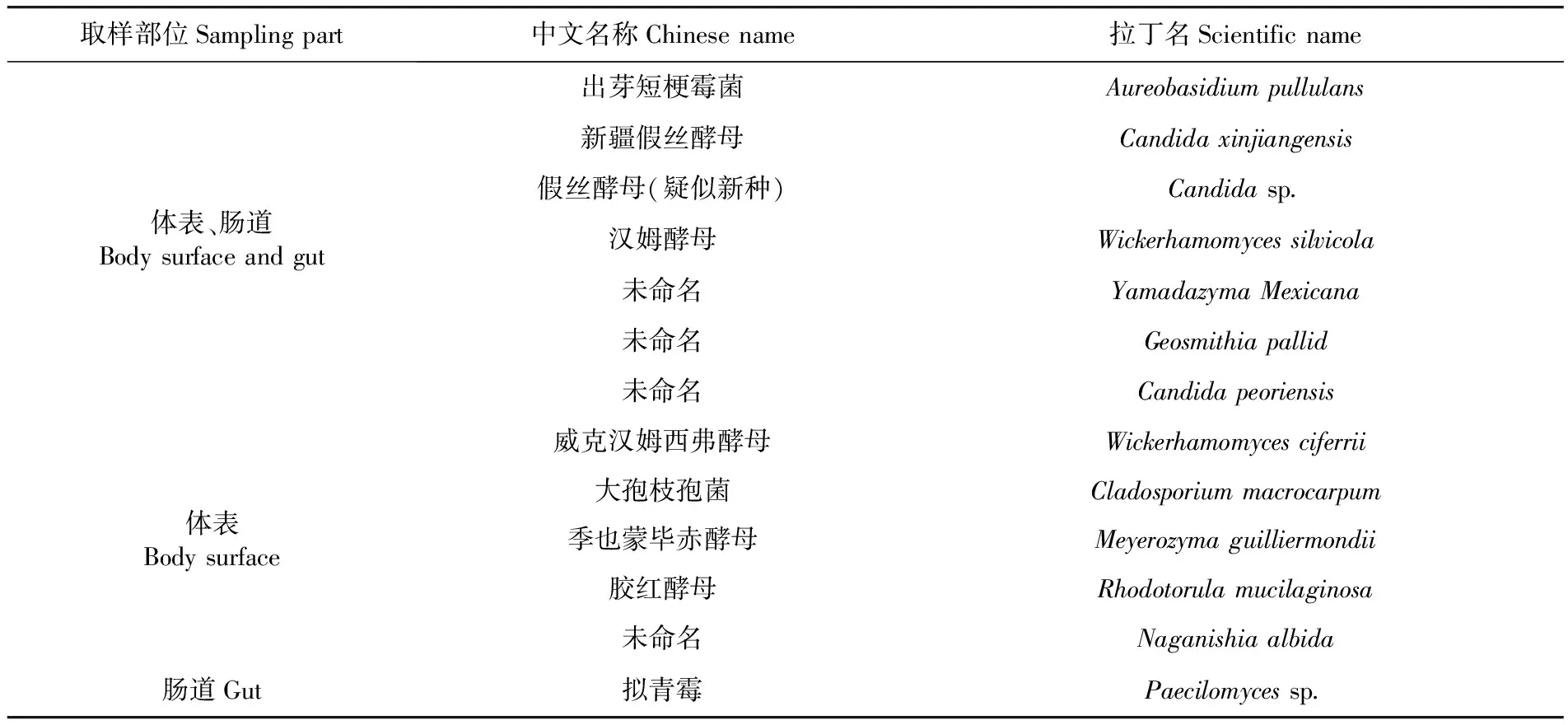
表4 脐腹小蠹伴生真菌的分离与鉴定
3 讨 论
昆虫共生菌主要有以下几方面的功能:一是营养和物质代谢功能;二是影响昆虫的生长发育;三是影响昆虫行为;四是保护昆虫的作用[43]。通过对杏、扁桃、桃、西梅等果树脐腹小蠹伴生真菌的高通量测序和FUNGuild功能预测可以看出脐腹小蠹伴生有大量的真菌,且营养型丰富,含有腐生营养型真菌、植物致病型真菌、病理-腐生营养型真菌和动物致病型真菌;此外通过室内培养鉴定和功能分析伴生真菌中既有植物致病真菌又有对植物病原菌有杀菌、抑制或拮抗作用的生防有益菌,与FUNGuild功能预测结果具有一定的一致性。脐腹小蠹伴生菌是一个微生态系统,作者认为这些伴生菌在脐腹小蠹寄主定殖过程中起着重要的协同作用。如植物致病真菌(如G.pallida、Y.mexicana和大孢枝孢菌等)被脐腹小蠹普遍携带并传播,为脐腹小蠹为害和克服寄主抗性提供有利条件。而一些有益菌(如W.silvicola、季也蒙毕赤酵母、胶红酵母、出芽短梗霉菌对脐腹小蠹的为害起抑制作用。
酵母菌也是小蠹虫常见的伴生菌,大多数小蠹虫个体仅伴生一种或少量几种,并且存在于小蠹虫的所有生命阶段,也存在于卵室、蛹室、幼虫和成虫消化道以及寄主韧皮部和木质部组织中;伴生酵母菌产生的挥发性化学物质具有广泛的生物活性,低浓度下可吸引小蠹虫,高浓度有驱避作用,其挥发物也可以作为捕食性和寄生性天敌搜寻小蠹虫的重要物质;伴生酵母菌还可以改变树体组织的化学成分或代谢有毒的萜类化合物,因此,伴生酵母菌对小蠹虫可能具有调节种间竞争、产生信息素、分解植物有毒物质、提供营养补充的作用[44,45]。如伴生酵母菌Ogataeapini产生的挥发物可显著促进西松大小蠹Dendroctonusbrevicomis互惠共生菌Entomocorticiumsp.B的生长,抑制其病原菌Beauvariabassiana的生长,并能参与到寄主植物组织中对萜类挥发物的反应之中,改变韧皮部组织的化学环境,产生乙醇,二硫化碳(CS2)和Δ-3-蒈烯(对小蠹虫具有引诱作用)[45,46]。在研究中在新疆果树脐腹小蠹伴生菌多种酵母菌,如新疆假丝酵母、汉姆酵母、威克汉姆西弗酵母、季也蒙毕赤酵母、胶红酵母、Y.mexicana和C.peoriensis。其中,Y.mexicana为植物致病真菌,而汉姆酵母、季也蒙毕赤酵母、胶红酵母为多种致病菌的拮抗菌或生防菌,此外,新疆假丝酵母、C.peoriensis和威克汉姆西弗酵母其生态学功能未见报道,其中新疆假丝酵母为新疆果树脐腹小蠹伴生真菌报道之新种。进一步研究脐腹小蠹伴生酵母等真菌的生物、生态学功能,对进步一揭示脐腹小蠹的发生为害和综合治理具有重要意义。

表5 已鉴定果树脐腹小蠹伴生真菌功能分析
4 结 论
新疆南部地区果园脐腹小蠹伴生真菌落是一个微生态系统,主要有腐生营养型、植物致病型、病理-腐生营养型和动物致病型真菌组成,且不同果园脐腹小蠹均携带植物致病真菌,其中为害桃树的脐腹小蠹携带比例最高,为19.06%;室内鉴定出植物致病真菌3种、有益拮抗真菌4种。新疆果树脐腹小蠹普遍携带、传播植物病原菌,在防控脐腹小蠹的同时应注重果树枝干病害的防控;而伴生真菌中的有益拮抗菌可作为生物防治菌被开发利用。
