基于网络药理学的秦七风湿方干预骨性关节炎活性成分及作用机制预测△
2022-04-11苏洁周瑞王梅张海潮刘妍如刘红波宋忠兴杨莎唐志书
苏洁,周瑞*,王梅,张海潮,刘妍如,刘红波,宋忠兴,杨莎,唐志书
1.陕西中医药大学 陕西中药资源产业化省部共建协同创新中心/秦药特色资源研究开发国家重点实验室(培育)/陕西省创新药物研究中心,陕西 咸阳 712083;2.陕西中医药大学 附属医院,陕西 咸阳 712000
骨性关节炎(osteoarthritis,OA)为常见的关节类疾病,临床一般表现为膝、髋等大关节的疼痛、单侧关节僵硬,严重者甚至会出现关节畸形、脱位,影响患者日常生活[1]。OA 属于中医“骨痹”范畴,为五体痹之一。风寒湿邪内侵人体筋骨关节,致经脉气血闭阻,肢体沉重、拘挛屈曲,关节剧痛。《黄帝内经·素问》记载“肾主骨”[2]10、“肾生骨髓”[2]43,《黄帝内经·灵枢》记载“脑为髓之海”“髓海有余,则轻劲多力,自过其度;髓海不足,则脑转耳鸣,胫酸眩冒。”[3]100肾充养骨骼,肾充则髓实。《黄帝内经·素问》逆调论中记载:“病名曰骨痹,是人当挛节也。”[2]56以肾虚髓涸,致筋燥失养,挛缩而急。故在祛除风寒湿邪之时,当补益肝肾,以达到扶正祛邪之效。秦七风湿方(Qinqi Rheumatism Formula,QRF)为陕西中医药大学附属医院杨秀清教授的临床经验方,常用于治疗类风湿性关节炎,该方源于秦岭特色药材陕西“太白七药”,由珠子参(扣子七)、秦艽、山茱萸组成,方中君药珠子参,有补肺养阴、祛瘀止痛、止血之效,文献报道其具有镇痛、抗炎[4]及免疫调节[5]等药理活性。臣药秦艽善治风湿痹痛、半身不遂等证,具有祛风湿、止痹痛、清湿热等功效,增强君药祛瘀止痛之效。山茱萸以果肉入药,性微温,归肝、肾经,临床多用于补益肝肾、收涩固脱,文献记载其具有免疫调节、抑菌等多种药理活性[6],在QRF 中为佐使药,补益肺肾之气,调和君药珠子参的寒性,同时引药下行入肾经。三药配伍共行通痹止痛、清湿热、补益肝肾之效,配伍得当,温而不燥,补而不过。
OA高发于老年人群,在治疗过程中,使用消炎药、止痛药的不良反应较严重,而进行关节置换手术需要承担较高风险,因此寻找合适的药物进行缓解及干预治疗十分必要。在临床中QRF 已被证实对类风湿性关节炎(RA)所表现的关节肌肉疼痛、屈伸不利等症状有明显改善作用,且QRF 全方在通痹止痛基础上,更有补益肾气、扶正祛邪之效。本课题组前期研究发现,QRF 能够显著抑制脂多糖(LPS)诱导的小鼠单核巨噬细胞RAW264.7 分泌炎症细胞因子一氧化氮(NO)[7],在昆明种小鼠体内有较强的镇痛作用,具有抑制免疫功能的作用[8],同时初步发现其对碘乙酸钠诱导的软骨细胞损伤具有一定的保护作用[9]。以上研究表明,QRF 具有较好的抗炎镇痛作用,因此推测QRF 可能对OA 有干预作用。目前关于QRF 干预OA 的临床研究和实验报道较少,本课题基于系统网络数据库,建立QRF干预OA 的靶点网络,对QRF 作用于OA 的活性成分及作用机制进行预测分析,并通过分子对接及体外实验进行验证。OA 在临床中常表现为滑膜炎症,患者滑膜组织中存在大量活化的巨噬细胞,提示巨噬细胞可能在OA 的发生、发展中具有关键作用[10]。因此,本课题组通过LPS 诱导RAW264.7细胞构建炎症模型,研究QRF 的体外抗炎活性,为QRF 干预OA 的临床研究提供参考。
1 材料
1.1 细胞
RAW264.7细胞购自于中国科学院上海细胞库。
1.2 试药
珠子参(批号:20191105)、秦艽(批号:20200511)和山茱萸(批号:20200321)饮片均购于陕西兴盛德药业有限责任公司,经陕西中医药大学刘世军教授鉴定,分别为五加科植物珠子参Panax japonicusC.A.Mey.var.major(Burk)C.Y.Wu et K.M.Feng.的干燥根茎、龙胆科植物秦艽Gentiana macrophyllaPall.的干燥根、山茱萸科植物山茱萸Cornus officinalisSieb.et Zucc.的干燥成熟果肉;胎牛血清(FBS,批号:1924622)、青‑链霉素(批号:0010419)、RPMI 1640 培养液(批号:2038151)均购于Biological Industries 公司;CCK‑8试剂(批号:SB793,Dojindo Laboratories 公司);LPS(批号:L4391,Sigma公司);肿瘤坏死因子‑α(TNF‑α)酶联免疫吸附分析(ELISA)试剂盒(批号:M170228‑102a,欣博盛生物科技有限公司)。
1.3 仪器
Multiskan GO 型全波长酶标仪、I50i/240i型CO2细胞培养箱、Legend Micro 17R型高速冷冻微量离心机、ECO 0.9型超净工作台(Thermo Fisher Scientific公司)。
2 方法
2.1 QRF化学成分及成分靶点收集
基于中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php)、SymMap(https://www.symmap.org/)及中医药百科全书数据库(ETCM,http://www.nrc.ac.cn:9090/ETCM/)[11‑13]及相关文献收集珠子参、山茱萸、秦艽3 味中药所含的活性成分及成分对应的靶点,通过UniProt数据库(https://www.uniprot.org/)规范、校正靶点简称。
2.2 OA相关靶点收集及成分‑疾病靶点交集
以“骨性关节炎(Osteoarthritis)”为关键词,在GeneCards 数据库(https://www.genecards.org/)、Therapeutic Target Database(http://db.idrblab.net/ttd/)及DrugBank 数据库(https://www.drugbank.ca/)中对疾病进行搜索,得到与OA 疾病相关的靶点蛋白,通过UniProt数据库进行校正并去除重复靶点,即得OA 相应的疾病靶点。运用在线作图网站微生信(http://www.bioinformatics.com.cn/)对成分靶点及疾病靶点进行映射,收集成分可能作用于疾病的靶点。
2.3 蛋白质‑蛋白质相互作用(PPI)网络的构建及生物学功能与代谢通路的富集分析
在STRING 11.0 数据库(https://String‑db.org/)中将成分、疾病的共有靶点进行PPI 网络的分析构建,将种属选项选择“智人(homo sapiens)”,Clusters 选择“kmeans clustering”选项,设置3 个集群,其他参数保持默认值,将PPI 结果以.png 格式导出保存。在STRING 11.0 数据库中对所得的预测靶点进行分析,通过基因本体(GO)数据库分别对靶点蛋白进行生物过程(BP)、细胞组成(CC)、分子功能(MF)富集分析,通过京都基因与基因组百科全书(KEGG)数据库进行相关靶点的代谢通路富集分析。使用在线作图网站微生信输出结果。
2.4 药物‑成分‑靶点‑通路网络构建分析
根据KEGG 代谢通路的富集结果,进一步将富集得到的通路与3 味药物、关联成分及靶点导入Cytoscape 3.7.2 软件中,构建QRF 的药物‑成分‑靶点‑通路网络。
2.5 分子对接虚拟筛选
2.5.1 蛋白受体结构的准备 通过UniProt 数据库检索网络药理学预测出的核心靶点的三维结构,在RCSB PDB 数据库(https://www.rcsb.org/pdb/home/sitemap.do)中下载蛋白质大分子的.pdb 格式文件。在UCSF Chimera 1.15rc软件中去除大分子蛋白结构中的晶体结构及水分子等小分子物质,对蛋白结构进行加氢、计算电荷、能量最小化处理后,保存为.mol2格式。
2.5.2 活性成分配体结构的准备 通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)查找网络药理学预测活性成分及阳性对照药物塞来昔布(Celebrex)的CAS 号,在SciFinder‑Explore 数据库(https://scifinder.cas.org/scifinder/view/scifinder/scifinder Explore.jsf)的Substance Identifier 项下检索活性成分,并保存其二维化学结构的.mol 格式。通过ChemBioDraw Ultra 14.0 软件规整二维化合物结构式,保存为.cdx 格式,通过Chem3D 19.0 软件进行能量最小化处理,保存小分子配体为.mol2格式。
2.5.3 成分靶点对接 在UCSF Chimera 1.15rc 软件中打开大分子靶点蛋白与小分子配体的.mol2 格式,通过软件中的AutoDock Vina 板块,设置受体、配体分子及对接盒子大小,设定Number of binding modes=9、Exhaustiveness of search=8、Maximum energy difference=3,进行分子对接虚拟筛选,导出对接的最优构象亲和力分值结果。
2.6 QRF的体外炎症活性验证
2.6.1 QRF 水提物的制备 按照1.0∶1.5∶1.5 称取珠子参、秦艽和山茱萸,加16 倍量水煎煮3 次,每次2 h,合并滤液,得QRF水提液,用时稀释至对应质量浓度。
2.6.2 QRF对RAW264.7细胞增殖的影响 RAW264.7细胞用含10% FBS 及1%青‑链霉素的RPMI 1640 培养液培养于37 ℃、5% CO2的培养箱中。将处于对数生长期的RAW264.7细胞密度调整为2×105个/mL,每孔100 μL 接种于96 孔板中,放入37 ℃、5% CO2的培养箱中培养4 h 之后,弃去上清液,设对照组(完 全培养基)及QRF(20、50、100、200、500、1000、2000 μg·mL-1,以生药量计)组,每组设置6个复孔,继续培养24 h后,每孔加入CCK‑8试剂10 μL,1 h后用酶标仪在450 nm波长处检测其吸光度。
2.6.3 QRF对LPS诱导的RAW264.7细胞分泌TNF‑α的影响 将RAW264.7 细胞以2×105个/mL 的细胞密度接种于96孔板中,每孔100 μL,放入37 ℃、5%CO2的培养箱中培养4 h之后,弃上清液,设置对照组(完全培养基)、模型组(LPS 1 μg·mL-1)、QRF(20、50、100、200 μg·mL-1,以生药量计)组,每组设置6 个复孔[14]。作用20 h 后取细胞上清液,按TNF‑αELISA试剂盒说明书进行操作,检测TNF‑α释放量。
2.6.4 统计学方法 数据采用GraphPad Prism 5.01软件进行统计学分析。各组数据以()表示。若符合正态性分布和方差齐性检验,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(ANOVA);若为非正态分布或方差不齐,两组之间比较采用Mann‑Whitney U 检验,多组间比较采用Kruskal‑Wallis H检验。至少进行3次以上平行实验。
3 结果
3.1 QRF活性成分的收集
经TCMSP、SymMap、ETCM 数据库及相关文献[15‑20]筛选,剔除无靶点预测数据的成分及药物中含量少且非主要活性部位的成分,筛出珠子参活性成分33个、山茱萸中活性成分12个、秦艽中活性成分11个。
通过数据库与文献筛选出3 种药物主要活性成分共50 个,结果见表1。其中齐墩果酸为3 种药物共有的成分,谷甾醇、獐牙菜苷元为山茱萸、秦艽共有成分,豆甾醇为珠子参、山茱萸共有成分,胡萝卜苷为珠子参、秦艽共有成分。
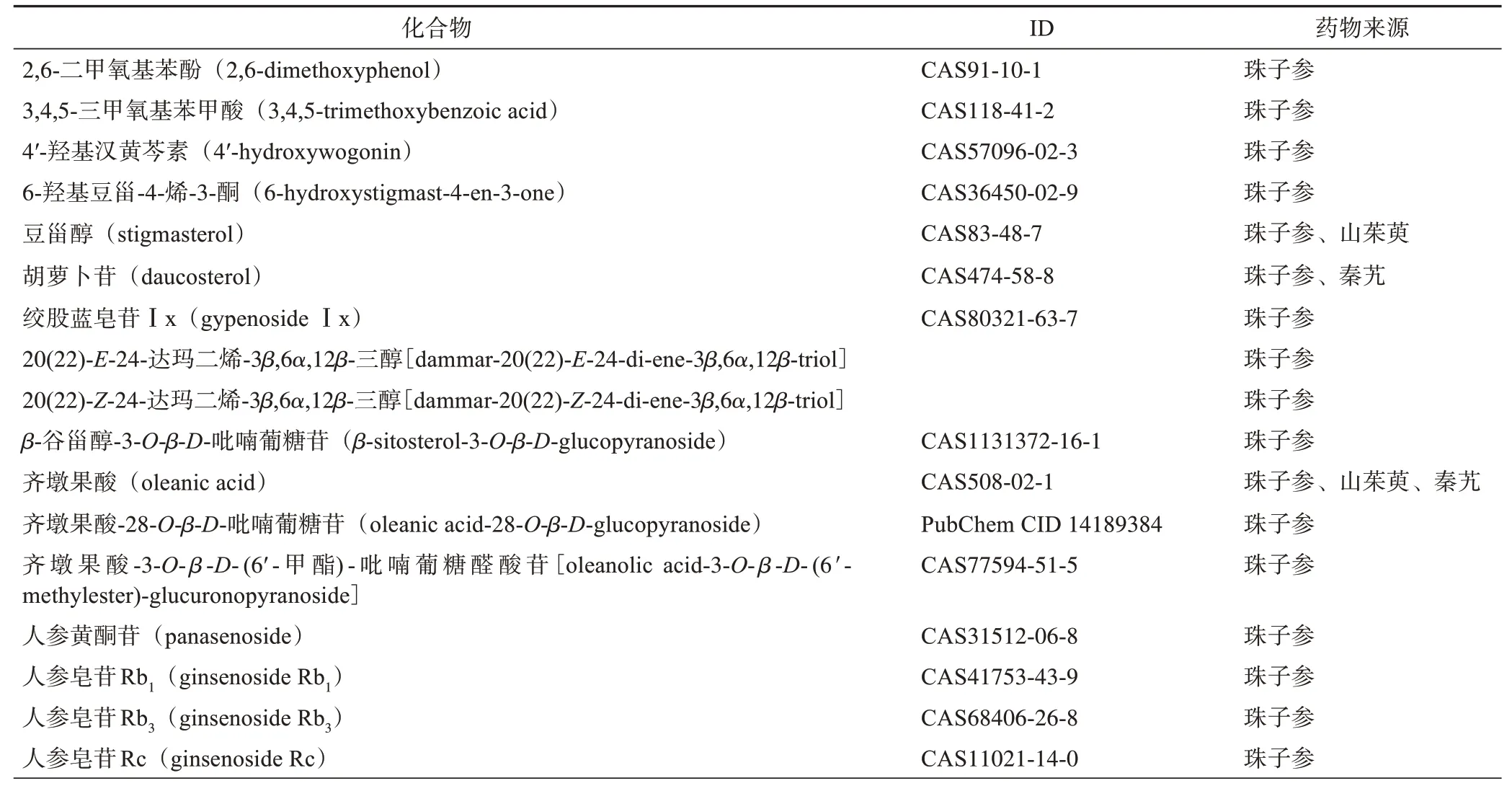
表1 QRF主要活性成分
3.2 药物成分对应靶点及OA靶点的收集
共筛选得到珠子参靶点247 个、山茱萸靶点206个、秦艽靶点169个,去重后共计成分靶点330个。在GeneCards、Therapeutic Target Database、DrugBank 数据库检索分别得到OA 相关靶点466、20、82个,去重后共得到556 个靶点。通过韦恩图对收集到的成分与疾病靶点进行交集(图1),得到可能为QRF 中活性成分作用于OA的靶点26个。
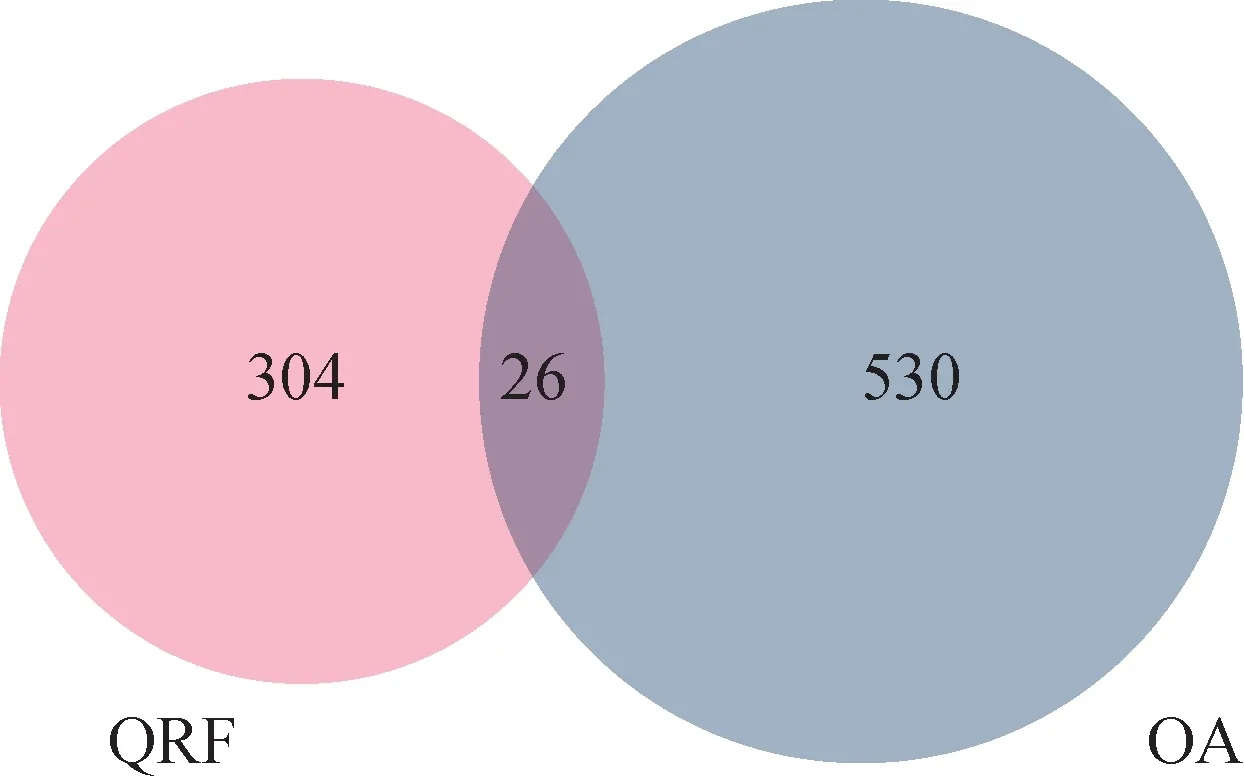
图1 QRF成分靶点与OA靶点交集韦恩图
3.3 PPI网络的构建
将26个靶点进行PPI分析,构建PPI网络,见图2。白细胞介素‑6(IL‑6)与其他蛋白的关联程度最高,TNF、前列腺素内过氧化物合酶2(PTGS2)、IL‑1β等蛋白次之,说明这些蛋白参与调控的功能较为显著。

图2 QRF作用于OA靶点的PPI网络
3.4 GO分析及KEGG通路富集分析
运用STRING 11.0 数据库对26 个靶点进行GO生物学功能富集分析,共得到GO 条目762 个(P<0.05),其中BP 条目672 个,CC 条目30 个,MF 条目60 个,分别占88%、4%、8%。3 个类别GO 分析P值较小的前10 个结果见图3。由GO 分析结果可知,QRF 中的活性成分作用于OA 的靶点主要分布在细胞外空间(extracellular space)、细胞外区域(extracellular region)、核转录因子‑κB(NF‑κB)抑制蛋白(I‑κB)/NF‑κB 复合体(I‑κB/NF‑κB complex)等部位,MF 主要涉及过渡金属离子结合(transition metal ion binding)、血红素结合(heme binding)、前列腺素内过氧化物合酶活性(prostaglandin‑endoperoxide synthase activity)、细胞因子活性(cytokine activity)等,且与细胞因子介导的信号通路(cytokine‑mediated signaling pathway)、对细胞因子的反应(response to cytokine)、细胞对细胞因子刺激的反应(cellular response to cytokine stimulus)、炎症反应(inflammatory response)等BP密切相关。
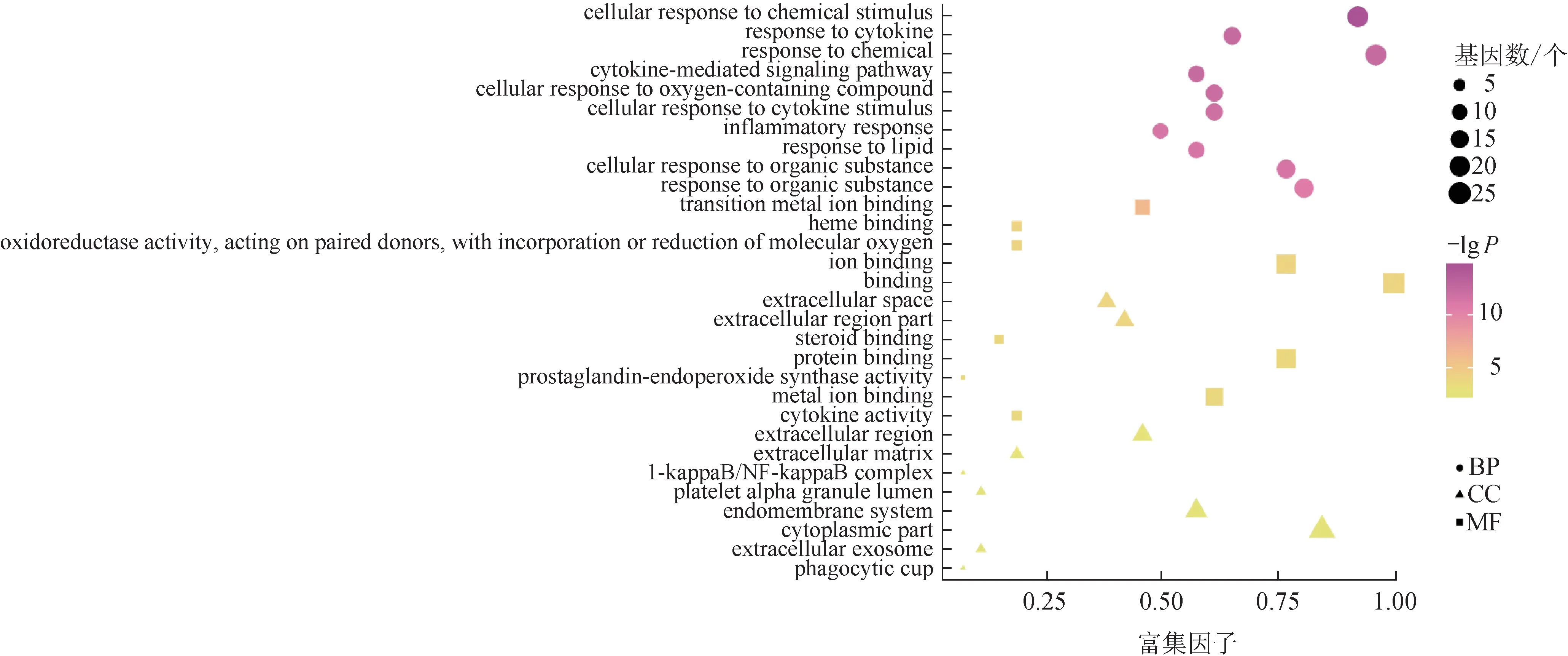
图3 QRF干预OA靶点的GO富集分析
KEGG 代谢通路富集共筛选得到102 条信号通路(P<0.05),涉及IL‑17 信号通路(hsa04657)、TNF信号通路(hsa04668)、类风湿关节炎(hsa05323)、Toll 样受体(TLR)信号通路(hsa04620)、辅助性T 细胞17(Th17)分化(hsa04659)、破骨细胞分化(hsa04380)等,这些通路可能为QRF 干预OA 的关键通路。P值较小的前10 条代谢通路对应靶点信息见表2。
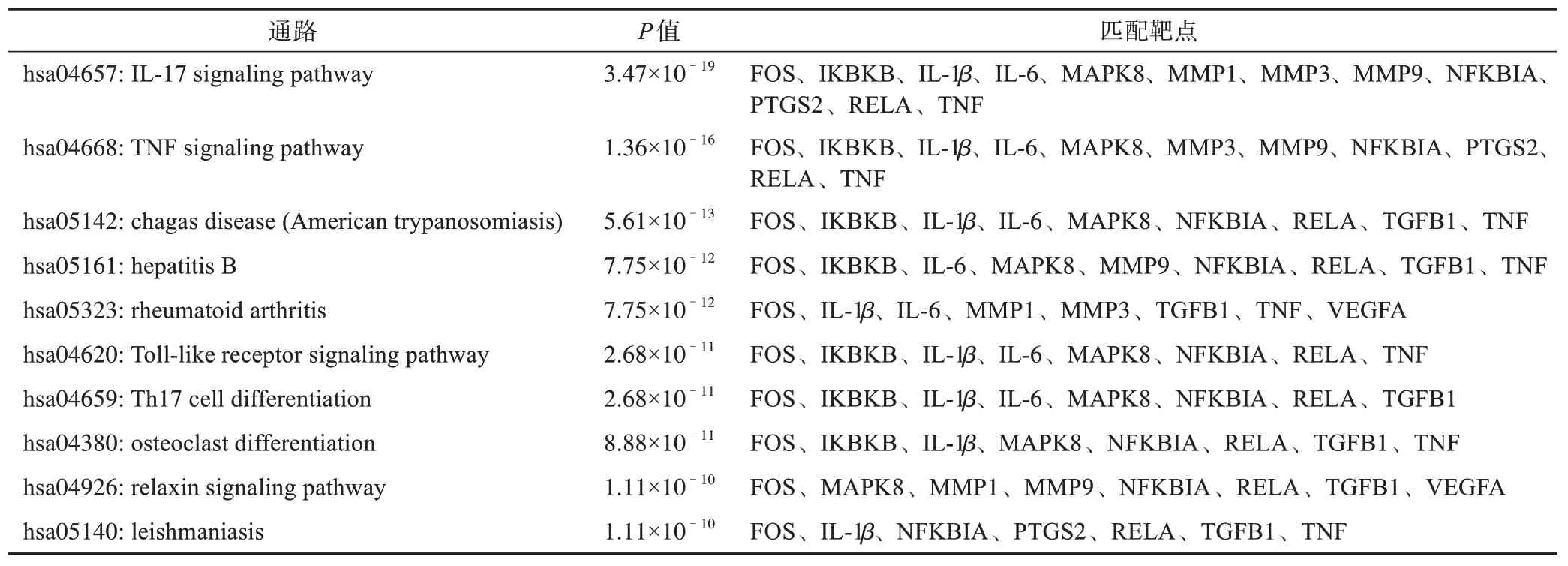
表2 代谢通路对应靶点信息(前10条)
3.5 药物‑成分‑靶点‑通路网络的构建
将KEGG 通路富集分析结果的前10 条代谢通路匹配的靶点进行整合,共得到通路关联靶点14 个,通过2.1 项下的成分靶点整理得到14 个靶点分别对应的药物活性成分,运用Cytoscape 3.7.2 软件构建QRF药物‑成分‑靶点‑通路网络(图4)。
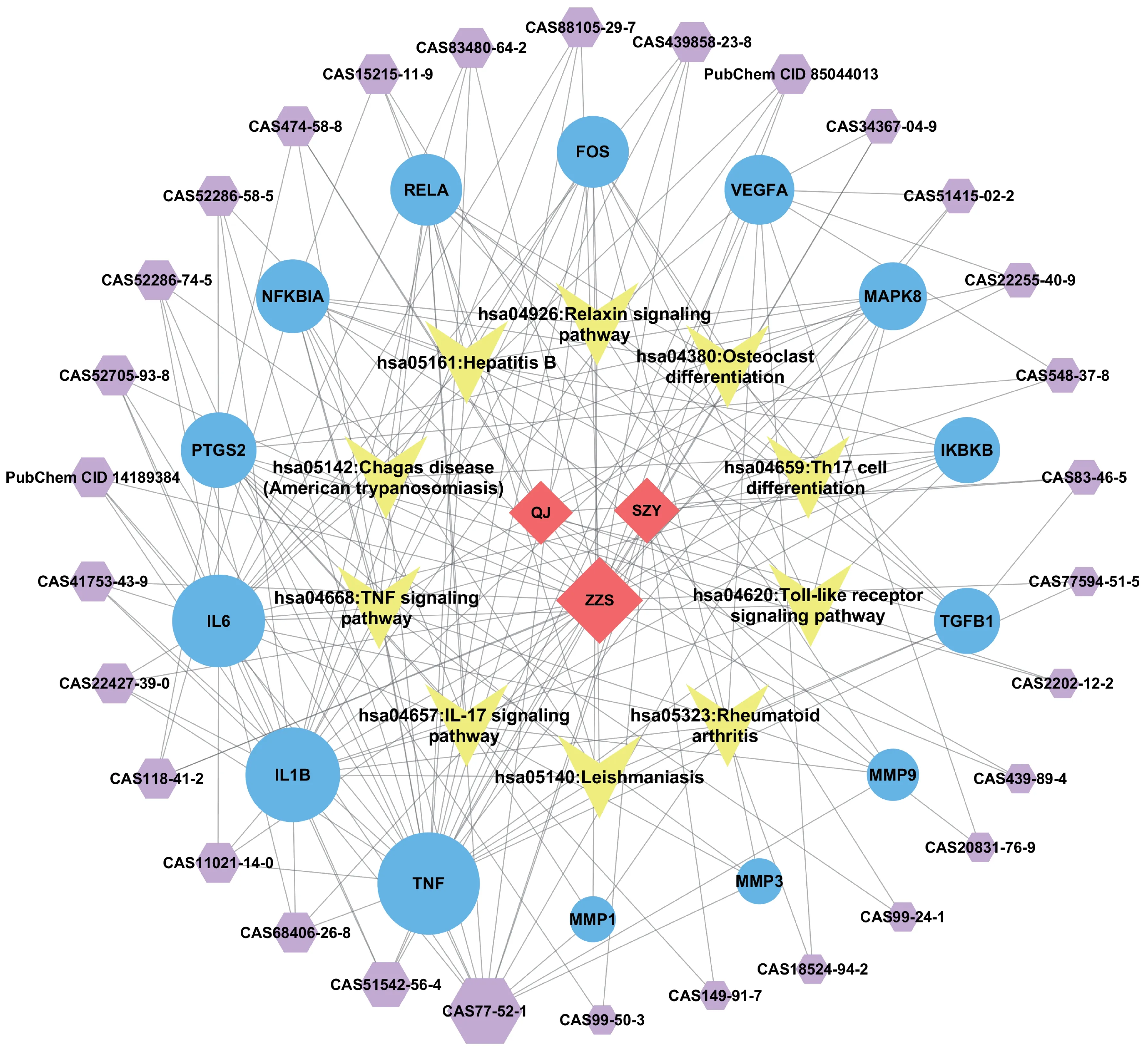
图4 QRF干预OA的药物-成分-靶点-通路网络
其中珠子参中人参皂苷Re、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd,山茱萸中熊果酸、獐牙菜苷元、山茱萸苷,秦艽中的马钱苷酸、龙胆碱等多个成分的度(degree)值较高,提示这些活性成分可能参与了QRF调控干预OA的过程。
3.6 分子对接虚拟筛选
AutoDock Vina 对接后的score 表示配体受体对接的最佳构象打分值,数值越小说明配体与受体结合的亲和力越大,构象越稳定。一般认为score<-7,配体受体具有强烈的结合活性。将网络药理学技术预测的靶点蛋白受体及活性成分的小分子配体结构进行能量最小化处理后,在Chimera 的AutoDock Vina 板块进行虚拟对接,结果见表3。以阳性对照药物塞来昔布对比评价预测的其他主要活性成分与目标靶点的结合能力。由分子对接结果可知,人参皂苷Rg1与TNF 亲和力强于塞来昔布,熊果酸、人参皂苷Rb1与IL‑1β,熊果酸与IL‑6 亲和力强于塞来昔布,人参皂苷Re 与IL‑1β、IL‑6 对接构象的亲和力与塞来昔布相当。熊果酸、人参皂苷Re、人参皂苷Rg1、人参皂苷Rb1、人参皂苷Rd、马钱苷酸、獐牙菜苷元、山茱萸苷与PTGS2 均有较强的结合活性,但弱于塞来昔布。
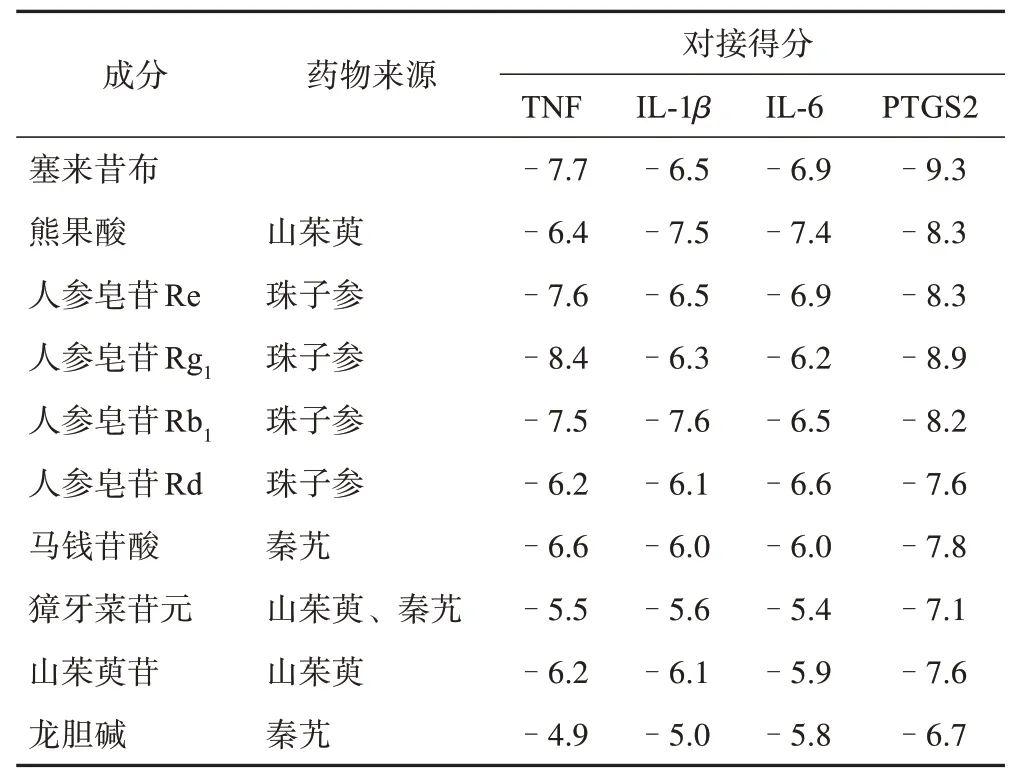
表3 QRF干预OA的活性成分与关键靶点对接得分及关联药物分析
上述靶点与部分活性成分的分子对接构象结果见图5。大部分活性成分与受体主要以氢键形式结合,其中人参皂苷Rg1上羟基与TNF 蛋白上的GLU248、GLN369为氢键的结合位点,羰基与LYS238结合形成氢键。人参皂苷Rb1与IL‑1β受体结合,配体上羟基与LEU134 为氢键结合位点。熊果酸与IL‑6 受体上ASN33结合形成氢键。人参皂苷Rg1与PTGS2上氢键结合位点为THR28、ARG29、SER95、ILE93、SER90、GLN339。

图5 QRF干预OA的活性成分与靶点对接相互作用分析
3.7 体外抗炎活性验证结果
QRF 对RAW264.7 细胞增殖的影响结果见表4,与对照组相比,QRF 在1000 μg·mL-1时细胞存活率降低,在20~500 μg·mL-1可明显促进细胞增殖,说明QRF 质量浓度在500 μg·mL-1以下对RAW264.7细胞无细胞毒作用。因此,选取QRF质量浓度为20、50、100、200 μg·mL-1进行LPS诱导炎症模型实验。
表4 QRF对RAW264.7细胞增殖的影响(,n=5)
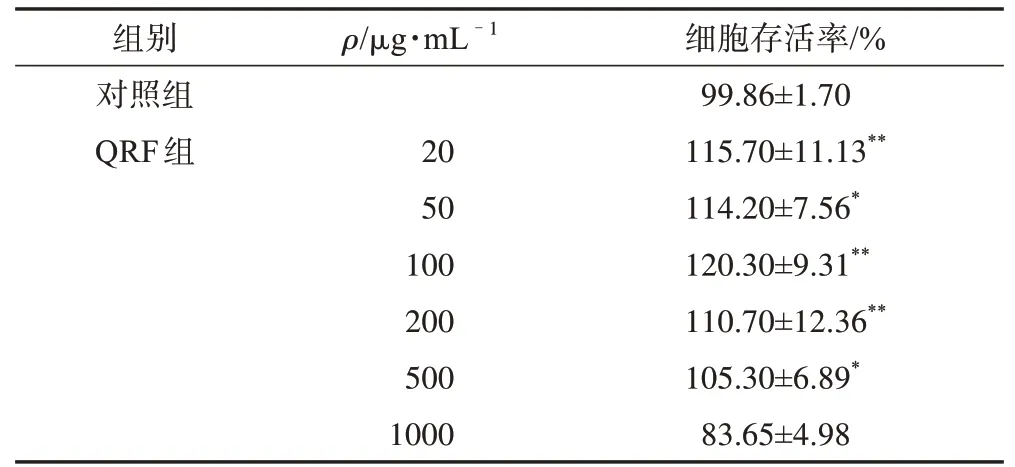
表4 QRF对RAW264.7细胞增殖的影响(,n=5)
注:与对照组比较,*P<0.05,**P<0.01。
QRF 的体外抗炎作用结果见表5。模型组细胞TNF‑α的释放量显著高于对照组(P<0.001)。与模型组相比,QRF 各给药组对细胞TNF‑α释放量呈剂量依赖性降低,其中以QRF 200 μg·mL-1组最为显著(P<0.01)。由此可见,QRF 可抑制LPS 诱导的RAW264.7细胞中炎症因子TNF‑α的释放。
表5 QRF对RAW 264.7细胞TNF-α分泌量的影响(,n=3)

表5 QRF对RAW 264.7细胞TNF-α分泌量的影响(,n=3)
注:与对照组比较,***P<0.001;与模型组比较,#P<0.05,##P<0.01。
4 讨论
OA为退行性关节疾病,不同于风湿性关节炎和系统性狼疮,OA不影响身体的其他器官。年龄、外伤、肥胖、发炎、劳损、遗传、骨质疏松及皮质类固醇药物治疗致骨头坏死等多种因素均可诱发OA。临床中对于OA 的干预方式包括减轻体质量、锻炼、服用止痛药或消炎药、膝关节注射皮质类固醇或透明质酸、替代疗法(外用辣椒素软膏、针灸、补充剂包括葡萄糖胺和软骨素)、外用支架及手术等[21]。使用的止痛药及消炎药多应用非甾体类抗炎药物、阿片类镇痛药物、对乙酰氨基酚与阿片类复方制剂等[22‑23],但非甾体类抗炎药物、阿片类药物不良反应较明显[23‑24],且使用时对患者的限制条件较多。中医药不良反应相对较小,通过药物中的多种活性成分作用于多靶点进行干预,在OA 的治疗过程中发挥了重要作用[25‑26]。
本研究借助网络药理学方法,预测得出QRF 可能通过人参皂苷Re、人参皂苷Rb1、人参皂苷Rg1、熊果酸、獐牙菜苷元、山茱萸苷、马钱苷酸、龙胆碱等活性成分,作用于IL‑6、TNF、IL‑1β、PTGS2等靶点,调控IL‑17信号通路、TNF信号通路、类风湿关节炎、Th17 分化、Toll 样受体信号通路、破骨细胞分化等信号通路实现对OA的干预。
研究发现,在成骨细胞存在的前提下,IL‑6 和可溶性IL‑6 受体结合,增加破骨细胞形成、分化,从而刺激骨吸收[27]。IL‑1 是与软骨破坏息息相关的细胞因子,可促进金属蛋白酶(MMPs)的生成,抑制金属蛋白酶组织抑制因子‑1(TIMP‑1),使TIMP‑1 与MMPs 处于失衡状态,从而引起软骨分解;另一方面,IL‑1 又可刺激滑膜细胞生成、释放脂质类代谢物质前列腺素E2(PGE2),引发滑膜炎症,PGE2 反作用于IL‑1,强化其对软骨的分解。IL‑1α和IL‑1β是IL‑1 的2 种不同的分子形式。在正常人软骨细胞中,IL‑1 仅存在于上层软骨的个别细胞中,但是在OA 患者上层软骨细胞及细胞外基质均可见强阳性的IL‑1α和IL‑1β。IL‑1β刺激软骨细胞释放MMP‑1、MMP‑3 及MMP‑13,这3 种蛋白酶是软骨破坏的关键调节因子,是与软骨破坏息息相关的细胞因子[28]。已有研究在类风湿性关节炎患者的关节滑液中检测到TNF‑α,患者体内产生大量炎症因子,导致血中TNF‑α、IL‑6 增加,激活炎症反应,表现出发热、疼痛等一系列炎症反应症状[29]。PTGS参与花生四烯酸代谢途径。PTGS2作为前列腺素G/H合酶家族中的1 种诱导型同工酶,参与炎症反应及前列腺素类的生物合成。以上文献研究表明,IL‑6、IL‑1β、TNF‑α、PTGS2 在炎症、软骨关节的病理生理过程中起着重要的调节作用。
IL‑17 是炎症相关的细胞因子,与靶细胞上受体相结合,通过NF‑κB途径,诱导IL‑1β、IL‑6、TNF‑α等促炎因子的产生,上调NO、MMPs等水平,引发自身免疫性疾病、炎症反应等[30]。而IL‑17 细胞因子为Th17 的主要效应因子,在人体自身免疫及机体抵御病原体等各种免疫反应中起重要作用[31]。TNF 在OA 患者的滑液、滑膜及软骨中含量均显著升高,TNF 可抑制软骨细胞中Ⅱ型胶原蛋白的合成,刺激MMP‑1、MMP‑3 和MMP‑13 的释放,诱导产生IL‑6等活性因子[32]。类风湿性关节炎(RA)通路的活化可能参与骨破坏过程,文献报道,RA 患者的免疫系统异常激活,体内促炎因子、趋化因子水平升高,作用于滑膜成纤维细胞及成骨细胞,产生大量破骨细胞分化因子,影响破骨细胞的正常骨吸收;同时促炎因子升高致使滑膜成纤维细胞所释放的MMP‑1、MMP‑3 等高表达,造成关节破坏[33]。有研究表明,TLR 依赖性途径可激活NF‑κB 和下游转录因子,产生各种破坏性介质及自身抗体,从而导致骨关节功能性疼痛,结构性的软骨、骨畸形等一系列变化,TLR 可能是OA 与疼痛间的模式识别受体[34]。破骨细胞的生成与NF‑κB 受体激活子配体(RANKL)相关,炎症性关节滑膜成纤维细胞产生大量的RANKL 及TNF‑α、IL‑1 类促炎因子,刺激破骨细胞生成,致使关节部位骨丢失,从而导致关节部位僵硬、关节变形,进而发展为OA[35]。本研究预测出与炎症、关节疾病、破骨细胞分化相关的多条信号通路,可为QRF 干预OA 的相关研究提供参考。
珠子参的主要活性部位是珠子参总皂苷,其中人参皂苷Re、人参皂苷Rb1、人参皂苷Rg1等多种单体化合物已被证实具有抗炎活性。据文献报道,人参皂苷Re 能抑制LPS 与TLR4 结合,以及刺激小鼠腹腔巨噬细胞中NF‑κB的激活,抑制炎症因子TNF‑α和IL‑1β等的表达,减轻炎症反应[36]。人参皂苷Rb1可通过抑制IL‑6、IL‑1β、环氧化酶‑2(COX‑2)、PGE2等炎症介质,对单碘乙酸(MIA)所致去卵巢OA 大鼠起到软骨保护作用[37]。人参皂苷Rg1可剂量依赖性地抑制IL‑1β诱导的人软骨细胞中MMP‑13、COX‑2 和PGE2 的蛋白表达,并抑制Ⅱ型胶原降解,亦可减轻前交叉韧带横断(ACLT)诱导的OA 大鼠软骨退行性变[38]。熊果酸是山茱萸中一类三萜化合物,为山茱萸药物中的主要抗炎活性化合物,研究发现,熊果酸可剂量依赖性抑制酵母聚糖诱导的小鼠急性炎症气囊渗出液中PGE2 的产生,还能防止卡拉胶对大鼠足跖水肿的影响及醋酸所致小鼠扭体现象,具有抗炎、镇痛功能[39]。部分研究认为,熊果酸的抗炎机制与抑制脂氧合酶和环氧合酶活性、减少花生四烯酸级联反应产生的炎症因子密不可分[40]。山茱萸、秦艽中的活性成分獐牙菜苷元亦具有抗炎活性。Zhang等[41]研究发现獐牙菜苷元可显著抑制IL‑1β诱导的大鼠关节软骨细胞中PGE2的产生,降低MMP‑1、MMP‑3 和MMP‑13 mRNA 的表达,同时能够抑制IL‑1β所诱导的NF‑κB活化,推测其抗炎活性是通过抑制NF‑κB 信号转导介导的。龙胆碱为秦艽中主要活性成分,Kwak 等[42]研究发现龙胆碱可抑制LPS 诱导的雄性SD 大鼠血清中TNF‑α、IL‑6水平升高,从而减轻炎症反应。
分子对接构象筛选结果显示,网络药理学预测得到的活性成分与靶标蛋白结合亲和力较强,说明QRF 中活性成分对OA 的干预可能通过调控TNF‑α、IL‑6、IL‑1β、PTGS2 等相关因子实现。进一步通过QRF 干预炎症模型的体外实验验证了其对炎症因子TNF‑α有明确的调节作用。结合上述相关文献研究,证实这些活性化合物可以通过对体内炎症因子的调节,抑制炎症反应进程。因此,通过网络药理学及分子对接技术预测QRF 干预OA 具有一定的参考价值。
本研究仍存在一些不足之处:1)受限于网络药理学预测分析时使用的数据库的时效性及全面性,可能存在成分及疾病靶点更新不及时、不全面现象,从而使得预测结果可能存在一定的误差。2)在临床治疗中,中药或制剂在体内的相互作用机制尚不明确,无法将药物相互作用及在体内的反应纳入研究分析。3)网络药理学技术及分子对接技术用于初步的预测、筛选,其结果还需实验验证。后续课题组将在本课题的研究基础上,进一步对预测的结果进行验证。
综上所述,本研究通过网络药理学、分子对接技术及体外实验验证,预测得出QRF 主要可能通过抗炎、免疫调节等过程,发挥多靶点、多通路干预OA的作用,为QRF干预OA提供理论支撑。
