白藜芦醇对冲击波致小鼠脑组织炎症损伤影响研究
2022-04-11丛培芳史秀云马瑞珩金红旭
丛培芳, 刘 颖, 史秀云, 马瑞珩, 金红旭
北部战区总医院 急诊医学科,辽宁 沈阳 110016
爆震伤是指高速冲击波对人体器官和组织造成的损伤,可导致内伤和外伤。在各种损伤中,发生率较高的是冲击波造成的肺损伤和脑损伤[1]。冲击波可使脑组织发生氧化应激、炎症、凋亡反应,进而发生认知障碍和情绪焦虑,其中涉及多种机制[2]。白藜芦醇(resveratrol,RES)是从红酒、葡萄、浆果、虎杖、结缕草中提取的活性提取物[3],具有多种功能,如抗炎、抗氧化、抗癌、保护心血管等[4-5]。RES可抑制核因子(nuclear factor,NF)-κB的核转位和转录活性,抑制肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1β、IL-6的表达[6]。有研究报道,RES可减轻小鼠脑出血后的神经炎症,并发挥神经保护作用[7]。Xie等[8]发现,RES可通过抑制氧化应激和内质网应激减轻蛛网膜下腔出血后的脑损伤。在创伤性脑损伤中,RES可通过上调Sirt1增加星形胶质细胞的自噬,发挥神经保护作用[9]。本研究旨在观察RES对冲击波致小鼠脑组织炎症损伤的影响,并探讨其可能的分子机制。现报道如下。
1 材料与方法
1.1 实验动物及试剂 30只健康雄性C57BL/6小鼠购自沈阳艾科赛斯生物科技有限公司;RES购自西安高远生物科技有限公司;IL-1β和IL-6的酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自南京森贝伽生物科技有限公司; 高迁移率族蛋白B(high mobility group box 1,HMGB1)、toll样受体(toll-like receptors,TLR)4、TNF-α、S100β、NF-κB抗体购自英国Abcam公司。实验设计得到北部战区总医院动物伦理委员会许可。
1.2 研究方法
1.2.1 实验分组及模型建立 将30只C57BL/6小鼠随机分入对照组(Control组)、爆震组(Blast组)、爆震+给药组(RES组),每组各10只。采用自主研发的爆震伤装置建立小鼠脑损伤模型,冲击波强度为(115.8±10.4)PSI。小鼠提前1 d禁食水,用2%戊巴比妥钠(1.5 ml/kg)腹腔麻醉小鼠,将Blast组和RES组置于防护装置内进行头部爆震。RES组于建模前1周给予30 mg/kg RES干预, 腹腔注射,每天1次。于爆震后24 h麻醉处死所有小鼠,收集血清及脑组织标本。采用HE染色,观察小鼠脑组织病理学改变。
1.2.2 Y迷宫 采用Y迷宫测试爆震后24 h小鼠的记忆能力。在测试的前1 d,小鼠需要接受训练。禁食过夜后,将小鼠放入起始臂自由探索并找到食物臂。每天接受2次训练,每次5 min。然后继续禁食到第2天进行测试。在测试阶段,任何手臂都没有食物。将1只小鼠放在Y迷宫的起始臂,让其自由移动5 min,监测食物臂的进入和持续时间。
1.2.3 HE染色 将取材的脑组织在室温下固定在10%甲醛缓冲液中,并通过徕卡微系统组织处理器(ASP 300S,德国)将其包埋在石蜡中。进行4 μm厚的切片后,HE染色并在光学显微镜下检查。
1.2.4 ELISA检测 将血清在4℃融化,按说明书所示,与标准品一起加入到抗原包被的96孔板中,37℃孵育,甩干。加入Detection A溶液孵育30 min,甩干洗板后再加入Detection B溶液孵育30 min,甩干洗板后显色。检测每个孔的吸光度,根据标准曲线计算出血清内所含IL-1β和IL-6的浓度。
1.2.5 Western blot检测 采用Western blot技术检测脑组织HMGB1/TLR4/NF-κB信号通路蛋白及炎症相关蛋白TNF-α、S100β的表达。

2 结果
2.1 各组小鼠冲击后Y迷宫结果比较 与Control组比较,Blast组进入食物臂的次数和位于食物臂的总时间显著减少(P<0.05)。与Blast组比较,RES组在食物臂的进入次数有所增加,在食物臂的总时间明显延长(P<0.05)。见图1。
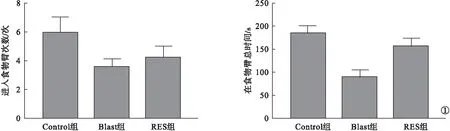
图1 各组小鼠冲击后Y迷宫结果比较
2.2 各组小鼠冲击后炎症反应比较 与Control组比较,Blast组小鼠血清内炎症因子IL-1β和IL-6明显升高(P<0.05)。与Blast组比较,RES组小鼠血清内炎症因子IL-1β和IL-6表达降低(P<0.05)。见图2。
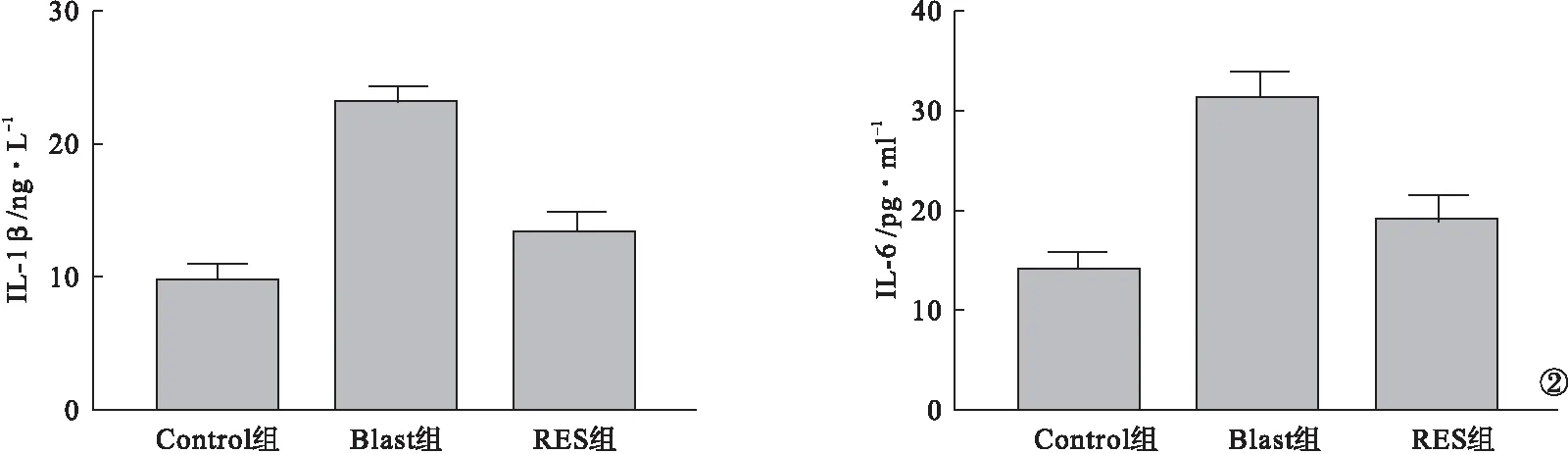
图2 各组小鼠冲击后炎症反应比较
2.3 各组小鼠冲击后脑组织病理改变比较 与Control组比较,Blast组小鼠脑组织内存在细胞变性和炎症细胞浸润。与Blast组比较,RES组小鼠脑组织内细胞变性明显缓解,炎症细胞浸润明显减轻。见图3。
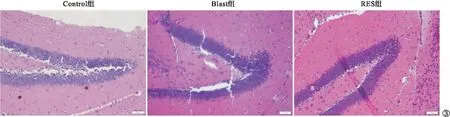
图3 各组小鼠冲击后脑组织病理改变比较
2.4 各组小鼠冲击后脑组织内炎症相关蛋白比较 与Control组比较,Blast组小鼠脑组织内炎症相关蛋白TNF-α和S100β明显升高(P<0.05)。与Blast组比较,RES组小鼠脑组织内炎症相关蛋白TNF-α和S100β明显降低(P<0.05)。见图4。
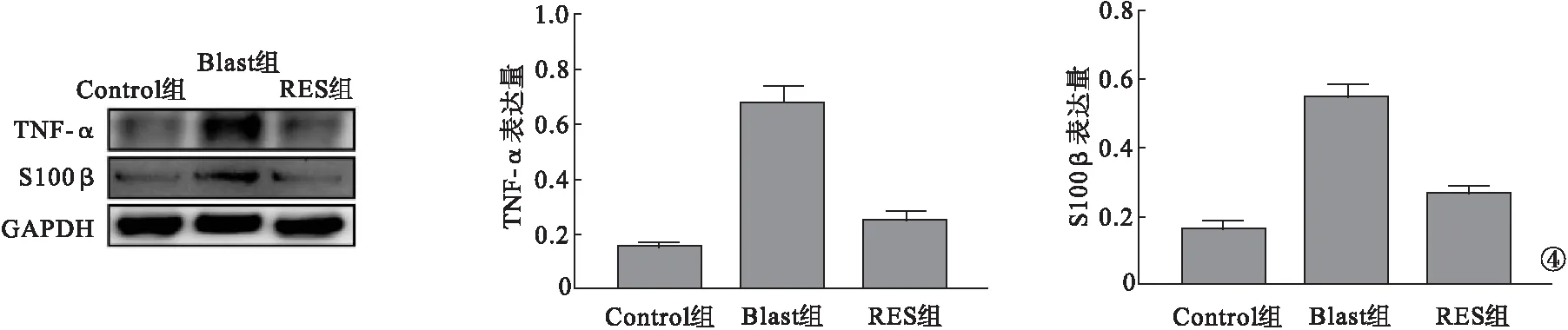
图4 各组小鼠冲击后脑组织内炎症相关蛋白比较
2.5 各组小鼠冲击后脑组织HMGB1/TLR4/NF-κB信号通路表达比较 与Control组比较,Blast组小鼠脑组织内HMGB1、TLR4、NF-κB蛋白表达均显著升高(P<0.05)。与Blast组比较,RES组小鼠脑组织内HMGB1、TLR4、NF-κB蛋白表达显著减少(P<0.05)。见图5。
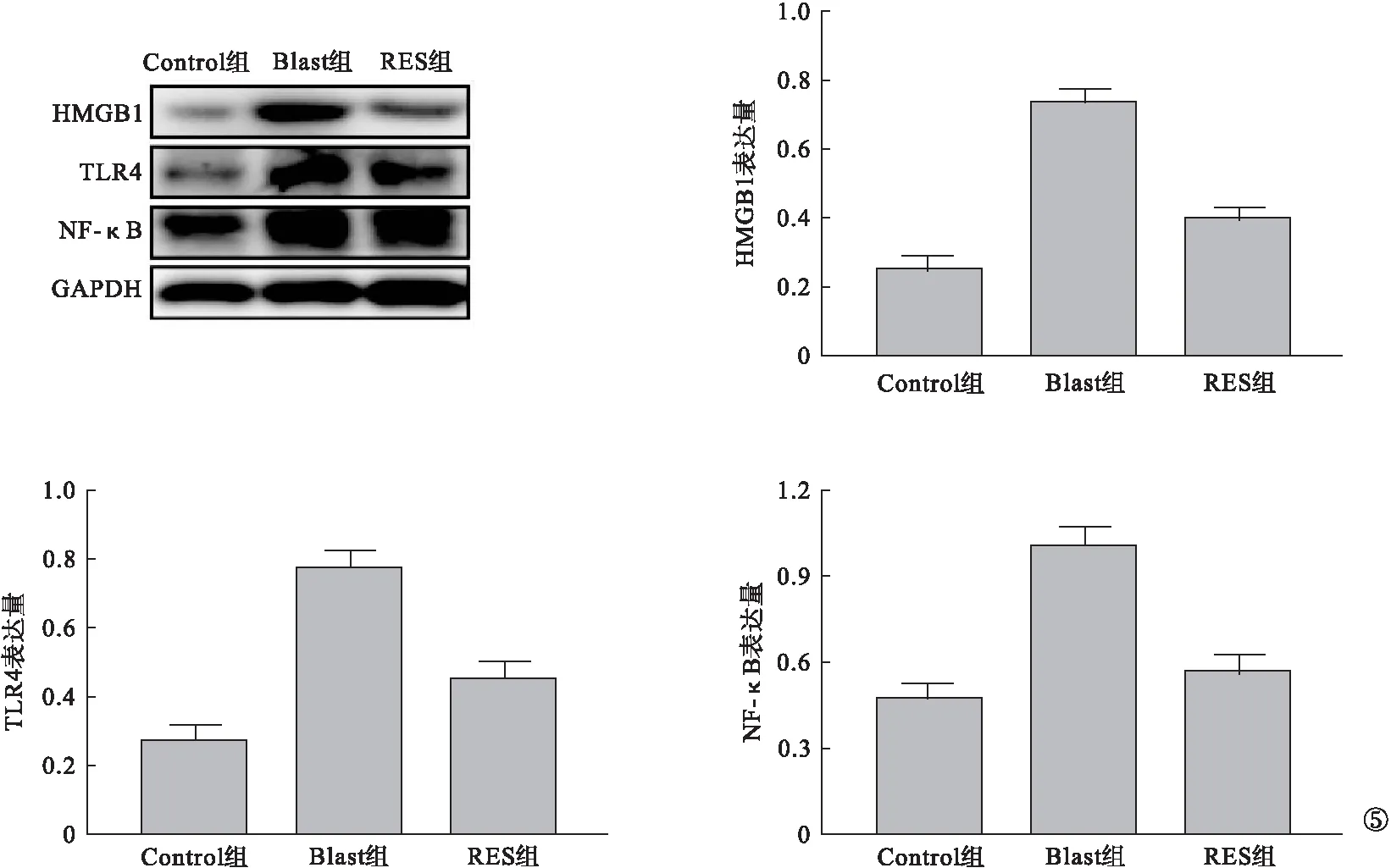
图5 各组小鼠冲击后脑组织HMGB1/TLR4/NF-κB信号通路表达比较
3 讨论
近年来,煤气爆炸及化学爆炸等各种社会事件的发生使得爆震伤在平民中的发生逐渐增多,冲击波所致的脑损伤会影响人们的记忆并造成功能不全,给家庭和社会造成很大负担。因此,了解其中涉及的病理生理机制和开发新的治疗策略至关重要。
RES作为一种天然活性成分已被广泛研究。除了抗炎、抗氧化、抗凋亡等生物活性外,还被证实具有神经保护作用。有研究报道,RES可以通过调节线粒体蛋白质、3-硝基酪氨酸、4-羟基壬烯酸的氧化损伤以及线粒体复合物Ⅰ的活性,从而对癫痫症产生有益影响[10]。Malaguarnera等[11]发现,RES可显著减弱炎症反应和氧化应激。本研究观察到RES能够改善血清炎症因子水平和脑组织炎症,同时可使冲击波引起的记忆能力下降得到缓解。
TLR4是一种模式识别受体,在检测保守的致病相关分子模式和内源性损伤相关分子模式中具有重要作用。HMGB1是一种广泛表达的非组蛋白核蛋白,能够激发和放大脑外伤后的非感染性炎症反应[12]。炎症细胞分泌后,HMGB1可与小胶质细胞上的TLR4相互作用,启动免疫反应,激活髓系分化因子88信号,导致NF-κB移位到细胞核,与特定的DNA序列结合,促进炎症细胞因子基因的转录[13]。NF-κB是一种蛋白质复合物,存在于几乎所有类型的动物细胞中,参与炎症、凋亡、免疫反应、细胞生长和发育等过程。有研究表明,中枢神经系统中的NF-κB信号可激活星形胶质细胞并产生促炎因子,在神经元损伤的细胞反应和突触可塑性中起着重要的生理作用[14]。还有研究表明,通过调节HMGB1/NF-κB易位可减轻脂多糖诱导的脓毒症及其产生的炎症反应。Le等[15]发现,RES通过激活SIRT1抑制HMGB1/TLR4/MyD88/NF-κB信号和随后的神经炎症反应,在新生儿缺氧缺血性脑损伤中发挥神经保护作用。本研究发现,RES处理可抑制HMGB1/TLR4/NF-κB信号通路,降低TNF-α和S100β蛋白表达,对小鼠脑损伤引起的脑内炎症反应具有保护作用。
综上所述,RES干预对冲击波致小鼠脑组织炎症损伤有保护作用,其机制可能与抑制HMGB1/TLR4/NF-κB信号通路相关。
