LIPI评分系统对非小细胞肺癌免疫治疗患者预后预测价值研究
2022-04-11许天齐马成才宋立强
周 英, 吴 蕾, 许天齐, 马成才, 宋立强, 张 艰
1.空军军医大学西京医院 呼吸与危重症医学科,陕西 西安 710061;2.西安市第八医院 感染科,陕西 西安 710049
非小细胞肺癌(non-small cell lung cancer,NSCLC)的治疗经历了细胞毒性化疗药物、靶向治疗、免疫治疗等过程,而免疫治疗为NSCLC提供了新的治疗策略[1]。目前,临床上免疫治疗应用较为广泛的是免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)[2]。但有研究报道,80%的NSCLC患者不能从ICIs中获益,甚至出现严重的免疫毒性[3]。因此,使用预测生物标志物筛选出可能获益的患者十分重要。目前,临床常使用的标志物是PD-L1表达量。有研究发现,PD-L1高表达患者使用免疫治疗具有更佳的总生存期和无进展生存期(progression-free survival,PFS)[3-5]。但是,免疫治疗并未在所有PD-L1表达阳性的患者中获益[4]。Mezquita等[6]第一次提出了肺癌免疫治疗预后指标(lung immune prognostic index,LIPI),并发现不良LIPI与较差的PFS相关。但是,LIPI在中国人群NSCLC患者免疫治疗中的预测价值尚不完全清楚。一些潜在的生物标志物,如中性粒细胞与淋巴细胞的比率(neutrophil to lymphocyte ratio,NLR)[7-8]、衍生的中性粒细胞与淋巴细胞的比率(derived neutrophil to lymphocyte ratio,dNLR)[9-10]等与癌症的免疫治疗预后相关。本研究旨在探讨由乳酸脱氢酶(lactic dehydrogenase,LDH)联合dNLR组成的LIPI对NSCLC免疫治疗患者预后的预测价值。现报道如下。
1 对象与方法
1.1 研究对象 回顾性分析自2018年1月至2019年7月空军军医大学西京医院与唐都医院收治的86例接受免疫治疗的NSCLC患者的临床资料。纳入标准:(1)年龄≥18岁;(2)组织学或细胞学证实为NSCLC;(3)根据实体瘤评估标准[11]对病灶进行过至少一次评估;(4)使用PD-1抑制剂免疫治疗。排除标准:(1)治疗前1周有持续非癌症相关炎症、免疫性疾病、终末期肝病或血液病者;(2)表皮生长因子突变或ALK、ROS1基因融合者;(3)既往有其他癌症或伴发其他癌症者;(4)对免疫治疗过敏或不耐受者。根据dNLR>3和LDH>250 IU/L 2个因素将患者分为3组,即良好LIPI组(含0个因素,n=31)、中等LIPI组(含1个因素,n=38)、不良LIPI组(含2个因素,n=17)。本研究经空军军医大学西京医院医学伦理委员会批准(KY20202077-C-1)。
1.2 治疗方法 确诊NSCLC患者一线或二线及后线使用PD-1抑制剂免疫治疗,单用免疫治疗或联合其他方案,其中免疫治疗药物有Pembrolizumab、Nivolumab和信迪利单抗。
1.3 观察指标及疗效评价标准 收集患者免疫治疗前的一般资料,包括性别、年龄、吸烟史、临床病理分期、转移脏器数、免疫治疗药物、免疫治疗线数、免疫治疗方式,以及治疗前2周内的中性粒细胞、淋巴细胞绝对值、红细胞分布宽度、血小板计数、dNLR、血小板与淋巴细胞比值、白细胞计数、LDH等血液学基线参数。疗效评价标准:完全缓解,所有靶病灶消失,无新病灶出现,且肿瘤标志物正常,至少维持4周;部分缓解,靶病灶最大径之和减少≥30%,至少维持4周;疾病稳定,靶病灶最大径之和缩小未达完全缓解,或增大未达疾病进展;疾病进展,靶病灶最大径之和至少增加≥20%,或出现新病灶。
客观缓解率=(完全缓解+部分缓解)例数/总例数×100%
疾病控制率=(完全缓解+部分缓解+疾病稳定)例数/总例数×100%

2 结果
2.1 各组患者一般资料比较 3组患者男性比例、年龄、病理分型、免疫治疗线数、免疫治疗方式、免疫治疗药物、转移脏器、临床病理分期、红细胞分布宽度、血小板计数比较,差异无统计学意义(P>0.05)。3组患者吸烟史、中性粒细胞、淋巴细胞绝对值、dNLR、血小板与淋巴细胞比值、白细胞计数、LDH比较,差异有统计学意义(P<0.05)。见表1。
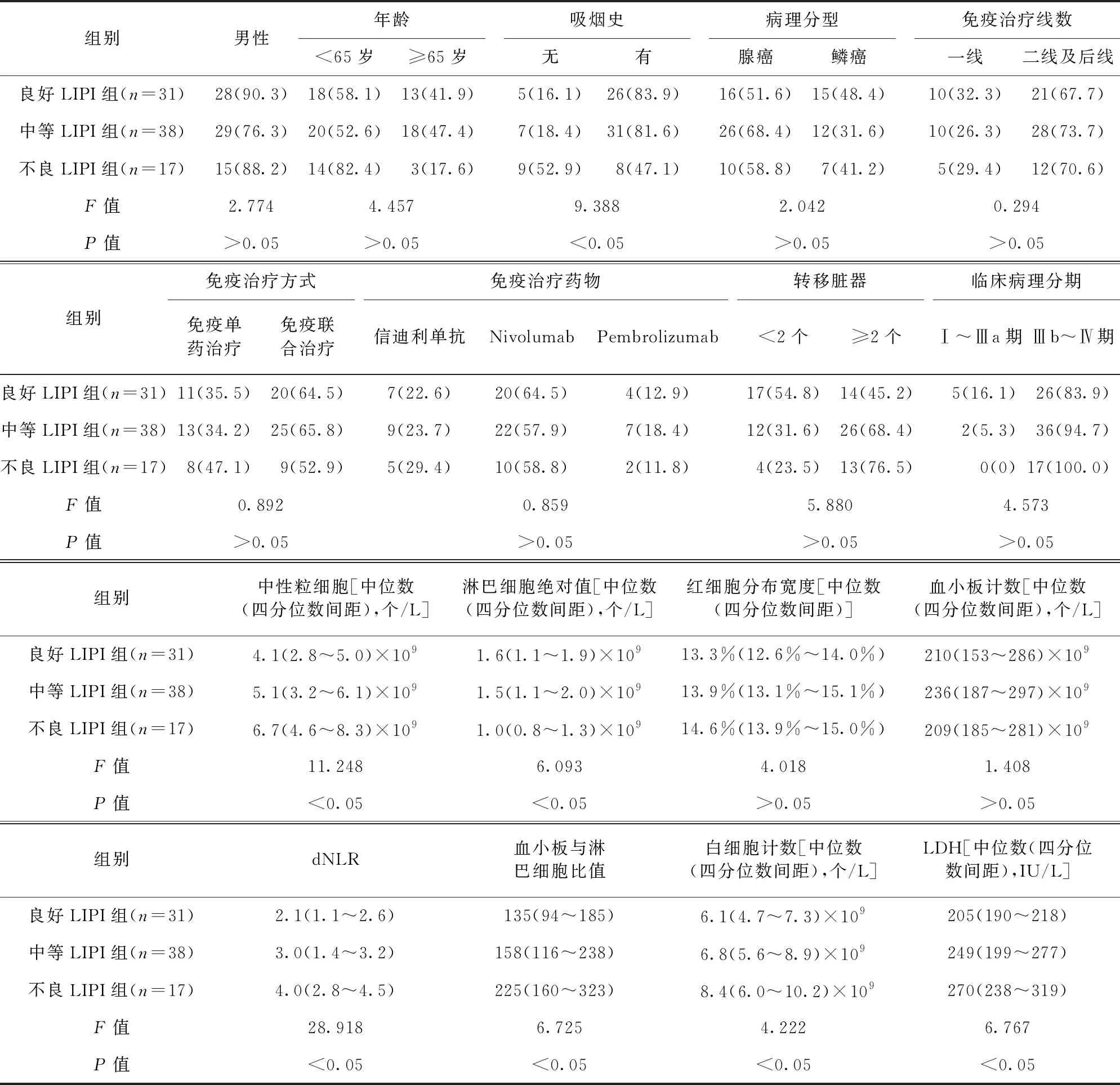
表1 各组患者一般资料比较/例(百分率)
2.2 各组患者疾病控制率、客观缓解率比较 各组患者客观缓解率、疾病控制率比较,差异无统计学意义(P>0.05)。见表2。
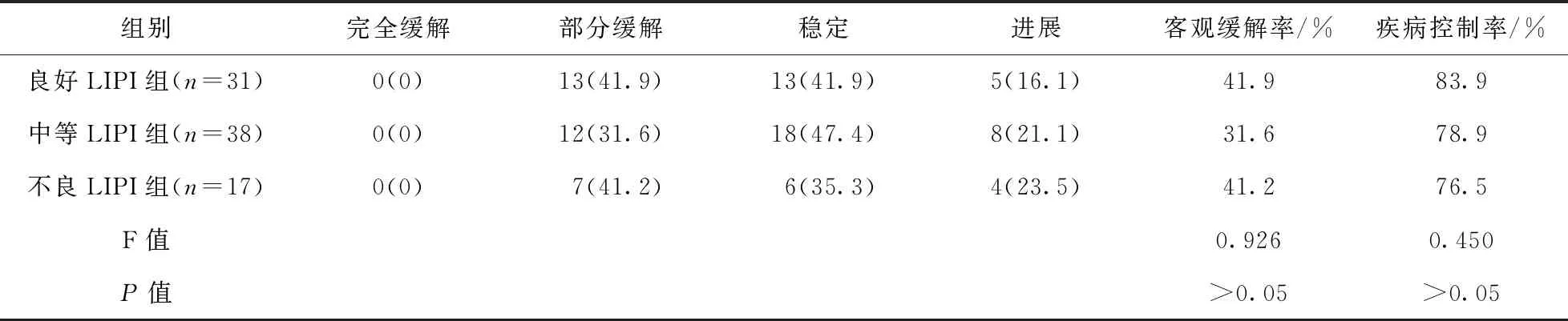
表2 各组患者疾病控制率、客观缓解率比较/例(百分率/%)
2.3 NSCLC免疫治疗预后影响因素分析 所有NSCLC患者的中位PFS为5.8个月。单因素Cox风险回归模型分析结果表明,转移脏器数≥2个的免疫治疗患者疾病进展风险明显高于转移脏器数<2个患者(危险比=2.16,95%可信区间1.17~4.01,P<0.05);中等LIPI疾病进展风险明显高于良好LIPI(危险比=1.45,95%可信区间1.21~2.77,P<0.05);不良LIPI疾病进展风险明显高于良好LIPI(危险比=2.96,95%可信区间1.41~5.91,P<0.05)。多因素Cox风险回归模型分析结果显示,LIPI是接受免疫治疗NSCLC患者预后的独立危险因素(P<0.05)。见图1。

图1 NSCLC患者免疫治疗预后的影响因素分析(a.单因素分析;b.多因素分析)
2.4 各组患者PFS比较 不良LIPI组PFS为4.3个月,中等LIPI组PFS为5.8个月,良好LIPI组PFS为7.5个月。Kaplan-Meier生存曲线显示,不良LIPI组、中等LIPI组PFS低于良好LIPI组,差异有统计学意义(P<0.05)。见图2。
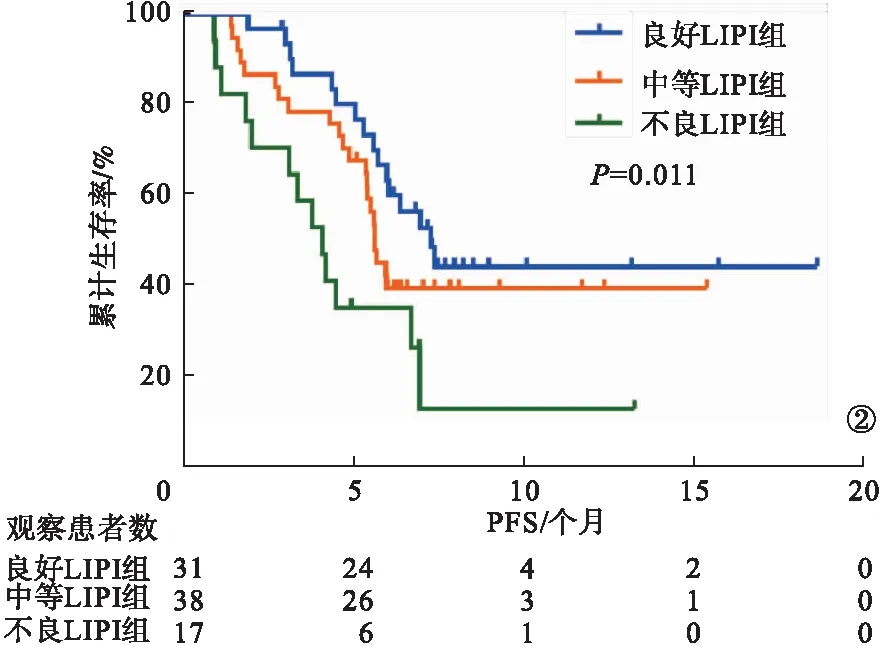
图2 Kaplan-Meier生存曲线
3 讨论
全身炎症反应与肿瘤的发生、发展密切相关,而外周促炎状态与癌症患者的不良预后有关[7-8,12-17]。系统性炎症反应的生物标志物(C-反应蛋白、白蛋白、LDH、中性粒细胞、淋巴细胞等)与NSCLC患者不良预后相关[7-8,12-13]。中性粒细胞作为一种炎症反应细胞,通过抑制免疫细胞,尤其通过是活化T细胞的细胞毒性抑制抗肿瘤免疫反应[16]。有研究发现,血清LDH水平升高与许多实体肿瘤的不良预后有关,如黑色素瘤、肺癌等[18-21]。Mezquita等[6]联合dNLR>3和LDH>正常值上限提出了LIPI这一概念。该研究分析了466例接受ICIs治疗的NSCLC患者,结果显示,良好LIPI组、中等LIPI组及不良LIPI组的PFS分别为6.3个月、3.7个月、2.0个月,总生存期分别为34个月、10个月、3个月,表明高风险LIPI与较差的PFS和总生存期相关[6]。
本研究结果显示,中等LIPI疾病进展风险明显高于良好LIPI,不良LIPI疾病进展风险明显高于良好LIPI;多因素Cox风险回归模型分析结果显示,LIPI是接受免疫治疗NSCLC患者预后的独立危险因素(P<0.05);Kaplan-Meier生存曲线显示,不良LIPI组、中等LIPI组PFS低于良好LIPI组(P<0.05),提示LIPI与NSCLC免疫治疗不良预后相关。本研究中,各组患者客观缓解率、疾病控制率比较,差异无统计学意义(P>0.05)。但Mezquita等[6]研究显示,LIPI与疾病控制率相关,原因可能为本研究纳入样本相对较少,需要扩大样本量进一步研究LIPI与疾病控制率的相关性。本研究存在一定的局限性,本研究属于回顾性研究,部分临床数据缺失或不完整;其次,因部分患者免疫治疗属于二线或后线治疗,PD-L1的表达状态未知[22]。
综上所述,LIPI与NSCLC免疫治疗不良预后相关,通过LIPI可筛选出无法从免疫治疗中获益的患者,避免不必要的免疫毒性和经济负担。
