雷贝拉唑联合生长抑素在肝硬化上消化道出血患者治疗中的应用
2022-04-11宋均亚
宋均亚
摘要:目的 探究雷贝拉唑联合生长抑素治疗肝硬化上消化道出血患者的效果。方法 我院2021.01-2021.12收治86例肝硬化上消化道出血患者,随机分为甲组(43例,雷贝拉唑治疗)、乙组(43例,雷贝拉唑联合生长抑素治疗),比较两组治疗效果。结果 乙组治疗总有效率93.02%明显高于甲组76.74%(P<0.05);乙组止血时间、症状改善时间和住院时间均短于甲组(P<0.05)。结论 雷贝拉唑联合生长抑素治疗肝硬化上消化道出血,治疗效果显著,可以缩短患者住院时间,具有推广价值。
关键词:肝硬化;上消化道出血;雷贝拉唑;生长抑素
【中图分类号】 R657.3+1 【文献标识码】 A 【文章编号】2107-2306(2022)05--01
前言:肝硬化是一种较为严重的肝脏损伤,其主要同长期大量饮酒、慢性病毒性肝炎、自身免疫性肝炎、胆汁淤积、家族遗传等因素有关,疾病若不予以及时治疗,可导致肝内静脉回流受阻,胃底食管静脉曲张,进而引起上消化道出血,严重损害患者身体健康[1]。雷贝拉唑是治疗肝硬化上消化道出血常用药物,其可以抑制胃酸分泌,稳定血凝块,同生长抑素联合应用可进一步提升治疗效果,缩短止血时间[2]。基于此,本研究将以86例肝硬化上消化道出血患者为例,通过分组治疗来进一步分析雷贝拉唑联合生长抑素治疗效果。
1资料与方法
1.1一般资料
研究对象为我院2021年1月~2021年12月收治86例肝硬化上消化道出血患者,随机分为甲、乙两组,各43例。其中甲组,男25例,女18例,年龄37~78岁,平均(52.32±5.78)岁。乙组,男26例,女17例,年龄40~76岁,平均(51.87±5.64)岁。对比两组基本资料,均衡可比(P>0.05)。
1.2方法
甲组:运用5ml0.9%NaCl溶解20克雷贝拉唑(南京长澳制药有限公司,国药准字H20140055),5-10分钟后将药液同100ml0.9%NaCl注射液混合后对患者静脉滴注(20-30分钟),每天两次,持续用药3天。
乙组:雷贝拉唑使用方法和剂量同上,为患者静脉缓慢推注0.25mg生长抑素(南京长澳制药有限公司,国药准字H20043583),之后微量泵持续静脉输注用药,速度维持在每小时0.25mg,患者持续用药3天。
1.3观察指标
患者临床症状完全消失,生命体征稳定,血红蛋白指标恢复正常水平,为显效;患者临床症状明显减轻,生命体征趋于稳定,血红蛋白指标显著改善,为有效;临床症状和血红蛋白指标均无明显变化或有加重,为无效。治疗总有效率纳入前两项。调查两组出血时间、症状改善时间和住院时间。
1.4统计方法
采用SPSS24.0统计软件进行数据分析,(x±s)描述计量资料,以t检验,计数资料采用率(%)表示,以卡方检验,P<0.05,代表数据对比有差异性。
2结果
2.1临床疗效
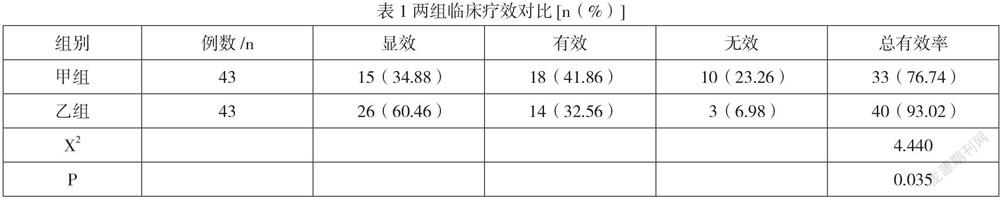
乙组治疗总有效率93.02%明显高于甲组76.74%(P<0.05),如表1所示。
2.2 康复相关指标
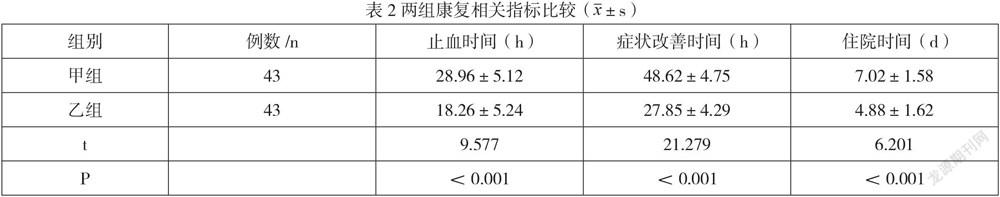
乙组止血时间、症状改善时间和住院时间均短于甲组(P<0.05),如表2所示。
3 讨论
近些年随着生活方式、饮食习惯等诸多因素影响,肝硬化发生率逐年升高,疾病长期反复发作得不到有效控制,将导致门静脉高压,进而引起消化黏膜水肿糜烂,曲张食道、胃底静脉破裂出血,患者将出现呕血、柏油样便、头晕等症状,若治疗不及时,可能危及患者生命安全。相关研究表明,对肝硬化上消化道出血患者采用雷贝拉唑联合生长抑素治疗,可以提升止血效果,降低患者机体炎性因子水平,药物不良反应发生率较低,具有安全性[3]。雷贝拉唑是质子泵抑制剂,其可以特异性的抑制胃壁细胞的氢-钾ATP酶,减少胃酸分泌量,降低胃内酸程度,保护胃肠道黏膜。生长抑素可以抑制胃蛋白酶、胃泌素释放,降低门静脉压力,调节胃肠道环境,改善血管平滑肌收缩,促进血小板凝集,实现止血目的[4]。本研究调查显示:乙组治疗总有效率高于甲组;且乙组止血时间、症状改善时间和住院时间短于甲组,体现了雷贝拉唑联合生长抑素治疗有效性。
综上所述,对肝硬化上消化道出血患者应用雷贝拉唑联合生长抑素治疗,可提高临床治疗效果,促使患者早日恢复健康。
参考文献:
[1]黄凌.肝硬化上消化道出血治疗中應用生长抑素联合奥美拉唑的效果及护理干预措施[J].北方药学,2021,18(02):146-147.
[2]姜红波,王力,孙影哲.生长抑素联合奥美拉唑治疗肝硬化上消化道出血40例患者临床分析[J].贵州医药,2021,45(08):1246-1247.
[3]熊劲松.雷贝拉唑联合生长抑素治疗肝硬化上消化道出血患者的临床疗效[J].血栓与止血学,2022,28(04):623-624.
[4]张朝柱,何明霞,王清,等.雷贝拉唑联合奥曲肽治疗肝硬化上消化道出血的临床研究[J].临床合理用药杂志,2020,13(34):62-63.
