咪唑乙烟酸对谷子生理特性及产量构成的影响
2022-04-09贺晓勇孙大生杨雪萍原向阳宋喜娥郭平毅杨雪芳
贺晓勇, 孙大生, 杨雪萍, 原向阳, 宋喜娥,姚 翔, 郭平毅, 杨雪芳*,
(1. 山西农业大学 农学院,山西 太谷 030801;2. 山西农业大学 资源与环境学院,山西 太谷 030801;3. 山西省繁峙县平型关镇政府,山西 繁峙 034300)
除草剂作为一种非生物胁迫,对作物的生长发育会产生影响,但同一作物的不同品种对除草剂的抗药性存在较大差异[1]。阐明抗性作物的抗药性机制是目前提高优质除草剂对作物的安全性,扩大其应用范围最重要的措施之一。侯珍等[2]研究表明,不同小麦品种对双氟磺草胺的抗药性不同,泰山9 818、山农6 号和潍麦8 号抗药性较强,而济宁13 抗性最弱。谢娜等[3]研究发现,不同玉米品种对氯吡嘧磺隆的耐药性也存在差异。调节体内生理代谢的动态平衡是抗性品种主要的抗性解毒机理[4-5]。同一作物抗除草剂品种在经除草剂胁迫后,通过一系列的逆境生理变化,可使自身的生长发育维持在正常水平,而敏感品种在经除草剂胁迫后,正常的生理代谢会遭到破坏,生长发育受到抑制[6]。Wang 等[7]研究表明,烟嘧磺隆胁迫下,糯玉米沈糯509-抗比近等基因型沈糯509-感的抗性强,其体内抗氧化酶 (SOD、POD、CAT) 活性和抗氧化物质含量显著高于沈糯509-感。胡海军等[8]研究表明,随着烟嘧磺隆浓度增加,抗性玉米品种光合色素含量、净光合速率及叶绿素荧光参数的变化幅度均小于常规品种。
目前,谷田中可用的除草剂较少,现登记用于谷田的除草剂对谷子安全性较差[9]。咪唑乙烟酸(imazethapyr) 是一种咪唑啉酮类除草剂,属于乙酰乳酸合成酶 (ALS) 抑制型除草剂,具有活性高、杀草谱宽、选择性强的特点[10],可兼杀单、双子叶杂草。咪唑乙烟酸通过抑制ALS 活性,使植物体内支链氨基酸的合成受阻,代谢紊乱,最终抑制植物的生长,降低叶片内光合色素含量,影响抗氧化酶活性及丙二醛(MDA)含量[11-13]。由于该除草剂对禾本科作物安全性较差,目前仅被用于大豆Glycine max(L.) Merrill.、花生Arachis hypogaeaLinn.等豆科作物田杂草的防除[14]。鉴于其除草效果好,目前已成功筛选或培育出了水稻Oryza sativaL.、谷子Setaria italica(L.) Beauv. 等抗咪唑乙烟酸禾本科作物的种质资源[15-16],但对其抗性机理研究较少。
河北农林科学院谷子研究所利用谷子的近缘植物青狗尾草Setaria virisis为育种材料,通过谷子与抗咪唑乙烟酸的青狗尾草远缘杂交和回交等方法创制出了冀谷33 和冀谷35 等抗咪唑乙烟酸的谷子新品种[12,16]。Wang 等研究发现,通过单分子实时测序和高通量染色体构象捕获(Hi-C)技术组装基因组的谷子品种Huagu11,其与敏感品种豫谷1 号对咪唑乙烟酸的抗性存在差异,其主要原因是调控ALS 酶的基因发生了突变[17]。目前咪唑乙烟酸在谷子中的研究主要集中在创制抗咪唑乙烟酸的谷子品种及其在谷田除草表现[18-19],而对抗性品种与常规品种在咪唑乙烟酸胁迫后的响应差异的研究较少,对于通过远缘杂交和回交培育出的抗性谷子品种的抗性机理及咪唑乙烟酸对谷子的光合荧光、抗氧化系统等生理特性和田间产量构成的影响也未见报道。因此,本研究拟通过比较抗性谷子品种与常规品种在喷施咪唑乙烟酸后生长和生理代谢差异及其对谷子产量构成性状的影响,揭示不同品种谷子对咪唑乙烟酸的抗性差异以及抗性品种的抗药性机理,为开发高效安全的谷田除草剂,推进谷子产业发展提供理论依据。
1 材料与方法
1.1 供试材料
供试谷子Setaria italica(L.) Beauv. 品种:1 个抗咪唑乙烟酸品种 (冀谷35) 和7 个常规品种 (晋谷21、晋谷59、冀谷38、冀谷41、龙谷39、长农44 及中谷9),均保存于山西农业大学农学院作物化学调控研究室。
药剂与试剂:50 g/L 咪唑乙烟酸水剂 (imazethapyr AS),吉林金秋农药有限公司;氯化硝基四氮唑蓝 (NBT),上海蓝季科技发展有限公司;愈创木酚 (分析纯),天津市大茂化学试剂厂;硫代巴比妥酸 (分析纯),天津市光复精细化工研究所;核黄素和三氯乙酸 (TCA),国药集团化学试剂有限公司;乙酰乳酸合成酶 (ALS) 酶联免疫分析 (ELISA) 试剂盒[包括ALS 标准品、辣根过氧化物酶 (HRP)、3,3′,5,5′-四甲基联苯胺 (TMB)、洗涤液、终止液],厦门仑昌硕生物科技有限公司。
主要仪器:DUAL-PAM-100 叶绿素荧光仪,德国WALZ 公司;UV 2 400 紫外可见分光光度计,上海舜宇恒平科学仪器有限公司;Sunrise 酶标仪,瑞士TECAN 公司;3-18KS 高速冷冻离心机,德国SIGMA 公司;CP153 千分之一分析天平,奥豪斯仪器有限公司;BIC-300 人工气候箱,上海博讯实业有限公司;3WBD-18 型电动喷雾器,山东鲁农现代农业发展有限公司。
1.2 盆栽试验
盆栽试验于2019 年6—10 月在山西农业大学农学院作物化学调控实验室进行。试验所用育苗基质为水藓泥炭土 (丹麦品氏托普生产),所用塑料花盆规格为7 cm × 7 cm × 9 cm。选取均匀、饱满的谷种,每盆播种20 粒,覆土后置于人工气候箱中 (光照条件下温度为28 ℃,黑暗条件下温度为18 ℃,光照周期为L : D=16 h : 8 h,相对湿度为35%~45%) 培养,幼苗生长期间通过底部渗灌方式补充所需水分。待谷子长至2 叶期时定苗,每盆定植长势一致的谷苗5 株。待幼苗长至3~4 叶期时使用500 mL 手压式喷壶施药。试验组(T) 按豆科作物田的推荐剂量有效成分93.5 g/hm2(水剂用量1.87 L/hm2,兑水750 kg/hm2) 喷施咪唑乙烟酸[20];对照组 (CK) 喷施等量的清水。于施药后7 d 测定地上部分鲜重、叶片光合色素含量、叶绿素荧光参数、抗氧化保护酶活性和丙二醛 (MDA)含量。
选择抗性品种冀谷35 和与其同系列且地上部分鲜重受咪唑乙烟酸抑制较大的常规品种冀谷38 为研究对象,探究靶标酶ALS 对咪唑乙烟酸的响应。植株培养方式同上,分别于药后0、1、3、5、9、13、17 和21 d 取样,备用。
1.2.1 地上部分鲜重的测定 于施药后7 d,在每个处理中随机选择3 个重复,剪取谷苗的地上部分,用千分之一分析天平称重。
还可以利用多媒体将一些破坏环境的图片或视频播放出来,将环境受到破坏的情境展现出来,如水污染、土地沙化、臭氧层空洞等。通过这些触目惊心的图片,让学生明白环境保护的重要性。同时给出一些利用化学知识保护环境的方法,如,尽量减少塑料袋的使用、少用或不用一次性筷子等。或是组织学生讨论化工厂选址问题,通过亲自参与活动的方式,加深对化学知识的理解,树立起可持续发展理念,完成传统文化元素的渗透,提高化学教学质量。
1.2.2 叶片光合色素含量的测定 光合色素含量测定参考乙醇浸提法[21]。剪取0.05 g 谷子倒二叶叶片,置于具塞试管中,加入96%乙醇5 mL,置于黑暗环境中浸提至叶片失绿变白。以96%的乙醇为参比,用分光光度计测定A665、A649和A470。光合色素含量按公式 (1) ~ (4) 计算。
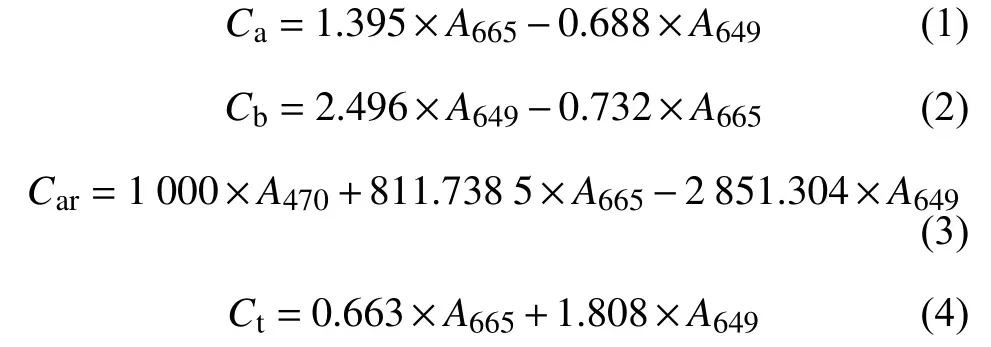
式中,Ca表示叶绿素a (Chla) 含量,mg/g FW;Cb表示叶绿素b (Chlb) 含量,mg/g FW;Car表示类胡萝卜素 (Car) 含量,mg/g FW;Ct表示叶绿素总量,mg/g FW。
1.2.3 叶绿素荧光参数的测定 参考文献方法[22]
测定叶绿素荧光参数,包括表观光合电子传递速率 (ETR(II))、最大光化学产量 (Fv/Fm)、非光化学淬灭系数 (NPQ)、光化学淬灭系数 (qP)、调节性能量耗散的量子产量 (Y(NPQ)) 及非调节性能量耗散的量子产量 (Y(NO))。取整株经30 min 以上暗适应 (光强低于1 μmol·m-2·s-1),对倒二叶照射检验光 (0.12 μmol·m-2·s-1,600 Hz) 后,测定初始荧光,之后照射饱和脉冲光,测定最大荧光,饱和脉冲光强度设置为4 000 μmol·m-2·s-1,脉冲时间为0.8 s,随后打开光化光,进行荧光动力学参数测定,光化光强度为500 μmol·m-2·s-1,参数测定时间为5 min。
1.2.4 抗氧化保护酶活性的测定 取0.1 g 倒二叶叶片,剪碎后放入预冷研钵中,加入少量石英砂和0.05 mol/L、pH 7.8 磷酸缓冲液2 mL,冰上快速研磨成匀浆,转移至2 mL 离心管中,于12 000 r/min 、4 ℃下离心15 min,取上清液即为酶液,于4 ℃冰箱保存,用于酶活测定。
超氧化物歧化酶 (SOD) 活性采用氮蓝四唑(NBT) 光还原法[23]测定,以抑制NBT 光化还原的50%为1 个酶活性单位 (U/g FW);过氧化物酶(POD) 活性采用愈创木酚法[24]测定,以A470变化1/min 为1 个酶活性单位 (U/g FW);过氧化氢酶(CAT) 活性采用紫外吸收法[25]测定,以A240减少0.1/min 为1 个酶活性单位 (U/g FW)。
1.2.5 ALS 活性的测定 使用ELISA 试剂盒测定谷苗叶片中ALS 活性,应用双抗体夹心法[26],使用纯化的ALS 捕获抗体包被微孔板,往包被的微孔中加入叶片ALS 提取液,再与HRP 标记的检测抗体结合,形成抗体-抗原-酶标抗体的复合物,用洗涤液彻底洗涤后加入底物TMB 显色。TMB在HRP 酶的催化下转化成蓝色,并在酸终止液的作用下转化成黄色。使用酶标仪测定450 nm 处的吸光度 (OD 值)。
1.2.6 MDA 含量的测定 参考Heath 等的硫代巴比妥酸法[27],并稍做改进。取0.2 g 倒二叶叶片,剪碎后放入预冷的研钵中,加入少许石英砂和2 mL 0.1%的TCA,冰上快速研磨成匀浆,转移至10 mL 离心管中,加入3 mL 0.1 %的TCA 制成提取液,再加入5 mL 0.5%的硫代巴比妥酸溶液,沸水浴显色15 min,冷却后于3 000 r/min 下离心15 min。取上清液并测量其体积,以0.5%硫代巴比妥酸溶液为参比,在532 nm、600 nm 波长下比色,采用紫外可见分光光度计测定吸光度值(A532和A600),按公式 (5) 计算MDA 含量。
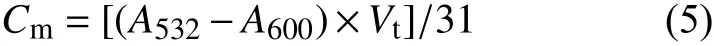
式中,Cm表示MDA 含量,mmol/g FW;Vt表示离心后上清液的总体积,mL。
1.3 田间试验
田间试验于2019 年5—10 月在山西农业大学申奉村试验田进行,供试土壤为碳酸盐褐土,试验采取随机区组设计,种植时采用人工条播,行距40 cm,每个小区面积为9.6 m2,共48 个小区。待谷子出苗后长至4~5 叶期时间苗定株距为6~8 cm。在晴朗无风的上午,使用电动背负式喷雾器采用喷雾方式施药。试验组咪唑乙烟酸用药量同盆栽试验,对照组喷施等量的清水,设3 次重复,在生育期内进行常规田间管理。
待谷子成熟后,从每个小区随机选取10 株谷子收获,进行室内考种测定。测量穗长、穗粗,称量穗重,人工数谷码数,单穗脱粒后测量穗粒重,称量千粒重,通过穗粒重及单位面积穗数求出理论产量。按公式 (6) 和 (7) 计算产量增长率和抑制率。
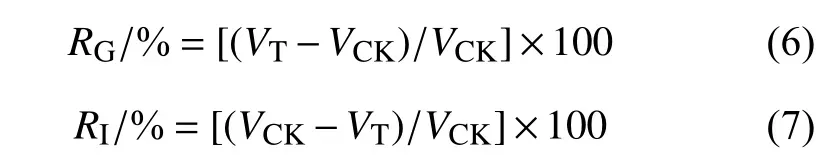
式中,RG表示产量增长率,%;RI表示产量抑制率,%;VCK表示清水对照组数值;VT表示咪唑乙烟酸处理组数值。
1.4 数据分析
使用Microsoft Excel 2016 进行数据整理,使用SPSS 24.0 软件进行独立样本t检验,显著性水平为α=0.05,使用Sigma Plot 10.0 将分析结果可视化。使用CANOCO 5.0 软件进行咪唑乙烟酸对谷子生理生化指标影响的主成分分析 (PCA)。
2 结果与分析
2.1 咪唑乙烟酸对抗性及常规品种谷子幼苗生长的影响
由图1 和图2 可看出:抗性和常规品种谷子幼苗对咪唑乙烟酸的响应存在显著差异。咪唑乙烟酸按有效成分93.5 g/hm2处理3 d 后,供试的7 个常规品种谷子幼苗均发生不同程度药害,株高低于对照植株;7 d 后,出现不同程度的植株矮化、萎蔫等受害现象,地上部分鲜重均显著降低,降幅达45.86%~72.83%。而抗性品种冀谷35 在同剂量咪唑乙烟酸处理后,长势良好,其地上部分鲜重与对照无显著差异。

图1 咪唑乙烟酸对抗性品种冀谷35 和常规品种冀谷38 幼苗生长的影响Fig. 1 Effects of imazethapyr on seedling growth of resistant variety Jigu35 and conventional variety Jigu38
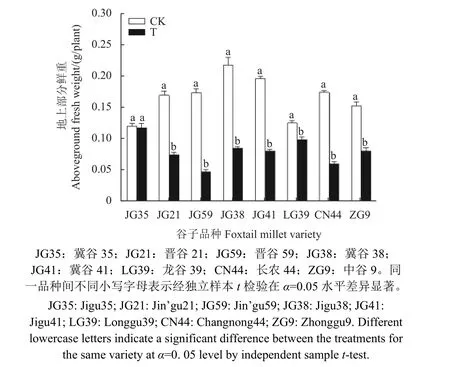
图2 咪唑乙烟酸对抗性及常规品种谷子地上部分鲜重的影响Fig. 2 Effects of imazethapyr on aboveground fresh weight of the resistant and the conventional varieties of foxtail millet
2.2 咪唑乙烟酸对抗性及常规品种谷子叶片光合色素含量的影响
由图3 可知:咪唑乙烟酸对抗性和常规品种谷子叶片光合色素含量的影响存在显著差异。咪唑乙烟酸处理下,7 个常规品种谷子的叶绿素a、叶绿素b、叶绿素 (a + b) 和类胡萝卜素含量均显著降低,分别降低了45.2%~92.1%、18.1%~93.8%、45.7%~92.4%和42.6%~84.2%;而抗性品种冀谷35 叶片光合色素的含量与对照相比无显著差异。
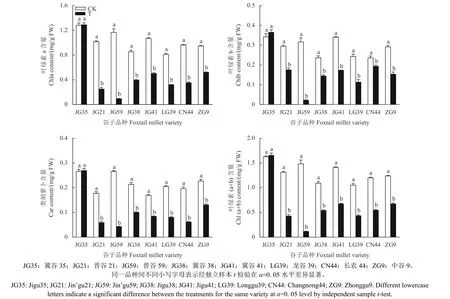
图3 咪唑乙烟酸对抗性及常规品种谷子叶片光合色素含量的影响Fig. 3 Effects of imazethapyr on the contents of photosynthetic pigments in leaves of the resistant and the conventional varieties of foxtail millet
2.3 咪唑乙烟酸对抗性及常规品种谷子叶片叶绿素荧光参数的影响
由表1 可知:抗性及常规品种谷子叶绿素荧光参数对咪唑乙烟酸的响应存在显著差异。咪唑乙烟酸处理下,常规谷子品种的荧光参数均受到不同程度的影响,其ETR(II)、Fv/Fm 分别显著下降20.4%~37.0%、6.9%~24.8%;NPQ、Y(NPQ)显著上升101.0%~322.1%、113.7%~319.7%;除龙谷39 外,其余常规品种的qP 值显著下降4.8%~10.4%。咪唑乙烟酸对抗性品种冀谷35 的叶绿素荧光参数影响较小,与对照相比差异不显著。
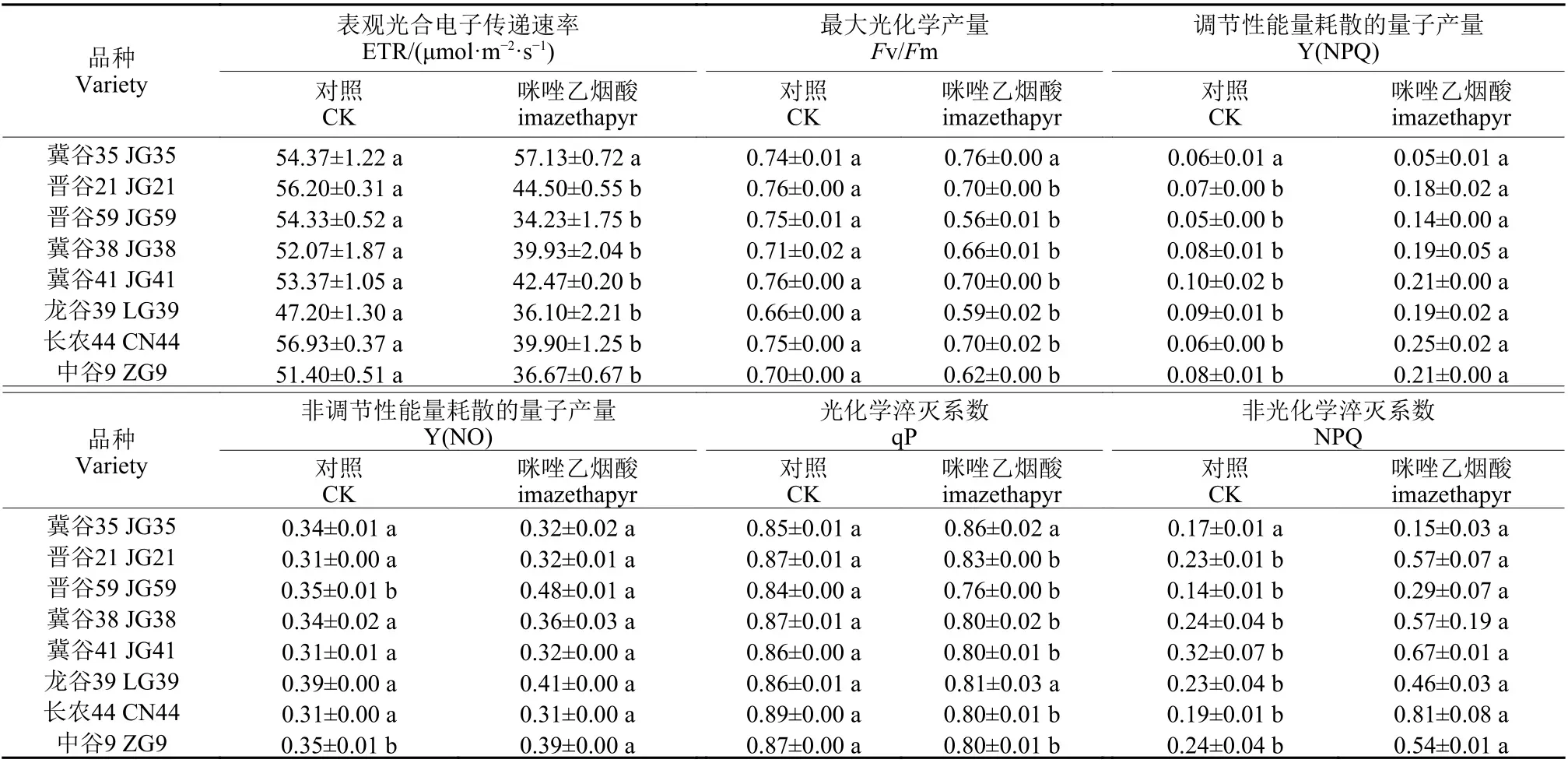
表1 咪唑乙烟酸对抗性及常规品种谷子叶片叶绿素荧光参数的影响Table 1 Effects of imazethapyr on chlorophyll fluorescence parameters in leaves of the resistant and the conventional varieties of foxtail millet
2.4 咪唑乙烟酸对抗性及常规品种谷子叶片抗氧化酶活性和丙二醛 (MDA) 含量的影响
咪唑乙烟酸处理下,抗性品种谷子幼苗抗氧化酶活性和MDA 含量与常规品种相比出现不同变化 (图4)。常规品种谷子过氧化氢酶 (CAT) 活性显著降低且不同品种对药害的响应存在差异,变化范围在19.70%~56.58% 之间,其中以冀谷38 降幅最大;相反,抗性品种冀谷35 的CAT 活性显著升高了52.50%。常规品种幼苗MDA 含量显著增加了16.70%~68.80%,但抗性品种冀谷35 的MDA 含量无显著变化。所有供试品种谷子超氧化物歧化酶 (SOD) 活性均显著提高而过氧化物酶 (POD) 活性的变化相对较小。
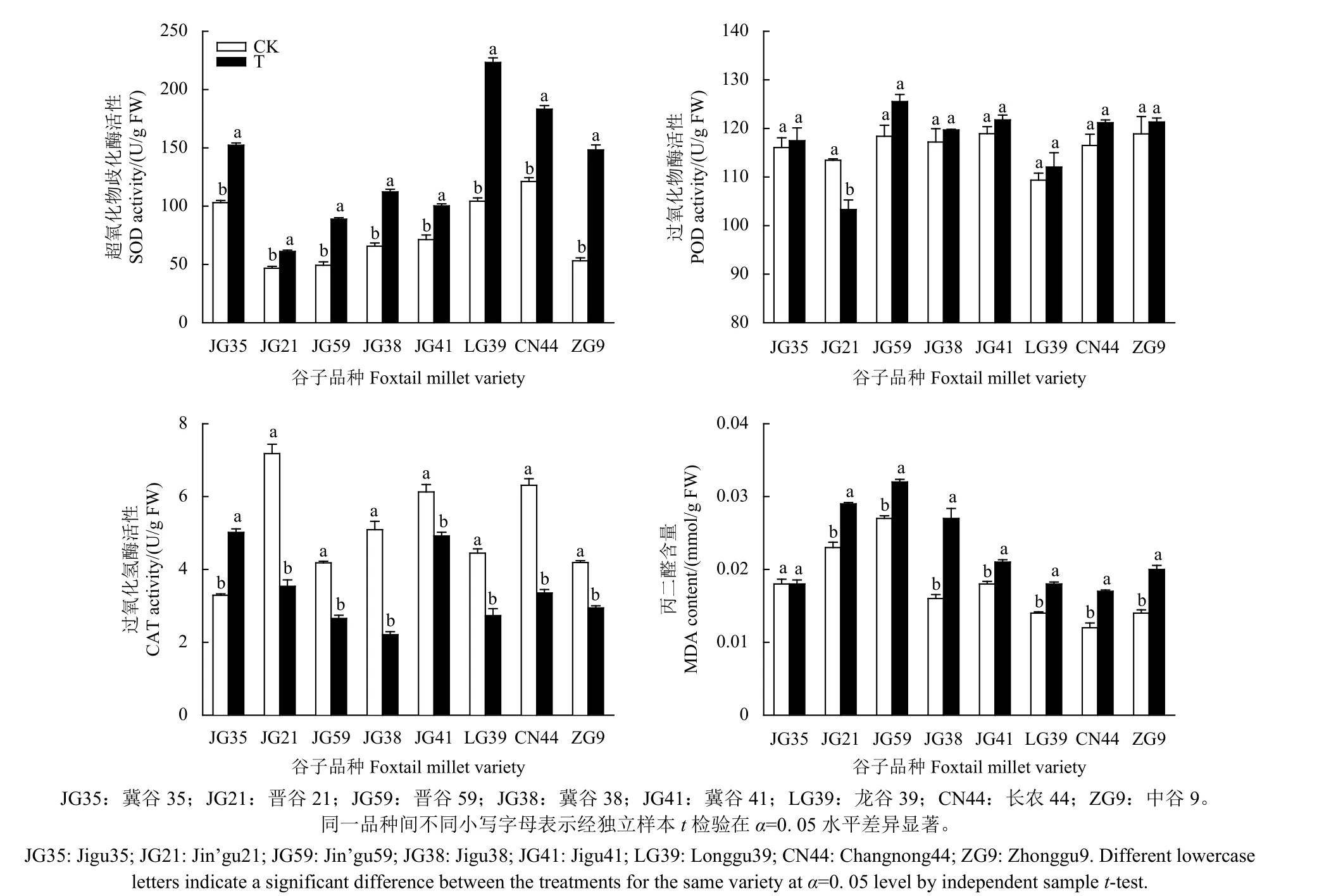
图4 咪唑乙烟酸对抗性及常规品种谷子叶片抗氧化保护酶活性和丙二醛 (MDA) 含量的影响Fig. 4 Effects of imazethapyr on antioxidant protective enzyme activity and MDA content in the leaves of the resistant and the conventional varieties of foxtail millet
2.5 咪唑乙烟酸对抗性及常规品种ALS 活性的影响
咪唑乙烟酸处理后,抗性品种冀谷35 的ALS活性在药后1 d 和9 d 分别显著上升12.69% 和18.40%,其余时间试验组与对照组差异不显著;常规品种冀谷38 在药后3~5 d ALS 活性显著上升19.72%~30.95%,从13 d 起,活性开始显著下降,药后21 d 较对照组降低24.57% (图5)。

图5 咪唑乙烟酸对抗性品种冀谷35 (A) 及常规品种冀谷38 (B) 谷子叶片乙酰乳酸合成酶 (ALS) 活性的影响Fig. 5 Effects of imazethapyr on ALS activity in the leaves of the resistant variety JG35 (A) and the conventional variety Jigu38 (B) of foxtail millet
2.6 咪唑乙烟酸对抗性及常规品种谷子产量构成的影响
咪唑乙烟酸对抗性和常规品种谷子产量构成的影响存在显著差异 (表2)。咪唑乙烟酸处理下,常规品种的穗长、穗粗、穗重、穗粒重及理论产量均显著降低,分别下降28.4%~56.3%、30.2%~55.9%、64.8%~89.9%、63.4%~90.7%和63.4%~90.7%,但对常规品种的千粒重影响相对较小,仅晋谷21 和中谷9 的千粒重显著降低13.5% 和30.6%。与此相反,咪唑乙烟酸处理提高了抗性品种冀谷35 的穗重、穗粒重及理论产量,分别增加8.6%、7.8%和7.8%;冀谷35 的其他产量性状较清水对照差异不显著。

表2 咪唑乙烟酸对抗性及常规品种谷子产量构成的影响Table 2 Effects of imazethapyr on yield composition of the resistant and the conventional varieties of foxtail millet
2.7 生理生化指标的主成分分析
图6 显示,抗性及常规谷子品种对咪唑乙烟酸的响应存在显著差异。主成分1 解释了83.5%的变异,主成分2 解释了8.4%的变异。咪唑乙烟酸处理下,常规谷子品种产量构成中的各项指标均受到抑制,光合色素含量和CAT 活性降低,但抗性品种冀谷35 表现出较强的抗药性。
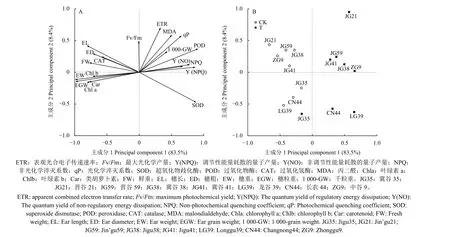
图6 咪唑乙烟酸对抗性及常规品种谷子生理及产量构成指标影响的主成分分析 (A:物种变量;B:样方变量)Fig. 6 Principal component analysis of the effects of imazethapyr on physiological and yield components of the resistant and the conventional varieties of foxtail millet (A: Species variable; B: Samples variable)
3 讨论与结论
除草剂在控制杂草危害的同时,往往会导致敏感性作物体内的生理生化过程发生改变,进而影响作物的生长、产量和品质[28-29],而抗除草剂作物品种在受到除草剂胁迫后,可以调节自身生理代谢的动态平衡来降低伤害[4-5]。植物叶片的叶绿素荧光参数与光合作用过程紧密相关,被称为光合作用探针,能够准确探测逆境胁迫下植物光合机构内各功能受到的影响[30]。已有研究表明,烟嘧磺隆处理对抗性品种玉米叶片Chla、Chlb 和Chl(a+b)含量无显著影响,但可使常规品种叶片的叶绿素含量显著下降[5]。Jimenez 等[31]研究发现,甲氧咪草烟可显著降低敏感小麦品种的光合活性和叶绿素含量,而对抗性品种的影响较小。Wang 等[5]研究发现,与对抗性品种相比较,烟嘧磺隆可使对烟嘧磺隆敏感玉米品种的叶绿素荧光参数Fv/Fm、qP 和ETR 显著降低,NPQ 显著升高。本研究发现,经咪唑乙烟酸处理后,晋谷21 等常规谷子品种叶片内光合色素含量以及叶绿素荧光参数Fv/Fm 和ETR 显著下降,NPQ 和Y(NPQ)显著上升,表明咪唑乙烟酸可抑制谷子叶片光合色素合成,使叶片PSⅡ利用光能的能力下降,叶片吸收的光能更多的以热能的形式耗散掉,而未能参与CO2固定,从而使叶片正常的光合过程受阻,并最终导致常规品种的谷苗生长受到抑制,成熟后田间表现为谷子穗长、穗粗、穗重等产量构成指标以及理论产量均显著下降。抗性品种冀谷35 的Chla、Chlb、Car、Chl(a+b)含量、叶绿素荧光参数及产量构成与对照相比均无显著变化,穗重、穗粒重及理论产量有所增加。Jefferies 等[32]研究发现,抗咪唑啉酮类鹰嘴豆品种在施用咪唑乙烟酸和甲氧咪草烟后,整个生育期均未表现出负响应,而敏感品种表现出生长发育延迟,产量降低。张婷等[12]研究发现,推荐剂量的咪唑乙烟酸可促进抗性品种冀谷33 增产,本研究结果与之一致。上述结果表明,冀谷35 的光合生理过程对咪唑乙烟酸具有较强的抗性,从而保证了其正常生长发育以及产量构成的稳定。
作物对除草剂的抗性差异主要由靶标抗性和非靶标代谢途径所致[33-34]。ALS 作为三唑并嘧啶类(triazolopyrimidines)、磺酰脲类(sulfonylureas)、咪唑啉酮类(imidazolinones)等除草剂的靶标酶,其对除草剂的响应差异是作物对ALS 抑制型除草剂产生抗性的重要原因之一[34]。已有研究表明,不同品种小麦靶标ALS 活性对啶磺草胺的响应存在显著差异[35]。用推荐剂量的烟嘧磺隆处理3 d后,敏感玉米品种的ALS 活性显著降低,而抗性品种的显著升高[36]。Domínguez-Mendez 等[4]也发现,ALS 保持较高的活性是抗咪唑啉酮类小麦品种具有抗性的主要原因。本研究结果显示,咪唑乙烟酸对常规谷子品种的靶标酶活性有抑制作用,表现为处理13 d 后,常规品种冀谷38 的ALS 活性显著降低,而抗性品种冀谷35 的ALS活性变化幅度较小,药后13 d 与对照组差异不显著,表明抗性品种可激发靶标抗性,维持靶标酶的活性稳定。活性氧代谢是作物抵御除草剂胁迫重要的非靶标代谢途径。除草剂处理后刺激作物组织在短期内产生较多的超氧自由基,使其活性氧代谢失衡,从而诱导细胞合成更多的SOD、CAT 及POD,以清除过量的超氧化物和H2O2等活性氧物质[37]。徐田军等[38]研究发现,苗后喷施烟嘧磺隆后,不同品种玉米叶片内CAT 活性和MDA 含量变化不同;Guo等[39]研究显示,不同品种谷子苗期喷施氯氟吡氧乙酸(使它隆)后,体内抗氧化酶的响应存在差异。本研究盆栽试验结果表明,咪唑乙烟酸胁迫显著提高了供试谷子叶片的SOD 活性,表明咪唑乙烟酸打破了谷子体内原有的活性氧代谢平衡,产生了过量超氧化物。然而,咪唑乙烟酸处理下常规品种谷子叶片的CAT 活性却大幅降低,H2O2的消除能力下降,从而加剧了膜脂过氧化程度,产生大量MDA。与常规品种不同,抗性品种冀谷35 在咪唑乙烟酸处理后,CAT 活性显著提高,从而维持了H2O2代谢的动态平衡,防止膜脂过氧化。
综上所述,常规及抗性谷子品种对咪唑乙烟酸的响应存在显著差异。在咪唑乙烟酸胁迫下,常规品种的光合生理代谢、幼苗生长以及产量构成均受到显著抑制,而抗性谷子品种冀谷35,通过维持靶标酶ALS 的活性,稳定并提高其抗氧化能力,可保证其正常的光合生理代谢,最终保持产量稳定。本研究结果可为谷田除草剂的合理使用以及谷子抗药性机理的研究提供理论基础。
