长期运动预处理对缺血性脑卒中大鼠脑组织损伤和神经功能障碍的改善作用及其可能机制▲
2022-04-08再努热阿不拉汗热迪娜亚生
再努热·阿不拉汗 热迪娜·亚生 韩 晶
(新疆维吾尔自治区人民医院康复科,乌鲁木齐市 833000,电子邮箱:C13989508@163.com)
近年来,缺血性脑卒中已成为我国居民死亡的主要原因之一[1]。大脑中动脉缺血会影响脑组织的血液循环,使得脑组织的氧气和葡萄糖供给不足。由于脑组织的高能耗性与易损性,较长时间的血氧剥夺会导致不可逆的神经损伤[2]。目前,溶栓治疗是缺血性脑卒中的首选治疗方案,然而较短的治疗时间窗及较危险的副作用限制了溶栓治疗的应用[3]。因此,亟须探寻预防缺血性脑卒中的发生或减轻缺血性脑卒中后的脑组织损伤和神经功能障碍的有效措施。
已有较多文献报告,缺血性脑卒中后长期运动有助于患者康复,其机制包括抑制小胶质细胞活化从而减少炎症反应[4-5],增加神经保护因子的分泌从而促进神经元新生[6],以及减少神经元凋亡从而缓解血脑屏障破坏[7]。然而,发病前长期运动是否有助于改善缺血性脑卒中后的脑组织损伤和神经功能障碍,其机制是否与降低小胶质细胞活化相关,却鲜有研究报告。因此,本研究拟采用跑步与游泳强迫大鼠锻炼,再通过线栓法构建缺血性脑卒中模型,探究长期运动预处理对缺血性脑卒中后脑组织损伤和神经功能障碍的改善作用及其可能作用机制。
1 材料与方法
1.1 实验动物 10周龄成年雄性SD大鼠36只,清洁级,体质量(230±10)g,由新疆医科大学动物实验中心提供[生产许可证:SCXK(新)2018-0001]。饲养环境:相对湿度(60±5)%,室内温度(24±2)℃,噪声小于50 dB,正常昼夜交换节律,室内通风良好,充足的食物与水源,为了保证大鼠有充足的自主活动空间,每笼大鼠不多于4只。根据随机数字表法将大鼠分为假手术组、脑缺血组、运动+脑缺血组,每组12只。
1.2 实验材料 L3400线栓购自广州佳灵生物技术公司,抗兔离子化钙结合适配分子1(ionized calcium-binding adapter molecule 1,Iba1)抗体(批号:bs-718240)、抗小鼠Toll样受体4(Toll-like receptor 4,TLR4)抗体(批号:bs-709432)、抗小鼠肿瘤坏死因子α(tumor necrosis factor α,TNF-α)抗体(批号:bs-758321)、抗兔白细胞介素(interleukin,IL)-6抗体(批号:bs-795843)、抗兔IL-1β抗体(批号:bs-712183)、抗小鼠甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号:bs-728732)均购自北京博奥森公司;酶标山羊抗鼠Ig(H+L)抗体(批号:65-19-768)、RIPA裂解液(批号:7018-905)购自上海碧云天公司;氯化三苯基四氮唑(triphenyl tetrazolium chloride,TTC)(批号:80417-793)、免疫组化试剂盒(批号:60029-132)均购自北京索莱宝公司。
1.3 长期运动方案 所有大鼠适应性喂养1周后,运动+脑缺血组大鼠开始连续4周的运动训练。每天上午,将大鼠放到自动跑步机(上海玉研仪器公司,型号:IITC Model 800)上跑步。设置动物程序为:由10 m/min至25 m/min缓慢提速,然后再缓慢降速,升速、降速的加速度均为1 m/min2,跑步时间共30 min;跑步机尾部设置电击以刺激大鼠向前跑步,电流强度为1.0 mA。每天下午,将大鼠投入一个装满水的圆柱形水桶(直径1.6 m,水高0.4 m)中,进行游泳运动,设置水温为(24±1)℃,15 min/次。在运动+脑缺血组大鼠进行强迫锻炼时,将其他两组大鼠放入80 cm×80 cm×40 cm的旷场中自由活动。所有大鼠均连续运动或活动4周。
1.4 脑缺血模型的构建方法 运动干预结束后,参考文献[8]中的方法建立脑缺血模型。取脑缺血组和运动+脑缺血组大鼠,术前12 h禁食不禁水,腹腔注射1.5%戊巴比妥钠(0.2 mL/100 g)进行麻醉,以按压脚趾无反应为麻醉成功标准。将大鼠以仰卧位固定于手术台上,给予颈部正中区域消毒后剃毛,使用手术刀片做一约1.5 cm的纵向切口,沿肌肉组织向下分离出右侧颈总动脉、颈内动脉和颈外动脉,结扎颈总动脉近心端和颈外动脉远心端,止血钳夹闭颈内动脉。颈总动脉剪开一个小口,插入线栓,松开止血钳,沿颈内动脉前进至大脑中动脉,进入距离分叉处15~17 mm,封闭大脑中动脉血流。固定线栓,维持2 h。再次注射少量戊巴比妥钠维持麻醉状态,辅助拔出线栓并结扎颈总动脉避免出血,缝合伤口,放入鼠笼中。按照上述的方法,给予假手术组大鼠麻醉、颈部消毒后做切口,分离出颈动脉后缝合伤口。建立脑缺血模型的大鼠于术后2~3 h顺利苏醒,脑缺血区所支配的对侧前肢无法伸展,按压时反应迟钝,提示造模成功。如出现大鼠死亡情况,则补充至每组12只。
1.5 神经功能缺损评分 拔出线栓24 h后,参考Zea Longa 5分制标准[8]对各组大鼠进行神经功能缺损评分(假手术组同一时间点进行评分)。评分标准:0分,四肢正常,可自由行走;1分,大鼠可正常行走,但提起大鼠悬空时,大鼠右侧前肢无法完全伸展,呈屈曲、抬高、肩内收;2分,在1分表现的基础上,存在向前瘫痪且有右侧旋转行走征象;3分,在2分表现的基础上,出现侧推易跌倒,行走较为困难;4分,大鼠无法自主活动,瘫痪且部分意识丧失。
1.6 脑水肿程度的评估 神经功能评分完成后,采用随机数字法每组选取3只大鼠,过量麻醉致死(3%戊巴比妥钠,0.2 mL/100 g,腹腔注射),迅速断头。完整取出大鼠脑组织,去除多余组织,吸干表面水分,电子秤称量大脑质量,记为湿重;将脑组织放入105℃烘箱中干燥去湿,6 h后称重,之后每隔1 h称一次质量,当连续称重3次前后差值少于0.3 mg时则记录最后一次质量为干重。根据公式计算得脑水肿程度,即[(湿重-干重)/湿重]×100%。
1.7 TTC染色法评估脑梗死体积 神经功能评分完成后,采用随机数字法每组选取3只大鼠,过量麻醉致死(3%戊巴比妥钠,0.2 mL/100 g,腹腔注射),迅速断头。将脑组织取出后,置于-20℃冰箱中冷冻30 min,当脑组织僵硬且易于切片时取出。使用锋利的刀片将脑组织自距额极约4 mm外作连续的冠状切片,每片厚度约3 mm,约5片。将切片浸泡于2%的TTC溶液中,37℃避光孵育20 min,每4 min翻动一次切片。将TTC溶液倾去,加入4%多聚甲醛溶液进行固定,30 min后将脑组织切片按顺序一次排列,使用数码摄像机拍摄。正常脑组织被TTC溶液染成玫瑰红色,梗死区域着色为白色。利用Image-Pro Plus软件测量脑组织切片白色区域面积,并计算脑梗死体积,以梗死体积占全脑体积百分比来表示脑梗死程度。
1.8 免疫组化染色检测Iba1和TLR4的表达情况 神经功能评分完成后,采用随机数字法每组选取3只大鼠,过量麻醉致死(3%戊巴比妥钠,0.2 mL/100 g,腹腔注射),剪开胸骨,暴露胸腔。使用生理盐水灌注冲尽血液,再以4%多聚甲醛灌注固定组织。断头取脑,将脑组织放入4%多聚甲醛溶液中继续固定3 d。取出脑组织,梯度乙醇脱水,对脑组织进行石蜡包埋,然后将石蜡包埋组织切成约4 μm厚的切片。将切好的石蜡切片放于45℃温水中展开,移至玻片上铺平,60℃烤片100 min。切片上滴加1%牛血清蛋白封闭液,室温封闭2 h,磷酸缓冲盐溶液漂洗玻片3次,切片上滴加抗兔Iba1单克隆抗体(1 ∶200)与抗小鼠TLR4单克隆抗体稀释液(1 ∶200),并在4℃条件下孵育过夜。次日,取出脑组织切片,磷酸缓冲盐溶液漂洗玻片3次,滴加酶标山羊抗鼠Ig(H+L)抗体稀释液(1 ∶200),24℃条件下孵育2 h。磷酸缓冲盐溶液洗涤玻片3次,3,3′-二氨基联苯胺底物复合物中孵育显色3~15 min,双蒸水充分冲洗,苏木精复染20 s,然后中性树胶封片,显微镜下观察并拍片,重点观察缺血侧海马区与前额皮层区。可见棕黄色颗粒则判定为样本阳性表达,通过软件Image-Pro Plus 6.0测定阳性表达区的光度值,以假手术组样本光度值的平均值为基值进行归一化统计。
1.9 免疫印迹试验检测炎性因子的蛋白表达情况 神经功能评分完成后,采用随机数字法每组选取3只大鼠,过量麻醉致死(3%戊巴比妥钠,0.2 mL/100 g,腹腔注射),迅速断头。取出脑组织后,镊取缺血侧海马组织与皮层组织部位,称重质量后加入RIPA裂解液提取总蛋白,裂解液与组织体积质量比为4 ∶1。将海马组织或皮层组织研磨成细胞悬液,4℃冰箱中静置30 min以充分提取蛋白。12 000 r/min离心30 min,吸取上清液,加入上样缓冲液,沸水中煮10 min使蛋白变性。配置十二烷基硫酸钠-聚丙烯酰胺凝胶,取出上样梳,每孔加入约10 μg样品进行电泳。设置电泳条件为恒压30 V/30 min、90 V/90 min,整个电泳以上样缓冲液到达凝胶底部设为电泳终点。根据分子标记Marker截取目的蛋白凝胶条带,使用湿法转膜法将目的蛋白自凝胶条带上转移至聚偏二氟乙烯膜上。设置转膜条件为恒流2 mA,时间60 min,整个转膜过程保持冰水浴。取出聚偏二氟乙烯膜,浸没于4%脱脂奶粉溶液中,封闭2 h,避免抗原与抗体非特异性结合。磷酸盐吐温缓冲液洗涤聚偏二氟乙烯膜,分别加入一抗稀释液,包括抗小鼠TNF-α抗体(1 ∶1 000)、抗兔IL-6抗体(1 ∶1 000)、抗兔IL-1β抗体(1 ∶1 000)、抗小鼠GAPDH抗体(1 ∶1 000),4℃条件下孵育过夜。次日,取出聚偏二氟乙烯膜,磷酸盐吐温缓冲液洗涤3次,加入辣根过氧化物酶标记的山羊抗兔/鼠IgG(H+L)二抗稀释液(1 ∶2 000),室温条件避光孵育2 h。磷酸盐吐温缓冲液洗涤3次,于条带上滴加ECL超敏发光液,显影仪下显影,使用Image J图像分析软件获取蛋白条带灰度值,以GAPDH作为内参,计算目的蛋白相对表达量。
1.10 统计学分析 采用SPSS 21.0软件进行统计分析,使用GraphPad 7.0软件进行绘图。计量资料以(x±s)表示,多组数据采用单因素方差进行比较,应用Tukey检验法进行两两比较。以P<0.05为差异具有统计学意义。
2 结 果
2.1 长期运动对大鼠脑缺血后神经功能的影响 假手术组大鼠没有出现任何行为学异常,能够自由行走且活跃度较高;脑缺血组大鼠出现明显的神经功能障碍,主要表现为行动迟缓,右侧前肢无法完全伸直,且仅能向右侧旋转,部分大鼠侧推易跌倒;运动+脑缺血组大鼠主要表现为一侧前肢无法伸展,但行动活跃且平衡能力较强,神经功能障碍较脑缺血组改善。3组大鼠神经功能评分差异有统计学意义(P<0.05),脑缺血组、运动+脑缺血组、假手术组大鼠的神经功能缺损评分依次降低(均P<0.05),见表1。

表1 3组大鼠脑缺血后神经功能缺损评分的比较(x±s,分)
2.2 长期运动对大鼠脑缺血后脑水肿和脑梗死程度的影响 脑缺血组和运动+脑缺血组大鼠脑组织水肿程度较假手术组严重,但运动+脑缺血组大鼠脑组织水肿程度较脑缺血组减轻(均P<0.05),见表2。假手术组脑组织TTC染色为红色,脑缺血组和运动+脑缺血组大鼠脑组织出现不同程度的白色梗死区域,脑梗死程度均较假手术组严重,但运动+脑缺血组大鼠脑梗死程度较脑缺血组减轻(均P<0.05),见表2和图1。

表2 3组大鼠脑水肿和脑梗死程度的比较(x±s,%)

图1 各组大鼠脑梗死区域
2.3 长期运动对大鼠脑缺血后脑组织中Iba1和TLR4表达的影响 与假手术组相比,脑缺血组大鼠海马区与前额皮层中Iba1和TLR4的表达量均增加(均P<0.05);与脑缺血组相比,运动+脑缺血组海马区与前额皮层中Iba1和TLR4的表达量均降低(均P<0.05)。见表3和图2、图3。

表3 3组大鼠脑组织中Iba1和TLR4相对表达量的比较(x±s)

图2 各组大鼠脑组织海马区与前额皮层中Iba1表达水平(免疫组化染色,×20)

图3 各组大鼠脑组织海马区与前额皮层中TLR4表达水平(免疫组化染色,×20)
2.4 长期运动对大鼠脑缺血后脑组织中促炎性细胞因子蛋白表达的影响 与假手术组相比,脑缺血组大鼠海马区与前额皮层中TNF-α、IL-1β与IL-6的蛋白相对表达量均增加(均P<0.05);与脑缺血组相比,运动+脑缺血组大鼠海马区与前额皮层中TNF-α、IL-1β与IL-6的蛋白相对表达量均降低(均P<0.05)。见表4、图4、图5。

表4 3组大鼠脑组织中促炎性细胞因子蛋白相对表达量的比较(x±s)

图4 各组(各2只)大鼠海马组织中促炎性细胞因子的蛋白表达情况
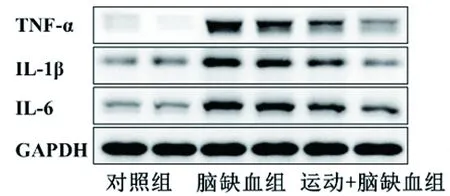
图5 各组(各2只)大鼠前额皮层组织中促炎性细胞因子的蛋白表达情况
3 讨 论
缺血性脑卒中是全球性的公共卫生问题,其高致残率和高致死率与缺血性脑损伤的严重程度密切相关[9]。缺血性脑卒中的病理机制非常复杂,涉及多种因素,如神经炎症、神经元凋亡、神经元再生抑制等[10]。其中,小胶质细胞介导的炎症反应参与了该病发生与进展的整个过程,是影响缺血性脑卒中患者预后的重要因素之一[11]。
已有较多文献报告,缺血性脑卒中发病后进行长期运动可发挥显著的神经保护作用[4-6]。在临床中,长期辅助运动是脑卒中患者康复管理的重要措施之一[12]。然而,发病前长期运动对减轻缺血性脑卒中发生后神经功能障碍的作用及其机制鲜有研究报告。本研究首先强迫大鼠进行为期4周的跑步、游泳混合锻炼,然后采用线栓法构建缺血性脑卒中模型,在建模24 h后评估大鼠的神经功能、脑水肿程度与脑梗死体积。本研究结果表明,运动预处理能改善缺血性脑卒中引起的脑水肿与脑组织梗死,降低神经功能评分。不同负荷运动会诱导脑组织出现间歇性缺血缺氧状态,这种短暂、高频的生理缺血能够提高人体血氧重新分配能力,提高机体的抗缺血缺氧能力,增强脑组织自我保护能力[13]。因此,缺血前长期运动本质上是通过一定的刺激手段,诱发机体内源性自我保护反应,从而快速适应缺血再灌注的刺激,及时做出反应,保护脑功能。
IL-1β,IL-6与TNF-α是缺血性脑卒中领域中被广泛研究的促炎性细胞因子。这3种细胞因子主要是由活化的小胶质细胞分泌,在缺血性脑卒中的进展中扮演重要角色[14]。有研究发现,给予能够对抗IL-1β与TNF-α的中和抗体进行预处理,能有效缩小缺血性脑卒中小鼠的脑梗死体积[15]。此外,纹状体内注射外源性重组IL-1β则会加剧缺血性脑卒中大鼠神经功能损伤[16]。IL-6是一种多效促炎性细胞因子,在缺血性脑卒中中IL-6的作用仍存在争议。Loddick等[17]发现,脑室内注射外源性重组IL-6可以显著降低大鼠脑缺血再灌注后脑水肿程度,部分恢复大鼠的神经功能。但多数研究报告IL-6表达降低在缺血性脑卒中模型中发挥着强大的神经保护作用[18]。本研究中,脑缺血组大鼠脑组织中IL-1β、IL-6和TNF-α的蛋白相对表达量均较假手术组增加(均P<0.05),提示IL-1β、IL-6和TNF-α水平升高在急性缺血性脑卒中的发生中具有重要作用;而运动+脑缺血组大鼠脑组织中上述因子的蛋白相对表达量均较脑缺血组降低(均P<0.05),表明长期运动可有效地降低缺血性脑卒中后大鼠脑组织中促炎因子的表达。
促炎性细胞因子在缺血性脑卒中进展中扮演重要角色,而小胶质细胞快速激活是诱发炎症的关键反应[19]。静息状态下,小胶质细胞通过较长突触对脑实质起监视作用;当发生血氧供应不足时,小胶质细胞迅速进入活化状态,吞噬坏死细胞,释放出大量促炎性细胞因子诱发脑组织炎症反应[20]。小胶质细胞激活对于宿主防御、清除碎片和组织修复是必需的,但小胶质细胞的过度激活会分泌各种细胞因子来杀死其他细胞,这进一步加重了缺氧条件下的脑组织损伤[21]。因此,靶向抑制小胶质细胞过度活化已成为缺血性脑卒中的治疗策略。TLR4是小胶质细胞膜上一种重要的模式识别受体,在与配体结合时会使小胶质细胞活化,诱发炎症级联反应[22]。而Iba1则是小胶质细胞的特异性识别抗体,在小胶质细胞过度活化时会过度表达[23]。因此,TLR4与Iba1的表达共同反映了小胶质细胞的活化状态,两者的表达随着小胶质细胞的活化而增加。本研究中,中动脉缺血造成了TLR4与Iba1表达协同增加;然而,模型构建前长期运动显著地逆转了缺血性脑卒中介导的TLR4表达增加,降低了小胶质细胞活化指标Iba1的表达。由此推测,长期运动可通过抑制由小胶质细胞活化引起的炎症反应发挥神经保护作用。
综上所述,发病前的长期运动有助于减轻缺血性脑卒中后大鼠的脑水肿和脑梗死程度,改善神经功能障碍,其机制可能与抑制小胶质细胞激活引起的炎症反应相关。因此,对于缺血性脑卒中的高发人群,如糖尿病、高血压、动脉粥样硬化患者[24],或者常饮酒、血压、血脂较高的老龄人群[25],应鼓励其加强体育锻炼,以减轻缺血性脑卒中后的脑组织损伤和神经功能损伤。
