非小细胞肺癌围术期免疫治疗临床决策的专家研讨
2022-04-08重庆肺癌精准治疗协作组执笔谢启超辇伟奇
重庆肺癌精准治疗协作组,执笔:谢启超,辇伟奇,张 瑜
(1.重庆医科大学附属第三医院肿瘤科 401120;2.重庆市中医院肿瘤科 400011;3.贵州省人民院肿瘤科,贵阳 550002)
据中国国家癌症中心2016年的统计数据,肺癌是发病率和病死率最高的恶性肿瘤,全国有82.8万新发病例和65.7万死亡病例[1]。约85%的肺癌为非小细胞肺癌(NSCLC),其中30%~40%被认为是可切除的肿瘤,包括大部分Ⅰ~Ⅱ期和部分ⅢA期肿瘤[2]。非常早期的NSCLC(ⅠA)可以通过手术治愈。然而,超过50%的NSCLC患者在接受手术治疗后会在5年内复发或转移,即使没有淋巴结转移,原发肿瘤直径<1 cm,仍有近8%的患者在解剖切除后5年内死于疾病[3-4]。为了改善可切除NSCLC患者的预后,辅助和新辅助治疗已被广泛用于围术期的治疗,但5年生存率仅提高约5%[5-6]。临床上,新辅助治疗较多用于可切除ⅢA期NSCLC,胸外科医生倾向于对更早分期的NSCLC尽早进行手术,以避免新辅助治疗中的疾病进展。
免疫检查点抑制剂(ICI)以程序性细胞死亡蛋白1(PD-1)/程序性细胞死亡配体1(PD-L1)抗体和细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抗体为代表,使晚期NSCLC患者的无进展生存期(PFS)和总生存期(OS)都得到了明显改善,已成为晚期NSCLC的一线标准治疗;局部晚期不可切除的NSCLC患者同步放化疗后免疫巩固治疗也已经成为该类患者的标准疗法之一。在黑色素瘤和胶质瘤中,新辅助ICI治疗已被证明可以为患者提供了更好的生存优势[7-8]。当前,可切除NSCLC患者围术期的新辅助免疫治疗和辅助免疫治疗正在如火如荼地展开,尽管已有NSCLC新辅助免疫治疗的国际共识,但并未包括辅助免疫治疗,且围术期免疫治疗的相关证据仍十分有限,在真实世界临床应用中尚存在各种问题和决策困惑。为此,来自重庆市和贵州省多家三级甲等医院的肿瘤内科、胸外科、呼吸内科、病理科等学科的肺癌诊治专家组(CPLOG)成员展开了学术沙龙,通过文献复习和经验交流研讨,形成了NSCLC围术期免疫治疗的共识建议和决策树,以期对临床实践给予指导和参考。
1 共 识
1.1 NSCLC新辅助免疫治疗的适宜人群
在新辅助免疫治疗的探索初期,开展了多项新辅助单药免疫治疗的临床试验。2018年,CheckMate159研究[9]首次报道了接受纳武利尤单抗单药新辅助治疗的结果。在安全性方面,手术时机没有明显延迟,不良反应可耐受,无新增的不良反应类型,≥3级不良反应与既往研究相似。整体上看,NSCLC新辅助免疫治疗的临床试验大多数是免疫治疗与化疗相联合,免疫治疗药物的用法用量与晚期NSCLC一致,术前均完成2~4个周期,见表1。NSCLC的Ⅱ期临床试验NADIM中,接受新辅助免疫治疗联合化疗,患者的主要病理缓解率(MPR)高达85.4%[10]。CheckMate816研究是目前唯一发布结果的Ⅲ期临床试验,共入组358例可切除ⅠB~ⅢA期NSCLC患者,接受新辅助纳武利尤单抗联合化疗组相对于单纯化疗组,病理学完全缓解率(pCR,24.0%vs.2.2%,OR=13.94,95%CI=3.49~55.75,P<0.000 1)和MPR(36.9%vs.8.9%,OR=5.70,95%CI=3.16~10.26)更高[11-12]。CheckMate816研究的第2个主要终点无事件生存率(EFS)也已达到预设值[13],也是首个新辅助免疫治疗Ⅲ期研究的阳性生存终点,为新辅助免疫治疗提供了强有力证据。
本共识参照CheckMate816研究入组条件,建议ⅠB期(肿瘤直径≥4 cm)~ⅢA期可手术的NSCLC患者作为新辅助免疫治疗人群。
1.2 新辅助免疫治疗生物标记物尚不明确,条件允许时在基线可行下一代测序(NGS)检测
晚期NSCLC患者中,PD-L1表达阳性显示出更高的生存率[15]。然而,在早期NSCLC新辅助免疫治疗中,并未发现PD-L1表达与病理学缓解或生存获益有明显的相关性[16]。肿瘤突变负荷(TMB)较高的患者在新辅助免疫治疗中似乎有更好的MPR[9],但LCMC3研究结果并不支持这一结论[17]。同时TMB也无法预测患者的生存获益[16]。根据NADIM研究在2021世界肺癌大会的更新报道[16],循环肿瘤DNA(ctDNA)清除预示着新辅助免疫治疗的生存获益(HR=0.05,95%CI:0~0.68,P=0.024)。CheckMate816研究同样显示,ctDNA清除与pCR明显相关[12]。
驱动基因状态与新辅助免疫治疗的关系也尚未明确。CheckMate057、KEYNOTE-010和OAK研究亚组分析表明,驱动基因突变的晚期NSCLC患者接受免疫治疗并未比化疗显示出PFS或OS改善。CheckMate057研究纳入了82例既往接受过表皮生长因子受体(EGFR)-酪氨酸激酶抑制剂(TKI)或含铂两药方案治疗进展的EGFR突变晚期非鳞NSCLC患者,OS亚组分析结果显示,该类型患者无法从PD-1抑制剂中获益(未分层HR=1.18,95%CI:0.69~2.00);KEYNOTE-010研究纳入了46例既往接受过EGFR-TKI或含铂两药方案治疗进展的EGFR突变晚期PD-L1≥1%的NSCLC患者,OS亚组分析结果显示,该类型患者同样无法从免疫治疗中获得OS优势(未分层HR=0.88,95%CI:0.45~1.70);OAK研究入组的85例EGFR突变NSCLC患者,接受Atezolizumab治疗与接受多西他赛治疗患者的疗效比较,OS比较差异无统计学意义(未分层HR=1.24,95%CI:0.71~2.18)[18-20]。美国国家综合癌症网络(NCCN)指南建议,对于EGFR基因突变的NSCLC患者不宜进行免疫治疗[21]。关于其机制,EGFR基因突变可以调节PD-1通路的激活,减少PD-L1的表达[22];但AZUMA等[23]认为,PD-L1表达状态不能解释驱动基因突变患者未能从免疫治疗中获益这一事实。此外,EGFR基因突变可能导致TMB降低,免疫原性降低[24-25]。黑色素瘤免疫治疗的研究证实,只有少数新抗原来自敏感基因突变[26]。
鉴于40%~50%的亚裔肺腺癌患者存在EGFR基因突变[27],因此,建议新辅助免疫治疗患者在条件允许时,在治疗前进行基线NGS检测。如果有敏感基因突变,不建议行新辅助免疫治疗。
对于免疫疗效预测因子(正向基因突变包括TP53、DDR、ARID1A、POLE/D等,负向基因突变包括SKT-11、B2M、JAK1/2、MDM2/4、EGFR等)、PD-L1表达分层在新辅助免疫治疗中的作用和依据,参照CPLOG既往研讨会形成的决策推荐[28]。简而言之,对于PD-L1表达水平可以参照晚期NSCLC免疫治疗推荐进行分层,PD-L1≥50%,可给予单药ICI治疗;PD-L1<1%,给予ICI联合化疗;PD-L1为1%~<50%,给予ICI单药或联合化疗。对于免疫负性预测因子表达者,建议慎重给予ICI联合化疗。此外,如果条件允许,建议患者行分子残留病灶(MRD)监测以对后期复发进行个体化的干预。
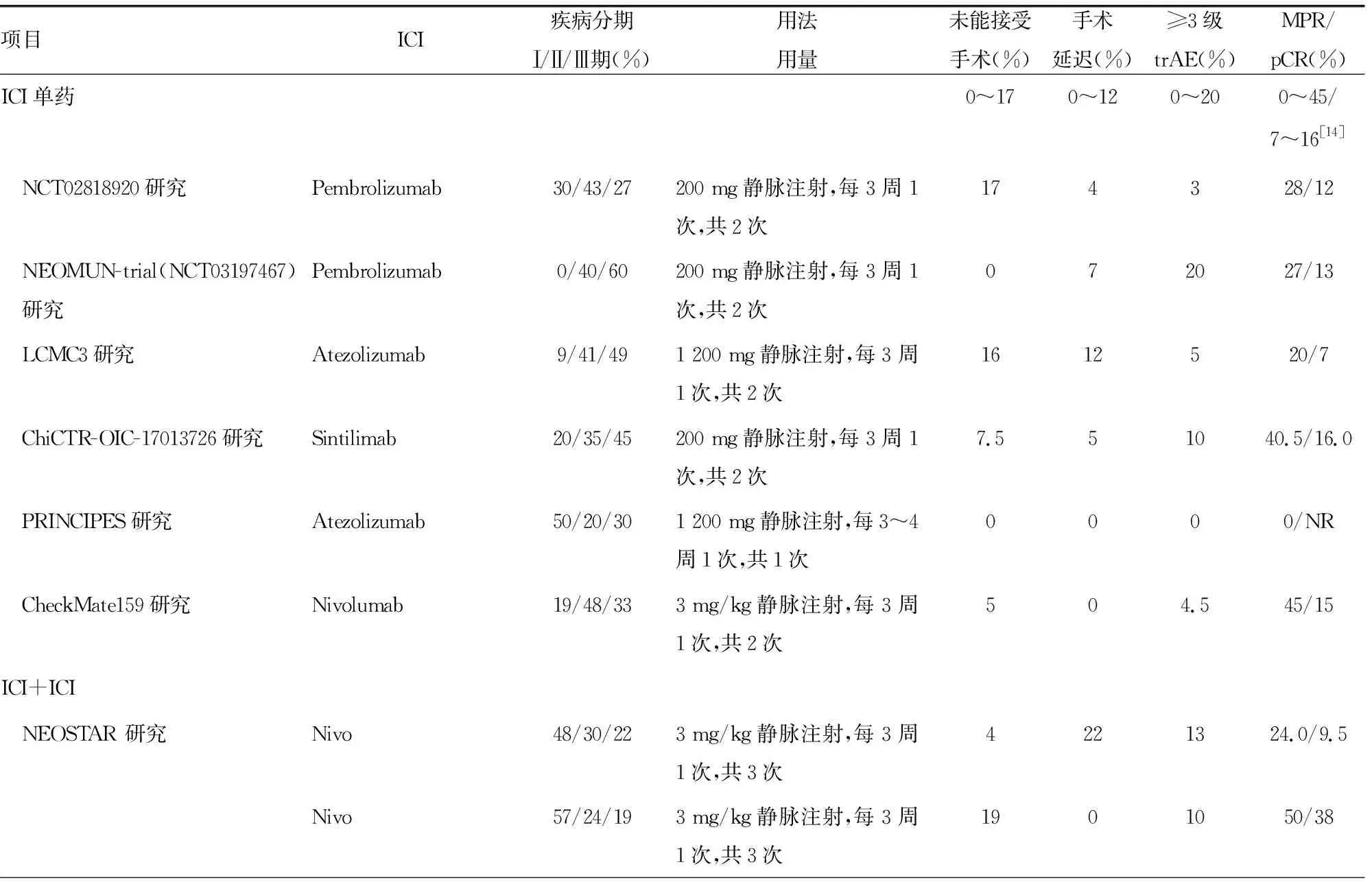
表1 新辅助免疫治疗安全性及疗效数据汇总

续表1 新辅助免疫治疗安全性及疗效数据汇总
1.3 放疗在新辅助免疫治疗中应谨慎选择
目前放疗联合ICI新辅助治疗的数据有限,证据级别低。在一项单中心的Ⅱ期临床研究中纳入了60例ⅠA~ⅢA期的NSCLC患者,其中30例接受新辅助度伐利尤单抗治疗,30例接受度伐利尤单抗联合立体定向放疗(SBRT,8 Gy×3次)。在联合SBRT组中影像学缓解率[部分缓解(PR):47%vs.3%]和病理学缓解率(MPR:26%vs.7%;pCR:27%vs.0)均高于度伐利尤单抗组。安全性方面,联合SBRT组在3~4级不良事件(AE)发生率上有所增加(20%vs.17%),另外还发生了1例心肺事件相关的死亡[29]。因此,本共识推荐通常情况下在可手术切除的人群中新辅助治疗不选择ICI联合放疗的方案。需全肺切除者不宜选择,术前、术后肺部放疗需非常谨慎。
但在以下几种特殊情况应考虑新辅助ICI治疗时联合放疗:(1)患者充分表达希望接受新辅助ICI治疗但同时拒绝接受化疗或具有化疗禁忌证;(2)患者TN分期不宜过大,T分期界定≤T3,N分期界定在≤N2;(3)多学科联合会诊,胸外科医生判断放疗对手术影响较小;(4)在联合放疗时选择PD-L1抗体为佳;(5)潜在可切患者希望通过ICI联合放疗实现降期从而获得手术机会。
1.4 新辅助免疫治疗病理学评估优于影像学评估
RECIST1.1是NSCLC患者的重要疗效评价指标[30],但在新辅助免疫治疗时,41%~45%患者的组织病理学反应可能与肺部CT评价不一致[9,31],可能与肺组织纤维化成分,或新辅助免疫治疗后淋巴细胞浸润影响影像学评价有关。
相比影像学评估,术后病理学评估可以提供新辅助治疗最为准确的疗效信息。组织病理学改变主要表现为不同程度的肿瘤细胞消退、坏死和间质改变(主要包括纤维化和炎性病变),其中残存活肿瘤细胞百分比是比较可靠的疗效预测指标,也能为术后辅助治疗提供更准确的方案选择证据。研究发现以大量免疫细胞浸润为主的肿瘤消退是新辅助免疫治疗后的组织学特征,也提示免疫治疗的病理学评估标准有别于传统化疗[32-35]。近日,国家肿瘤质控中心肺癌质控专家委员会基于国际肺癌研究协会推荐和本国实践,推出了《非小细胞肺癌新辅助治疗疗效病理评估专家共识》,对新辅助治疗后的标本取材、病理评估及病理诊断报告提出规范,为临床治疗和预后预测提供可靠依据[36]。
1.5 新辅助治疗的病理学缓解可作为替代终点,但OS仍是不可替代终点
早期NSCLC的长期生存数据往往需要10年左右,MPR是较多临床研究的替代研究终点。最初,JUNKER等[37]发现,一些ⅡB或Ⅲ级肿瘤退缩的患者(残余肿瘤<10%,即MRP),其生存率明显提高。随后有研究显示MPR与OS之间存在明显的相关性[38]。2014年,MPR被更正式地确认为OS的一个替代指标[39]。2020年欧洲肿瘤内科学会(ESMO)年会公布CA209-8Y9 meta分析结果,新辅助治疗达到pCR或MPR,与患者更好的OS、EFS结果相关[40]。NADIM研究[10]显示,新辅助免疫治疗病理学缓解与2年生存获益有明显相关性(MPR+pCRvs.非MPR,100%vs.86%,P=0.002)。2018年12月美国食品药品监督管理局同意EFS/无病生存期(DFS)可以作为适应证审批的替代终点,用于加速审批或直接临床获益的审批[41]。尽管尚未有新辅助免疫治疗病理学缓解与5年生存率相关性的报道,但从社会经济学角度来看,采取病理学缓解终点可加速肺癌和其他癌症药物的研究发展速度并降低研发成本,使患者更早享受新疗法的获益。
多方面证据显示病理学缓解与生存之间的相关性比较明确,EFS/DFS可以作为临床研究的替代终点,但OS指标仍是不可被替代的最相关终点。
1.6 新辅助2~4个周期后进行RECIST1.1评估来辅助手术决策
免疫治疗后,部分患者会出现超进展,表现为肿瘤加速生长,临床症状迅速恶化,约占总病例的10%,该过程的分子机制尚不完全清楚[42-44]。与假性进展不同,超进展不仅表现为影像学肿瘤增大,病理学还表现为肿瘤细胞增殖,而假性进展病理学显示为肿瘤坏死及CD8+T细胞浸润。正电子发射计算机断层显像(PET-CT)较CT更有利于判断超进展和假性进展,后者标准摄取值较低[45-46]。基于PET-CT评估NSCLC新辅助治疗疗效的临床研究仍处于起步阶段,缺乏标准化和前瞻性数据,当前,新辅助免疫治疗的肺部CT检查仍无法替代,大多数研究采用2~4个周期新辅助治疗后进行RECIST1.1评估,来辅助手术决策。
本共识推荐如下,(1)完全缓解(CR):新辅助治疗后评估为临床完全缓解(cCR),仍优先推荐手术切除。因为即使原发灶完全退缩,但淋巴结仍有转移的风险,需进行淋巴结清扫以减少复发风险。如患者有强烈保肺意愿拒绝手术,需在患者充分知情同意后取消或暂缓手术。(2)PR/疾病稳定(SD):按计划进行手术切除。(3)疾病进展(PD):如疾病进展程度仍符合技术上可根治性切除,则按计划进行手术治疗;如疾病进展程度至无法实现技术上根治性切除,则按局部晚期患者给予根治性放(化)疗或按晚期患者给予一线标准治疗。
1.7 不同的手术方式对接受辅助免疫治疗患者生存有影响
现有数据(IMpower010研究)分层比较粗糙,并没有对全肺切除患者进一步分层,如肿瘤分期、全肺切除位置。在临床实践中,应尽量避免全肺切除,尽可能保留肺组织可为术后的辅助化疗、放疗提供条件。左全肺切除的患者要比强行保留肺叶或袖式切除的患者预后更好。右全肺切除对生活质量影响很大,应尽量避免,全肺切除仅限于左肺。如果只有全肺切除才能达到R0切除时,不应强行保留肺叶,有必要做全肺切除。本共识推荐:手术中尽量保留肺组织,避免全肺切除,但需要根据实际情况判断,不必强行保留。
1.8 辅助免疫治疗的患者选择
目前NSCLC辅助免疫治疗研究数据有限,仅有IMpower010研究作为参考[47]。IMpower010研究是一项随机、开放标签的全球多中心Ⅲ期研究,纳入1 280例接受完全性切除手术的ⅠB(≥4 cm)~ⅢA期NSCLC患者,在接受辅助化疗后无疾病进展的1 005例患者接受阿替利珠单抗维持治疗或最佳支持治疗(BSC)。研究显示,Ⅱ~ⅢA期亚组,阿替利珠单抗组的DFS明显优于BSC组(HR=0.79,P=0.02),在意向治疗分析人群中,DFS差异未达到预设统计学界值(HR=0.81,P=0.04),分层分析显示,ⅠB期患者阿替利珠单抗未能提高DFS(HR=1.01)。基于此,NCCN指南2021 V7版推荐,PD-L1≥1%的ⅡA~Ⅲ期患者可进行辅助免疫治疗[48]。
基于IMpower010研究及NCCN指南,本共识推荐辅助免疫治疗的人群选择局限在PD-L1≥1%的Ⅱ~ⅢA期患者。
1.9 开始辅助治疗的时机在术后3~4周
患者术后的体能及免疫状况需要一定时间才能恢复,术后开始辅助治疗时机的研究证据较少。2015年,ASTR研究提示,根治切除的Ⅲ期结肠癌患者在术后3周以内开始辅助化疗,复发率明显低于术后3周以上开始辅助化疗者(11.1%vs.33.0%,P=0.018),DFS更长。多项正在进行的NSCLC辅助免疫治疗的Ⅲ期研究规定辅助治疗时机为术后3~12周(NCT02595944、NCT02273375、NCT02486718、NCT04564157研究)。
本共识推荐:若患者术后体能、免疫状态恢复较好,术后3~4周可以开始使用辅助ICI治疗或其他化疗。开始ICI治疗前,需要通过CT检查来排除肺部感染,且肺功能基本恢复。临床实践中,可根据患者全身状态、病理指标、肺部情况,对辅助治疗时机做出适当调整,不必过于拘泥。
1.10 辅助治疗的方案选择应基于术后基因检测及病理学评估
对于术前未进行基因检测的患者,要求完成术后基因检测以明确是否存在驱动基因突变。对于辅助治疗的方案选择,应结合新辅助治疗的临床疗效、MPR和pCR来确定辅助治疗的方案选择。
本共识推荐术后辅助治疗应基于术后基因检测及病理学评估:如术后基因检测为驱动基因突变型,则不推荐辅助免疫治疗而应选用靶向药物。如术后基因检测为驱动基因野生型,则推荐患者术后接受辅助免疫治疗,具体方案选择应根据病理学评估。pCR/MPR或PD-L1≥50%:可选择ICI单药;中度比例肿瘤残留或PD-L1低表达或低TMB:可选择ICI联合化疗;高度比例肿瘤残留:可选择辅助化疗。
1.11 pCR/MPR患者免除辅助治疗的临床选择
NSCLC根治术后ctDNA是一种无创监测治疗反应的有效工具,对预测疾病复发具有很高的灵敏度和特异度,对于监测癌症特异性分子变化有很大潜力和应用前景。对肿瘤进行个体化的ctDNA深度测序,可以早期诊断出MRD,用于指导个性化的辅助治疗[49-50]。LUNGCA-1队列研究[51]的结果显示,术后1个月内ctDNA-MRD阳性患者的复发率80.8%(21/26),明显高于阴性患者16.2%(49/303,P<0.001),MRD阳性患者接受辅助治疗可提高RFS(HR=0.3,95%CI:0.1~0.8,P=0.008)。术后ctDNA状态是术后患者复发预测的明显指标(HR=11.1,95%CI:6.5~19.0,P<0.001)。该研究揭示了围术期ctDNA能有效预测NSCLC患者术后复发,可作为NSCLC患者术后早期检测MRD的可靠指标。
本共识推荐:如果新辅助治疗后获得了pCR或MPR,辅助治疗可以选择ICI单药方案或仅进行观察。如果有条件持续收集液体活检标本,可以监测MRD来进行辅助治疗决策,即肿瘤分期早(ⅠB期)且MRD阴性,可不接受辅助治疗;肿瘤分期晚(Ⅱ~ⅢA期)则不论MRD结果,须接受辅助治疗。
1.12 围术期免疫治疗的安全性可控,但应警惕治疗早期致死性免疫相关不良事件(irAE)
对特殊人群(自身免疫性疾病患者、器官移植后的患者、慢性病毒感染患者、免疫缺陷患者、肺纤维化患者、妊娠期患者、肝肾功能障碍患者等)进行围术期免疫治疗需要格外谨慎。一般而言,可手术的NSCLC患者的围术期免疫治疗是相对安全的,单药免疫治疗的所有等级和3级AE的发生率分别为23.0%~67.7%和4.5%~13.0%。少数情况下,irAE可能导致无法手术、手术延迟和术后并发症增加,甚至危及生命[52]。由于辅助免疫治疗一般需1年的治疗期,总体药物暴露相比2~4个周期新辅助免疫治疗增加很多,因此,在辅助免疫治疗的临床实践中,迫切需要对irAE进行更精细的管理。良好的、规范的围术期irAE管理不仅可以保证完整的治疗实施,而且对改善患者的临床预后有积极作用。
本共识推荐:(1)围术期免疫治疗期间,有必要定期检查和监测器官功能(实验室检查和影像检查、肺功能、心电图、甲状腺功能和其他基线评估);(2)早期识别与免疫相关的肺炎或心脏毒性等是很重要的;(3)NSCLC围术期的irAE应根据相关指南进行分级治疗。
2 结 语
新辅助免疫治疗和辅助免疫治疗均在可切除NSCLC患者中体现出重要价值,对于潜在可切除NSCLC患者也可能是一种重要的治疗方式,目前尚缺乏NSCLC围术期全程免疫治疗的Ⅲ期临床研究结果。从降低整体复发风险及长期生存获益的角度看,本共识推荐新辅助免疫-手术-辅助免疫的围术期全程治疗。NSCLC围术期免疫治疗的全程管理和决策树见图1。

图1 NSCLC围术期免疫治疗的全程管理和决策树
重庆肺癌精准治疗协作组成员(按姓氏汉语拼音排序):宫亮,李力,李梦侠,李咏生,罗虎,罗志林,辇伟奇,阮志华,孙建国,谢启超,杨志祥,杨镇洲,张瑜,朱宇熹
特邀嘉宾:吴蔚教授(陆军军医大学第一附属医院)
邓波教授(陆军特色医学中心)
马强博士(陆军特色医学中心)
