高功率锂离子电池研究进展
2022-04-07陈港欣孙现众马衍伟
陈港欣,孙现众,张 熊,王 凯,马衍伟
1) 中国科学院电工研究所,北京 100190 2) 中国科学院大学工程科学学院,北京 100049 3) 齐鲁中科电工先进电磁驱动技术研究院,济南 250013
锂离子电池是21世纪以来最为热门的储能器件之一,与铅酸电池、镍氢电池、镍隔电池等可充放电池相比较,其具有能量密度高、单体输出电压高、循环性能优越、可快速充放电和使用寿命长等优点,被广泛应用于消费电子产品、电动汽车和新能源电站的储能电源系统等.
锂离子电池主要由正极、负极、隔膜和电解液等构成.充电时锂离子从正极脱出、嵌入到负极碳材料中,放电过程与此相反,以实现能量的存储与释放.锂离子电池的充放电过程伴随着锂离子在正、负极之间不断的嵌入与脱嵌,因此锂离子电池又被形象地称为“摇椅电池”[1].常规的锂离子电池能量密度很高 (可达 300 W·h·kg-1),但由于受电池内阻和极化的影响,电池在高功率密度条件下电压下降很快,不能有效发挥其储能作用.随着对智能电网、轨道交通、弹射系统、航空系统以及高定向能器件等领域的重视程度不断提高,高功率锂离子电池的重要性也得以显现.高功率锂离子电池通常是指具有较高的输入功率密度或输出功率密度的锂离子电池,可分为“快充”和“快放”两种类型,本文主要介绍了“快放”型锂离子电池.根据国家标准GB/T 31486—2015《电动汽车用动力蓄电池电性能要求及试验方法》[2],高功率蓄电池是指室温下最大允许持续输出电功率(W)和1C倍率放电能量(W·h)的比值不低于10的蓄电池.该标准对于C的定义为:C1为1小时率额定容量(A·h);I1为1小时率放电电流,其数值等于C1(A).即1C电流是指锂离子电池1 h完成放电的电流.本文针对高功率锂离子电池用正极材料、负极材料、电解液等关键材料和制备工艺的研究进展进行综合评述,并作了简要总结与展望.
此外,锂离子电池功率密度的测试也有多种方法:(1) 平均功率法[3],即单位时间内释放的能量,P=E/t,但是在高倍率下放电时间短、误差大,这种方法受限于测试设备的精度和采点频率;(2)美国 FreedomCAR项目功率密度测试方法(简称HPPC法)[4],测试方法中将电池采用HPPC方法通过10 s脉冲充放电试验计算出放电内阻Rdis,最大放电电流为Imax= (UOC-Umin)/Rdis,放电功率能力Pmax=Umin×Idmax,其中UOC为开路电压,Umin为最小电压,Pmax为最大功率;(3)日本电动车辆协会功率密度测试方法(简称JEVS法)[4],在0~100%荷电状态(SOC)下按不同倍率进行交替充电10 s和放电10 s试验,获得测试电流与电压曲线,通过拟合得出该SOC下对应截止电压下的最大放电电流,Pmax =Udis-cutoff ×Idmax,Udis-cutoff为放电截止电压;(4) 2 s脉冲放电法[5],测试方法为将电池用1C电流充电至截止电压,然后用不同电流放电2 s,计算最大电流Idmax与2 s终了时电压的乘积Pmax=U2s×Idmax,U2s为2 s 终了时的电压;(5) 峰值功率法,充放电测试设备在放电时电流从0 A增大至设定的电流值需要有一个约15 ms的时间过程,此时的峰值功率密度为Pmax=U15ms×Idmax,U15ms为15 ms终了时的电压.
1 正极材料
正极材料是锂离子电池中的“锂源”,通常既要提供充放电时在正负极之间往返的锂离子,又要提供锂离子电池首周充放电形成固体电解质相界面(简称SEI)膜时于负极所消耗掉的锂离子.正极材料对电池功率的影响主要体现在工作电压U及内阻R上,其中电压U由电极材料的热力学本征特性决定,而内阻R则与正极材料的结构、掺杂改性、表面包覆及制备工艺等多种因素相关.高功率锂离子电池正极往往会采用高电压材料并对其进行各种改性来提高电压以及降低内阻[6-7].最重要的高电压正极材料为高电压钴酸锂、镍锰酸锂和高电压三元材料等.
1.1 高电压钴酸锂
钴酸锂(LiCoO2)具有层状结构,在电池正极材料中具有最高的理论密度值和较高的体积能量密度,也是最早实现大规模应用的锂离子电池正极材料.最初的钴酸锂的工作电压为4.25~4.3 V(相对于锂电极,下同),比容量为130~150 mA·h·g-1;2013年后,工作电压为4.35~4.4 V、比容量为170~175 mA·h·g-1的钴酸锂面市.目前,功率型钴酸锂的充电电压可达到4.5 V.然而,追求高电压的钴酸锂会带来一系列的技术问题,包括体相结构变化、O参与电荷转移过程、表面结构变化、界面副反应以及高电压配套技术五个方面,如图1所示,这些方面的问题同样出现在其他高电压正极材料中[8].

图1 高电压钴酸锂存在的主要问题[8]Fig.1 Primary issues of high-voltage lithium cobalt oxide[8]
钴酸锂材料在4.25 V电压下会发生从O3六方晶系向单斜晶系的转变,而在4.5 V附近开始发生O3→H1-H3→O1相变,而相变过程的可逆程度是决定材料应用的瓶颈.高电压钴酸锂的相变过程会面临以下问题:(1)相变动力学变差,导致电池在高电压荷电状态下的倍率性能下降;(2)晶格结构出现较大改变,O3相开始消失,伴随着晶胞参数的剧烈膨胀;(3)滑移相变不完全可逆,造成材料容量和电压平台的衰减[9].材料表面由于存在悬挂键和不饱和的配位关系而具有比体相更高的反应活性,高电压钴酸锂材料亦是如此.从表面结构变化而言,在正极材料充电过程中,脱锂位从材料的表面开始并与体相内部形成一定的浓度梯度,表面过度脱Li后Li层的氧原子间由于失去了阳离子阻隔而产生排斥作用,表面结构变得不稳定,甚至发生氧气的析出和表面Co原子的溶解[8].
目前研究者们通常采用材料的掺杂改性和表面包覆改性来解决这些问题[10-11].掺杂改性即指往钴酸锂中引入新的元素,抑制其高压下的相变,提升综合性能.例如,Mg2+掺杂能够显著提升材料电导率[12],Al3+掺杂可以提高高压下钴酸锂的循环性能[13],Ti4+掺杂能增强材料的稳定性并提高其放电比容量[14].而Mg、Al、Ti的共掺杂可以显著提升钴酸锂在高压下的倍率及循环性能,有效解决其在高压下的稳定性问题[15].包覆改性是指在钴酸锂表面包覆一层电子导体或/和离子导体,主要包括各类固体电解质材料.例如,在钴酸锂表面包覆一层电解质Li1.4Al0.4Ti1.6(PO4)3(LATP),能有效提高其在4.5 V高电压下的倍率性能与循环稳定性[16];在钴酸锂表面包覆一层Al2O3则可以抑制高压下材料表层裂开,提高材料的高压性能[17];而TiO2包覆则能够提高材料在高压下的稳定性与倍率性能[18].
此外,正极材料与电解液的固液界面副反应也是锂离子电池不可避免的问题,而有效构造稳定和合适的正极电解质界面(简称CEI膜)对电池性能的提升具有重要作用[19],可通过优化电解液的组成来改善,这将在电解液部分进行介绍.
1.2 镍锰酸锂
镍锰酸锂(LiNi0.5Mn1.5O4)是一种具有尖晶石型结构的锂离子电池正极材料(无序尖晶石、有序尖晶石P4332)[20],具有锂离子脱嵌速率快、能量密度大、安全无污染等优点,且其工作电压可高达4.7 V,这赋予了其优秀的高功率潜能[21].然而,由于尖晶石型结构的Jahn-Teller效应以及电解液中锰离子的溶解与歧化反应[1,22],导致了该材料在高电压下循环稳定性不佳,如何解决这一问题成为进一步优化材料的关键.材料纳米化是一种可行的方法,能够有效提升材料中锂离子的传输速率.Hong等[20]用水热法制成LiNi0.5Mn1.5O4纳米颗粒,材料工作电压范围为3.5~5.0 V,在10C电流下循环1000次后放电比容量仍高达105 mA·h·g-1(电极堆积密度为1.59 g·cm-3).然而,纳米化带来过高的比表面积会增强与电解液的副反应,使得电池容量在循环过程中有一定的衰减,材料复合亦是提升镍锰酸锂循环稳定性的方法之一.Jia等[23]将LiNi0.5Mn1.5O4与氧化石墨烯(GO)复合,复合材料在3.8~4.9 V的电压范围内比容量为131.2 mA·h·g-1,在 10C 电流下放电比容量为94 mA·h·g-1(活性物质载量为4 mg·cm-2).Fang 等[24]将 LiNi0.5Mn1.5O4与碳纳米管(CNT)复合,在3.5~5.0 V电压范围内复合材料在20C电流下充放电仍有80%的容量保持率,10C电流循环100次后容量无明显衰减(活性物质载量为5 mg·cm-2).表面包覆也被用来提高镍锰酸锂材料的倍率性能和循环稳定性,如采用 Al2O3[25]、LiBO3[26]、LaFeO3[27]和PANI[28]等对镍锰酸锂材料进行表面包覆改性.
1.3 高电压三元材料
三元材料镍钴锰酸锂(Li(NiCoMn)O2,简称NCM)是近年来研究最多的锂离子电池正极材料之一.三元材料按照镍、钴、锰三种元素的计量比通常可分为111型LiNi1/3Co1/3Mn1/3O2、523型LiNi0.5Co0.2Mn0.3O2、424 型LiNi0.4Co0.2Mn0.4O2与811型LiNi0.8Co0.1Mn0.1O2等几种.三元材料中镍元素的含量决定了其高压下的容量性能,但过高的镍含量会导致材料的稳定性降低;钴元素的存在则主要起到稳定材料层状结构及提升材料倍率性能的作用;锰元素不参与电化学反应,主要作用为维持材料结构稳定.高电压三元材料存在的主要问题在于其首周库伦效率不高(通常小于90%),且高电压三元电池体系尚不成熟,未有与之匹配的完整电池体系等.Jurng等[29]在NCM表面包覆了纳米Al2O3材料,可以抑制高电压(4.6~4.8 V)条件下过渡金属元素的溶解和活性材料的损失.Park等[30]将NCM111颗粒用AlF3包覆,发现材料的循环性能、热稳定性和离子电导率显著提升.
除了考虑材料本身外,对锂离子电池输出功率有较大影响的正极因素还有正极极片厚度、导电剂种类等.作者课题组使用4.4 V功率型NCM523三元正极材料,研究了不同涂布厚度(40~70 μm)电极的倍率性能,发现40 μm厚度的正极可以兼顾电池的能量密度和倍率性能;研究了碳纳米管导电剂(CNT,天奈科技)与导电炭黑(CB)的不同配比对电池倍率性能的影响,结果表明使用(66% CNT + 34% CB,百分数为质量分数)混合导电剂的正极在高倍率下的比容量及倍率性能更优,如图2所示.此外,作者课题组采用专有技术的介孔石墨烯与导电炭黑作为复合导电剂,NCM111电极的倍率性能优于采用常规的导电炭黑和导电石墨的电极,这归因于介孔石墨烯的高导电性和介孔石墨烯与NCM材料之间的协同作用[31-32].
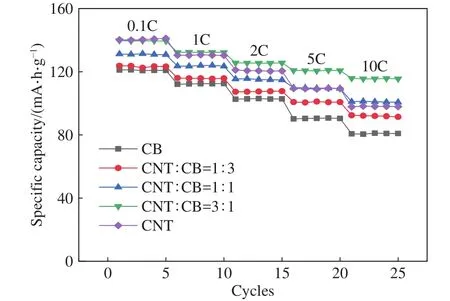
图2 采用不同质量比导电剂的正极倍率性能曲线Fig.2 Curves of rate capabilities of the cathode with various weight ratio of conductive additives
作者课题组将锂离子电池正极材料与电容性的活性炭材料复合制备具有电池和电容内并联结构的锂离子电池电容,与三元锂离子电池相比倍率性能和循环稳定性得到显著增强.随着三元材料含量的增加,锂离子电池电容正极的比容量和能量密度增加,但是倍率性能下降.在复合电极中活性炭发挥了以下作用:(1)活性炭与NCM、导电炭黑之间形成导电网络,提高了正极的电子电导;(2)活性炭的多孔结构可以吸附和保持较多的电解液,缩短了Li+输运距离;(3)电池成分与电容成分的协同作用[33-35].在此工作基础上,作者课题组提出了一种基于分体式双材料正极结构的锂离子电池电容,通过将两种三元NCM和活性炭(AC)制备成独立的极片,采用叠片工艺并联在一起从而形成双材料正极,并与软碳(SC)负极组装成(NCM+AC//SC)锂离子电池电容,如图3所示[36].结果表明,该结构的双材料正极具有电化学极化小、能量效率高的特性;混合器件单体具有较高的能量密度,优异的倍率性能、脉冲性能和循环稳定性.正极中电池材料和电容材料的质量分数分别为67%和33%的全电池能量密度可达到173.3 W·h·kg-1(基于正、负电极材料),在50C和100C的放电电流下其容量保持率分别为65.6%和48.7%,在恒流充/放电循环10000周后其容量保持率仍超过80%.
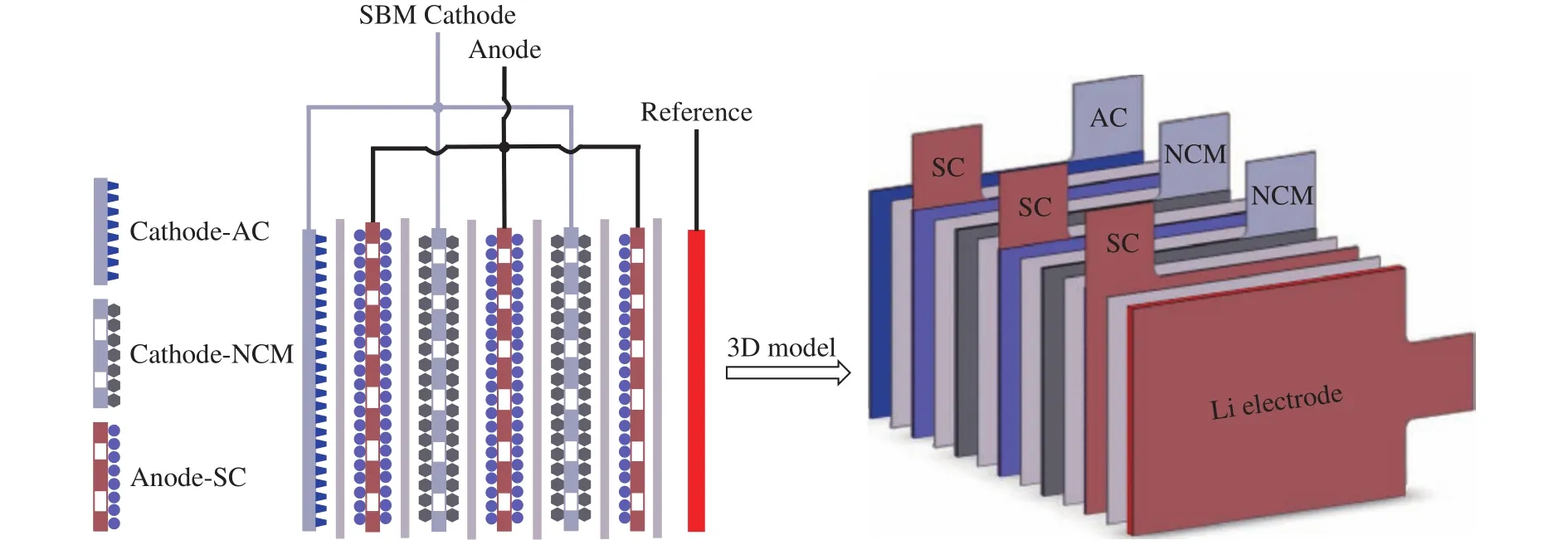
图3 分体式双材料正极结构的锂离子电池电容结构示意图[36]Fig.3 Schematic of the structure and assembly of a typical three-electrode lithium-ion battery-capacitor (LIBC) pouch cell with segmented bi-material cathodes[36]
2 负极材料
负极材料作为高功率锂离子电池的关键组成部分一般具有以下特征[37]:(1)具有较高的可逆嵌锂容量以满足电池能量密度的要求;(2)嵌脱锂反应具有较低的氧化还原电位,以获得较高的电池输出电压;(3)具有较低的电子和Li+输运阻抗,以获得较高的倍率和低温性能;(4)充放电后的化学稳定性好,以提高电池的循环性、安全性并降低电池的自放电.负极材料主要包括碳系材料、钛基材料和金属氧化物材料等.
2.1 碳系材料
碳系材料是锂离子电池最常用的负极材料,主要包括石墨、软碳、硬碳等,具有价格低廉、资源丰富等优点.其中,石墨主要有六方或菱形层状结构的天然改性石墨和人造石墨,空间结构为P63/mmc或R3m,软碳和硬碳分别为易石墨化碳和难石墨化碳,均属无定形结构[37].作者课题组对比了人造石墨(CAG)、石墨化的中间相碳微球(MCMB)和硬碳材料(HC),发现MCMB材料具有较高的比容量,而硬碳材料由于其无序结构和较宽的石墨层间距而具有更优的插嵌锂动力学性能,三者的倍率性能依次为:HC > MCMB > CAG[35];还对比研究了两款商用的硬碳和软碳材料,两者在2 A·g-1电流密度下的比容量分别是133 mA·h·g-1和203 mA·h·g-1(活性物质载量为3.8 mg·cm-2)[38].潘广宏等[39]采用原位方法化学合成了硬碳与软碳的复合材料,该复合碳材料兼具软碳和硬碳的优点,且性能优于机械混合碳材料,在保持高比容量和高首效的前提下倍率性能尤为突出.Zhang等[40-41]采用自蔓延高温合成的方法制备了介孔石墨烯、碳纳米管与空心碳纳米盒等几种纳米碳材料,并研究了其储锂性能,其在1 A·g-1电流密度下的比容量分别为486、267和227 mA·h·g-1(活性物质载量为1.2~1.5 mg·cm-2),但其首周库仑效率较低(约为50%),这类材料如用于全电池需进行预嵌锂操作来弥补首周锂的损失.
2.2 钛基材料
钛酸锂(Li4Ti5O12,LTO)为尖晶石结构,具有“零应变”结构特性(充放电过程中体积几乎不变)、较大的理论比容量、较高的锂离子扩散系数以及不发生析锂等优点,是一种极具潜力的高功率锂离子电池负极材料[42-43].钛酸锂的缺点是本征的离子和电子电导率偏低,在大电流充放电条件下容量衰减快、倍率性能较差,通过改性可显著提高LTO材料的倍率性能.LTO材料的改性途径包括:(1)通过粒径分布和形貌特征的调控制备纳米LTO,使材料与电解液充分接触,从而缩短Li+的扩散距离、提高扩散速率;(2)通过元素掺杂形成晶格畸变和晶格缺陷,提高Li+扩散速率和电子导电率;(3)采用导电材料包覆提高LTO的电子导电性.钛酸锂的制备方法有高温固相法、溶胶凝胶法、溶剂热法和静电纺丝法等,其中溶剂热法和溶胶凝胶法容易得到形貌和成分可控、晶粒生长完整的纳米钛酸锂,且溶胶凝胶法可实现对钛酸锂的原位碳包覆[44].Yan等[45]利将P5+掺杂到Li4Ti5O12中得到Li4Ti5-xPxO12负极材料,在1C电流下首次放电比容量为132.1 mA·h·g-1,经 500 次循环后放电比容量为128.3 mA·h·g-1,容量保持率为97.1%;该研究团队还研究了Mg2+、Ca2+、Al3+作为掺杂离子对LTO材料改性,其中Al3+掺杂效果最佳[46].
2.3 金属氧化物材料
根据储能机理金属氧化物负极材料可分为[47]:(1)合金化储锂材料,在充放电过程中通过与锂形成合金储锂,主要为硅基氧化物[48-50]和锡基氧化物[51];(2)转化型嵌锂材料,存在氧化还原反应和价态的变化,如CoO[52]、MnO[53]等过渡金属氧化物.Liu等[54]研究了无序岩盐结构的Li3V2O5负极材料(图4),这种材料通常作为锂电池的正极材料,然而用作负极材料可以在0.6 V平台电位下可逆插嵌两个锂离子,从而消除了高充电倍率下的锂沉积现象,这使电池更安全;嵌锂电位低于钛酸锂的1.5 V使得电池可以存储更多的能量;在1 A·g-1电流密度下容量可达200 mA·h·g-1(活性物质载量为2~3 mg·cm-2),与 NCM811 材料组装成全电池后在0.5 A·g-1电流密度下循环充放电1000次循环容量保持率为86.9%;并且可以具有较好的快速充放电能力,在20 A·g-1电流密度下发挥超过40%的容量.作者课题组Liu等[55]采用一步固态反应的方法合成碳包覆的Li3VO4,可逆容量可达416 mA·h·g-1(活性物质载量为3.8 mg·cm-2),在2 A·g-1电流密度下容量为110 mA·h·g-1,以 0.5 A·g-1电流密度循环500周容量几乎无衰减.Zhang等[56]采用低温热处理的方法一步合成了Fe3O4/石墨烯纳米复合材料,在0.1 A·g-1电流密度下可逆储锂容量达 820 mA·h·g-1,在 3 A·g-1电流密度下容量为300 mA·h·g-1.Qu等[57]制备了NaBO2包覆的Fe3O4复合材料,在2 A·g-1电流密度下比容量达733 mA·h·g-1(活性物质载量为1.5 mg·cm-2),这可归因于纳米化的Fe3O4基体和高离子电导率的NaBO2包覆层.Qin等[58]采用水热法和退火热处理合成了T-Nb2O5纳米棒材料,具有较高的扩散动力学和高倍率性能,在2 A·g-1电流密度下比容量达 147 mA·h·g-1(活性物质载量为3.5~4.2 mg·cm-2).Qu等[59]和Yang等[60]通过微观N掺杂制备了蛋壳结构的表面包覆有Li2CO3、Si3N4和SiOx的纳米硅材料,可有效抑制颗粒的粉化,在2 A·g-1电流密度下比容量达 1117 mA·h·g-1(活性物质载量大于1 mg·cm-2).作者课题组研究了将SiO颗粒分散于具有纳米结构的导电碳黑基体中,形成有效的电子导电网络、提高了电极的电子导电性;CB具有硬碳的储锂特性,可作为快速储锂的负极活性材料,其吸纳的电解液可缩短离子扩散距离;CB具有膨松的结构,为氧化亚硅颗粒提供足够的体积变化空间,避免电极的粉化和失效[49].此外,由于SiO材料具有超高的储锂能力,将SiO与软碳或石墨复合用作负极可显著提升高功率器件的能量密度和循环性能[48,61].

图4 密度泛函理论 (Density functional theory, DFT)计算无序岩盐结构 Li3+xV2O5的 Li位置占有率和电压曲线[54].(a)0-TM(T1)和1-TM(T2)四面体Li插入位点;(b)当Li插入0-TM(T1)位点时四个相邻的LiO6八面体的偏心位移;(c)根据DFT计算,在插入Li+后四面体和八面体中Li位置占有率的演变;(d)相对于锂电极的实验电压曲线和根据PBE+U泛函计算得出的的电压曲线Fig.4 DFT-calculated Li site occupancies and voltage profile for DRS-Li3+xV2O5[54]: (a) 0-TM (T1) and 1-TM (T2) tetrahedral Li insertion sites; (b) offcenter displacements of four neighboring LiO6 octahedra upon Li insertion into the 0-TM (T1) site; (c) evolution of Li site occupancies in the tetrahedral and octahedral sites upon Li insertion determined via DFT calculations; (d) experimental and computational voltage profiles calculated using the PBE + U functional
3 有机电解质溶液
锂离子电池电解液通常由锂盐和混合有机溶剂组成,起到连接电池正负极和传输锂离子的作用,很大程度地影响着锂离子电池的功率密度、倍率、高低温及循环性能.高功率锂离子电池中电解液也发挥着重要的作用,对电解液的各项成分进行合理的优化和调整能够有效提高其耐高压性能和倍率性能,进而实现输出功率的提升.
3.1 锂盐
锂盐应用于锂离子电池需满足如下条件[62-64]:(1)在有机溶剂中具有较高的溶解度,Li+易于解离、在电解液中具有较高的电导率;(2)具有较高的抗氧化还原稳定性,与有机溶剂、电极材料和电池部件不发生电化学和热力学反应;(3)环境友好,易于制备、提纯和产业化.六氟磷酸锂(LiPF6)是锂离子电池电解液中最常用的锂盐,具有良好的电化学稳定性和电导率,且分解产物有利于形成稳定的SEI膜;其主要缺点在于热稳定性较差,在溶液中的分解温度仅约为130 ℃.常见锂盐还包括高氯酸锂(LiClO4)、六氟砷酸锂(LiAsF6)、四氟硼酸锂(LiBF4)等.LiAsF6热稳定性好、不易分解,但As元素有剧毒;LiClO4电导率适中,但是作为一种强氧化剂存在电池安全问题[65];LiBF4低温性能好、电导率高,电化学窗口宽,热稳定性好,但单独使用时不易在负极表面形成稳定的SEI膜[66].新型锂盐有双三氟甲基磺酰亚胺锂(LiTFSI)、双氟磺酰亚胺锂(LiFSI)、二氟草酸硼酸锂(LiDFOB)、二草酸硼酸锂(LiBOB)和氟烷基磷酸锂(LiFAP)等[67-69].LiTFSI抗氧化性和热稳定性强,但存在对正极集流体的腐蚀问题.LiFSI与LiPF6相比具有更优的热稳定性、水解稳定性和更高的离子电导率,在碳酸乙烯酯(EC)/碳酸甲乙酯(EMC)(体积比为3:7)混合溶剂中的离子电导率的顺序为:LiFSI > LiPF6> LiTFSI > LiClO4> LiBF4,具有良好的低温倍率性能,同时不存在腐蚀正极铝箔的问题[70-71].LiFAP憎水性强,不易发生水解,在有机溶剂中具有较高的离子电导率,具有较好的抗氧化性和热稳定性.LiBOB稳定性较高,分解温度可达302 °C,但与某些正极材料如钴酸锂的匹配度不高[72].LiODFB是一种比LiBOB更易溶于有机溶剂的硼系锂盐,其电解液在较宽温度范围内具有较高的离子电导率[70].此外,LiBOB和LiDFOB还是良好的电解液成膜添加剂.
3.2 有机溶剂
锂离子电解质溶液的物理化学性能及电池的电化学性能与溶剂的性质密切相关,合适的溶剂选择能够有效提升电池的高功率性能.通常溶剂的选择应符合下述基本要求[62-64]:(1)至少有一种组分溶剂具有较高的介电常数,使溶剂体系具有足够高的溶解锂盐的能力;(2)具有较低的黏度使电解液中的Li+更容易迁移;(3)对电池的各个组分都是惰性的,在电池工作电压范围内与正负极有良好的兼容性;(4)有较低的溶点、较高的沸点和闪点,无毒无害、成本较低.
常用的有机溶剂有碳酸酯类、醚类和砜类等.碳酸酯分为链状碳酸酯和环状碳酸酯,链状碳酸酯包括碳酸二甲酯(DMC)、碳酸二乙酯(DEC)和碳酸甲乙酯(EMC)等,环状碳酸酯包括碳酸乙烯酯(EC)和碳酸丙烯酯(PC)等[73].链状碳酸酯具有较低的介电常数和较低的黏度和较窄的液态温区;环状碳酯具有较高的介电常数、较高的黏度和较高的熔点和沸点,所以一般在电解液中会采用链状和环状混合的碳酸酯类溶剂.醚类则具有比较适中的介电常数和比较低的黏度.传统的碳酸酯类溶剂由于其耐高压性能有限,故而新型高电压溶剂(如氟类溶剂、砜类溶剂等)的开发、混合溶剂的使用以及对常规有机溶剂的改性成为高功率锂离子电池电解液溶剂方面研究的重点.
Wu等[74]研究了亚硫酸二甲酯(DMS)、环丁砜(TMS)和亚硫酸二乙酯(DES) 等砜类溶剂,将LiBOB、LiPF6和LiTFSI等锂盐分别加入TMS/DMS (体积比为1∶1)和TMS/DES (体积比为1∶1)混合溶剂中,发现电解液的室温离子电导率均超过3 mS·cm-1,电压窗口均超过5.4 V,显示了砜类溶剂优异的耐高压性能.砜类溶剂的不足在于其黏度较大,通常需要助溶剂.此外,砜类还可用作电解液添加剂来匹配三元高电压正极材料.Chen等[75]发现LiDFOB-EC/EMC/DMS电解液促进了SEI膜的成膜作用、提升了电解液的电导率.
3.3 添加剂
添加剂是锂离子电池电解液中占比最小的成分,但是其重要性却不可忽略[76].根据组成分类电解液可分为[77]:含硫添加剂、有机磷类添加剂、含硼类添加剂、碳酸酯类添加剂.根据功能分类添加剂可分为:成膜添加剂、离子导电添加剂、阻燃添加剂[78]、过充保护添加剂、控制电解液中酸和水含量的添加剂等[64];对于高功率锂离子电池来说,更为关注前两者.主要的负极成膜添加剂包括碳酸亚乙烯酯(VC)、亚硫酸丙烯酯(PS)、亚硫酸乙烯酯(ES)和氟代碳酸乙烯酯(FEC)等,而三氟乙基甲基碳酸酯(FEMC)[79]、双氟草酸硼酸锂(LiDFOB)、双草酸硼酸锂(LiBOB)、三苯基亚磷酸酯(TPP)、三(三甲基硅烷)硼酸酯 (TMSB)[80]等用来促进和优化正极CEI膜的形成(图5).常用的离子导电添加剂有12-冠-4醚、阴离子受体化合物和无机纳米氧化物[81]等,均能有效提高电解液的离子电导率[64].

图5 添加剂TMSB增强锂离子电池高电压性能的作用机制[80]Fig.5 Fundamental roles of the TMSB to enhance the high-voltage performance of the LIB[80]
3.4 电极预嵌锂
负极预嵌锂工艺是提升锂离子电池功率性能的有效手段之一.在锂离子电池制备工艺中,预嵌锂的意义在于:硅基、无定形碳、石墨烯等负极材料首周库仑效率低(80%~90%),导致化成过程对正极材料中Li+的消耗较多;且1.0~3.0 V的电位区间容量占比较大,这部分容量不能被全电池有效利用;预嵌锂可补偿Li+的消耗并使负极的电位降至工作区间,从而提升电池的平台电压、提高电池的功率密度和能量密度,如图6所示[33].
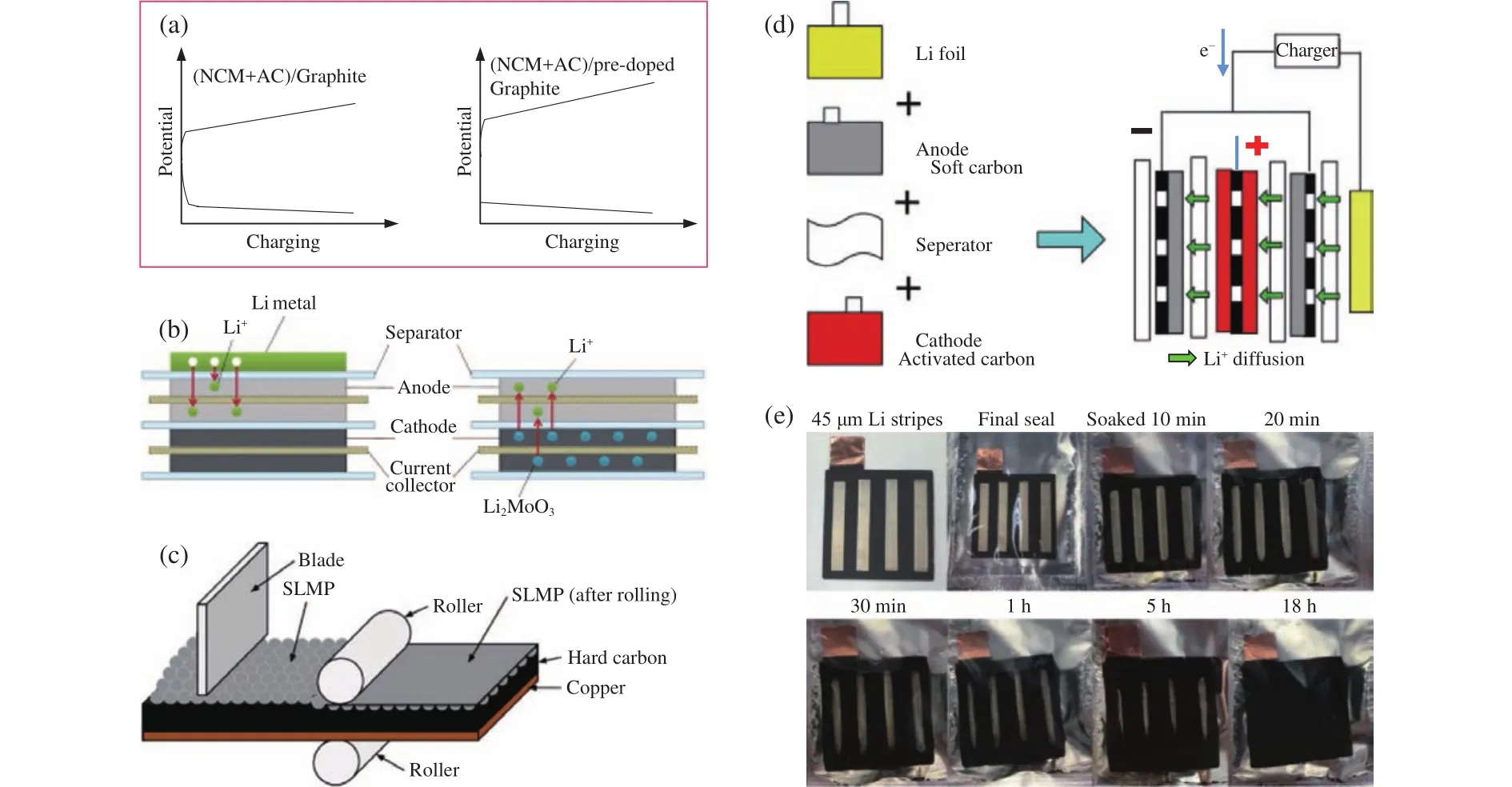
图6 高功率锂离子电池预嵌锂方法示意图.(a)预嵌锂效果图[33];(b)负极掺杂锂和正极掺杂锂示意图[82];(c)钝化锂粉(SLMP)方法预嵌锂[83];(d)电化学方法预嵌锂[84];(e)锂金属接触方法预嵌锂[85]Fig.6 Schematic diagram of pre-lithiation method for high power LIBs: (a) potential changes before and after pre-lithiation [33];(b)pre-lithiation approaches of Li foil and cathode additives[82];(c) SLMP powder pre-lithiation method [83];(d)electrochemical pre-lithiation method [84];(e) Li metal contact prelithiation method [85]
预嵌锂的方法包括从正极嵌锂和从负极嵌锂,其中,从正极嵌锂是指将富含锂的化合物掺杂在正极材料中,在充电过程中Li+不可逆地脱出并嵌入到负极材料中,这类化合物有氮化锂Li3N[86]、Li2MoO3[82]、Li5ReO6[87]、Li6CoO4[88]、Li2CuO2[89]、Li5FeO4[90]和Li2C4O4[91]等.从负极嵌锂包括将钝化锂粉(SLMP)[83,92-93]或金属锂箔压覆/贴合到负极表面[85],以及通过电化学[35,84]或短路方法[33]在充放电过程中实现预嵌锂.还有报导采用电解液中的有机锂盐进行预嵌锂,如3,4-二羟基苯甲腈二锂盐[94].其中,金属锂箔贴合法、电化学预嵌锂法、短路预嵌锂法和钝化锂粉压覆法等已实现工业化生产或小批量生产,而这些预嵌锂方法对高功率锂离子电池、锂离子电池电容和锂离子电容器都是适用的.
4 总结与展望
本文主要从正极材料、负极材料、电解液和预嵌锂方法等方面综述了“快放型”高功率锂离子电池.受限于应用需求和快速充电时负极易于析锂等因素的影响[95-96],“快充型”锂离子电池并未受到过多关注.然而,作为一种兼具超级快充和超级快放性能的锂离子储能器件,锂离子电容器尤其适合秒级至分钟级场景的储能应用,可以在秒级时间内完成充电和放电过程,且循环寿命超长(100万周),可实现与锂离子电池的配合使用[97].同时,锂离子电容器与高功率锂离子电池在融合发展,两者之间的界限也在日趋模糊[98].
随着社会发展对高功率锂离子电池的迫切要求,近年来电池的功率性能也有了很大提高.根据国内学术会议报道,目前高功率锂离子电池的实验室产品已实现约1000C电流脉冲放电,峰值功率密度可达100 kW·kg-1,预测在2035年高功率锂离子电池可实现2000C电流脉冲放电,峰值功率密度可达200 kW·kg-1.根据锂离子电池功率的计算公式可知,可通过提高工作电压和降低内阻来提高单体的功率密度.单体电压取决于锂离子电解液的稳定电压窗口和正/负极材料的嵌锂平台电位,需重点研究抗氧化性强且与负极匹配性好的非水电解溶液体系、高电压正极材料和嵌锂电位低的负极材料.单体内阻的降低可通过采用高离子电导率的电解液、具有快速脱/嵌锂特性的正/负极材料、薄的电极片和高效导电添加剂等来实现.
