小鼠睾丸组织玻璃化保存的初步实验研究
2022-04-07郭莹莹周新丽
谭 佳 郭莹莹 周新丽
(上海理工大学生物热科学研究所 上海 200093)
近50年来,男性精子数量呈大幅下降趋势[1],且男性不育症的患病率已接近10%[2],这引发了人们对现代环境影响生育的担忧。男性不育可能是由多种潜在因素造成的,包括精子产生和精子传递缺陷。其中,非梗阻性无精症是影响男性生殖健康最为严重的一类表型,目前尚缺乏使患者恢复生精功能的治疗手段。此外,医疗手段的进步使青少年癌症患者的整体生存率提高,但放化疗对其生育力的损伤在一定程度上是不可逆的,男性儿童癌症幸存者的不孕不育率已达到46%[3]。由于精液冷冻仅适用于青春期后的患者,对于还未产生精子的青春期前男孩并不适用。已有研究证实对青春期前的女孩进行卵巢组织的冷冻保存,并在成年时移植,可恢复其生育能力[4]。那么,对于无法取精的不育患者,或者患有癌症需放化疗的精液中未产生精子的青春期前男孩,将其睾丸组织进行冷冻也是潜在的保存生育力的方法。冷冻复苏后的睾丸组织可自体移植,重建生精过程,使患者恢复生育力而自然生育。
睾丸组织的低温保存方法主要有慢速冷冻法与玻璃化冷冻法,两者的主要区别在于冷冻保护剂(cryoprotectant, CPA)的浓度和使用的冷却速率。在慢速冷冻保存中,即使在最佳冷却速率下,仍不可避免细胞外冰晶带来的机械损伤。而在玻璃化冻存中,细胞及高浓度保护剂溶液以足够快的冷却速率降温,从而形成玻璃态,理论上避免了胞内外结晶引起的冰晶损伤。但睾丸组织由于体积较大,且细胞的渗透特性不一,与单个细胞(如精子)相比,玻璃化保存也更具挑战性。目前,关于成人和青春期前小鼠睾丸组织玻璃化冻存的研究尚不完善,且有学者指出玻璃化冻存可能诱导细胞损伤,导致细胞活力降低、诱导细胞凋亡、DNA完整性丧失等[5]。
玻璃化冻存在冷冻前需要加载较高浓度的CPA,由于睾丸组织自身对水及保护剂的渗透能力较低,若加载时间过短,保护剂无法渗透至生精小管内部;若加载时间过长,将导致组织表层的精原细胞长期暴露于保护剂溶液中,使其受到较大的渗透损伤和毒性损伤[6]。因此,为了在渗透作用与毒性作用之间找到平衡,最大限度地提高保护剂对睾丸组织的保护作用,需要对睾丸组织玻璃化冷冻所使用的保护剂种类、浓度及加载时间进行优化。C. Yildiz等[7]对比了三种不同浓度及加载时间的一日龄新生小鼠的整个睾丸组织玻璃化冻存效果,分别为:1)G. Rahimi等[8]的冻存方法:一步法添加保护剂,体积分数为40%的EG+体积分数为18%的Ficoll+0.35 mol/L蔗糖,在1.8 mL冻存瓶中浸泡6 min后直接投入液氮;2)F. Migishima等[9]的冻存方法:两步添加保护剂,体积分数为7.5%DMSO的保护剂溶液中浸泡5 min,转移至体积分数为15%的DMSO+1 mol/L乙酰胺+3 mol/L丙二醇中浸泡3 min,装载于1.5 mL冻存管投入液氮;3)R. C. Chain等[10]的冻存方法:两步添加保护剂,在体积分数为7.5%的EG+体积分数为7.5%的PROH中浸泡5 min,转入体积分数为15%的EG+体积分数为15%的PROH+0.5 mol/L蔗糖中浸泡2 min后,装载于冻存管投入液氮,将各组睾丸组织冷冻复温后移植于小鼠体内,观察组织移植后产生精子的能力,结果表明,只有第一组高浓度保护剂玻璃化产生了活性精子。可以看出,目前睾丸组织玻璃化冻存方法中所使用的保护剂种类、浓度及加载方案区别较大,所得到的冻存结果也相差很大。
目前关于睾丸组织冻存的研究,大多以复苏后细胞和组织的活性对冻存方法进行评价,并以此为依据调整冻存工艺,耗费较多的材料和人力。M. Curaba等[11]以乳酸脱氢酶释放试验评估的组织活力,免疫组化检测的细胞凋亡和增殖,光镜检测的小管直径、完整性和细胞密度作为标准,对比了青春期前小鼠睾丸组织玻璃化和慢速冷冻的结果,结果显示两种方法均保留了青春期前小鼠睾丸组织的存活、发育和完整性。C. S. Andrae等[12]以生精小管基底膜脱离的比例、各类细胞的凋亡情况为依据,对比了灰狼睾丸组织玻璃化和慢速冷冻,结果表明慢速冷冻可以更好地保持冷冻保存的睾丸组织形态。差示扫描量热法通过测量样品在特定的降温程序下发生结晶现象时的相变温度和相变过程中的焓变,判断特定种类及浓度的保护剂抑制冰晶形成和生长的能力,从而对保护剂的选择起到指导作用[13],大大减少了实验工作量。李鑫等[14]借助差式扫描量热仪(DSC) 研究了天然氨基酸中的L-赖氨酸、L-脯氨酸、甘氨酸和 L-丝氨酸水溶液的成核温度、结晶焓和冰点温度随溶液浓度及降温速率的变化规律,获得了4种氨基酸低温保护剂水溶液的未冻水含量,并分析了氨基酸类保护剂与水分子的作用机理。受以上研究的启发,若运用DSC检测加载保护剂后睾丸组织在降温过程中形成组织内冰晶的相变温度及相变焓,可用于研究不同体积分数保护剂溶液及不同浸泡时间加载保护剂后,抑制组织内形成冰晶的能力,对睾丸组织冻存过程中保护剂加载方案的选择具有指导性意义。
基于以上分析,本文首先运用差示扫描量热仪,对在不同体积分数保护剂中浸泡不同时间后的睾丸组织进行热分析,推测不同保护剂加载方案对组织内部抑制冰晶形成的能力;其次,对睾丸组织进行玻璃化冷冻保存,结合热分析结果及睾丸组织的冻后管腔完整率及组织内各生殖细胞的凋亡率,综合分析玻璃化冻存效果;最后,将睾丸组织玻璃化冻存与优化的慢速冷冻保存结果进行对比,得出更适用块状睾丸组织冷冻的方法。本研究的结果对推动人睾丸组织冻存的临床应用有参考意义。
1 材料与方法
1.1 主要试剂及其配置
睾丸组织基础液为含体积分数为20%FBS的DF12(DMEM/F-12 medium)培养液。用基础液按照体积分数配置三组玻璃化冷冻液、复苏溶液及洗涤溶液,具体组成如表1所示。每组玻璃化冷冻液由平衡溶液(equilibration solution, ES)和玻璃化溶液(vitrification solution, VS)两部分组成。

表1 玻璃化冷冻液及复苏液
1.2 小鼠睾丸组织采集
选取5~8周龄的雄性小鼠,将其安乐死后快速置于手术台上,用酒精棉轻轻擦拭腹部,用消毒后的无菌剪刀剪开小鼠下腹部,找到睾丸后剪去附睾连接组织以取出睾丸,置于室温下(约24~26 ℃)的睾丸组织基础液中,用镊子与剪刀夹住睾丸表面白膜轻轻撕开,获得睾丸内部组织,备用。
1.3 睾丸组织的保护剂溶液加载方案
睾丸组织采用两步法进行玻璃化保护剂的加载。首先,将睾丸组织在各组平衡溶液(ES1、ES2、ES3)中浸泡10 min,然后在其对应的保护剂溶液(VS1、VS2、VS3)中分别加载1、3、5 min,得到9组保护剂溶液加载方案。以玻璃化溶液中DMSO的体积分数和加载时间表示9种保护剂的冷冻方案,如表2所示。例如20%(体积分数)-1 min表示睾丸组织在平衡溶液ES1中浸泡10 min,然后对应的保护剂溶液VS1中加载1 min。
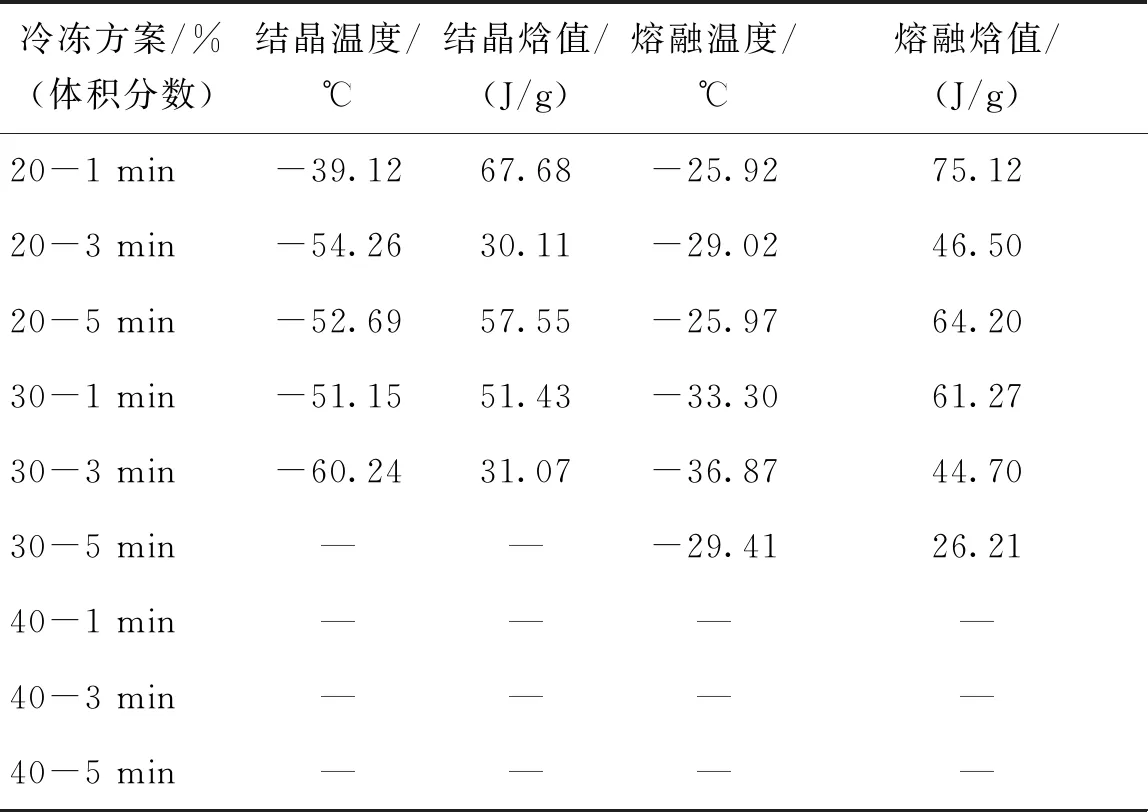
表2 睾丸组织在不同保护剂加载方案后的热分析
1.4 睾丸组织的量热分析
采用差示扫描量热仪(DSC200 F3,Netzsch,德国)进行热分析,实验前进行温度和灵敏度校准。实验每组取约9 mg小鼠睾丸组织,按照两步法保护剂加载方案在对应的保护剂溶液中平衡对应时间后,将组织放置于吸水纸上停留3 s吸取组织表面残留溶液,然后将组织平铺于铝坩锅中,将铝坩锅及参皿放入分析腔,以100 ℃/min的降温速率将样品温度降至-150 ℃,然后以100 ℃/min的升温速率将样品加热至室温25 ℃。根据升降温的热流曲线记录每组升降温过程中的结晶温度、结晶焓、融溶温度及熔融焓。每组实验重复3次。
1.5 睾丸组织玻璃化冷冻
玻璃化塑料载片(郜鸿生物科技有限公司,上海)由带有标圈的塑料薄片及手柄组成,为方便在液氮中移动操作,用铁丝将其固定。玻璃化冷冻实验步骤如图1所示。实验分9组,每组取1/3个睾丸,分别按照9种保护剂加载方案在对应的保护剂溶液中平衡对应时间,加载完成后吸去多余保护剂溶液,将睾丸组织平铺于冷冻载片上,随后迅速投入液氮保存。1 h后依次取出,将含有组织的一端浸入提前预热至37 ℃的复苏溶液中,组织解冻从载片脱落后继续平衡1 min,将组织转移至洗涤溶液1中平衡3 min,然后转移至洗涤溶液2中继续平衡5 min,随后取出用DF12洗涤2~3次,放入含有体积分数为10%的FBS的DF12溶液的孔板内,放置于CO2培养箱培养6 h。
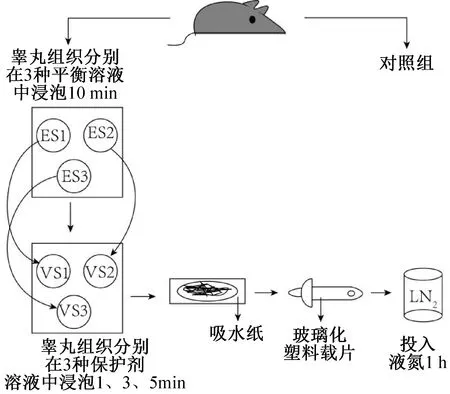
图1 玻璃化冷冻步骤
1.6 睾丸组织慢速冷冻程序
郭莹莹[15]对睾丸组织的慢速冷冻方法进行了优化,其慢速冷冻保护剂按照体积分数配置为:10% DMSO+10%FBS+0.1 mol/L蔗糖+DF12。首先在1.8 mL冻存管中装入1 mL慢速冷冻保护剂,然后取半颗小鼠睾丸放入冻存管中,最后将小鼠睾丸组织以改进两步法在程序降温仪(CryoMed Freezer 7453, Thermo Fisher Scientific, USA)中进行冷冻。改进两步法冷冻程序为:1)4 ℃停留10 min以加载低温保护剂;2)1 ℃/min降至-40 ℃,停留1 min;3)快速取出投入液氮。复温时从液氮中快速取出冻存管,置于37 ℃恒温水浴锅复温,至冰晶融化。然后将冷冻管中的组织块取出,放入1 mL的培养液中10 min去除保护剂,并用培养液洗涤3次。将组织放入装有1 mL培养液的孔板内,放置于CO2培养箱培养6 h。
1.7 睾丸组织的冻存效果评价
睾丸组织形态以及生精小管内部结构完整性主要通过HE染色评价。半定量评估切片组织的管腔完整性,正常结构评分为1,管腔受到损伤结构评分为0。当观察到以下结构变化时结构评分为0∶1)精原细胞从基底膜分离;2)基底膜破裂;3)小管内出现体积较大的空泡;4)小管内空泡面积超过单根小管截面积的40%。最终管腔完整率计算方法见式(1),每个实验组分别取3组平行,最终取平均值。
管腔完整率=
(1)
冷冻复温后睾丸组织的凋亡水平采用Tunel试剂盒进行检测。按照试剂盒的说明进行组织染色,染色后在荧光显微镜下观察细胞着色情况,显色后阳性凋亡细胞核为棕黄色,存活细胞核显蓝色。在生精小管内,根据细胞形态学方法(细胞形状、核致密性和相对于基底膜的位置等)来确定各种细胞类型[16]。分别计算各类细胞总数及各类细胞凋亡数量,各生精细胞Tunel阴性率通过式(2)计算,每个实验组分别取3组平行,最后取平均值。
(2)
2 结果与讨论
2.1 睾丸组织不同方案加载保护剂后的热分析
将睾丸组织按照9种保护剂加载方案在对应的保护剂溶液中平衡对应时间,然后运用差示扫描量热仪记录浸泡后组织在降温和升温过程中的热现象,睾丸组织相应的结晶温度、结晶焓、熔融温度及熔融焓如表2所示,典型的热流曲线如图2所示。
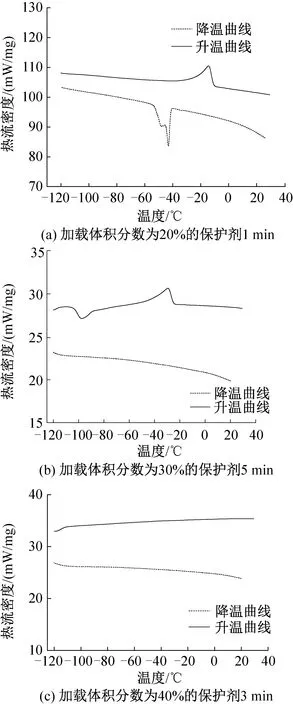
图2 睾丸组织冻融过程的热流曲线
在体积分数为20%的DMSO溶液中浸泡1、3、5 min后,典型热流曲线如图2(a)所示,降温过程中有明显结晶峰,升温过程中有明显融化峰。对比睾丸组织在体积分数为20%组保护剂中浸泡3 min及1 min的数据,3 min组相变温度降低,结晶焓值和熔融焓值均有所降低,说明升降温过程中形成的冰晶量减少。因此适当延长加载时间,可加强保护剂的跨膜运输,使组织在降温过程中抑制组织内冰晶形成的能力升高,减小组织内部冰晶形成量。而当浸泡时间延长至5 min时,熔融焓值为64.2 J/g,低于1 min组,但高于3 min组,说明5 min组在升降温过程中形成的冰晶量高于3 min组。已有研究证实,细胞在保护剂溶液中浸泡时,在渗透压差的作用下先失水皱缩,体积减小至最小值后将吸水恢复部分体积[6],组织在浸泡5 min后可能正经历吸水膨胀过程,组织内保护剂体积分数低于20%,使组织内形成冰晶量增大。
在体积分数为30%的DMSO溶液中浸泡3 min后的睾丸组织,降温过程中相变温度及结晶焓值均小于1 min组,说明浸泡3 min后的组织内冰晶形成量小于1 min组。当浸泡时间为5 min时,热流曲线如图2(b)所示,在降温过程中未出现明显结晶峰,实现了玻璃化;但升温过程中,在-103.42 ℃出现反玻璃化现象,结晶焓值为11.47 J/g, 在-29.41 ℃反玻璃化形成的冰晶开始融化,熔融焓值为26.21 J/g。
在体积分数为40%的DMSO溶液中浸泡1、3、5 min后,典型热流曲线如图2(c)所示,在降温过程中均未出现结晶峰,在复温过程中也未出现反玻璃化现象,成功在降温及升温过程中实现玻璃化。原因可能在于体积分数为40%的DMSO保护剂浓度较高,组织内外渗透压差较大,促进了水及保护剂的跨膜运输,在短时间内使组织内浓度升高至玻璃化水平,因此在升降温过程中均未出现结晶现象。
2.2 睾丸组织不同加载方案玻璃化冻存结果
将睾丸组织按照9种保护剂加载方案在对应的保护剂溶液中平衡对应时间,放在塑料载片上投入液氮中进行玻璃化冷冻保存,对冻后睾丸组织进行HE及Tunel染色,不同加载方案玻璃化的冻后管腔完整率及细胞凋亡阴性率如表3所示。
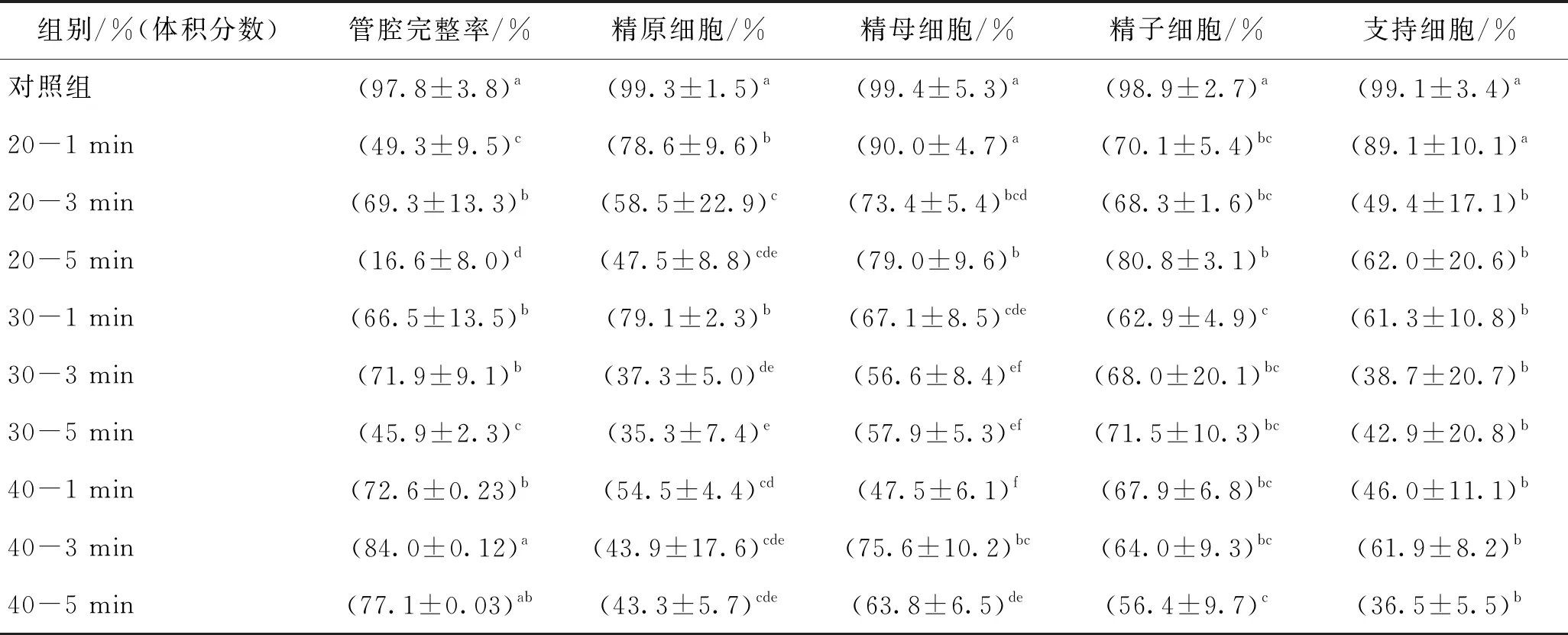
表3 不同加载方案玻璃化的冻后管腔完整率及细胞凋亡阴性率
由表3可知,当DMSO体积分数为20%时,浸泡3 min冻后睾丸组织管腔完整率为69.3%,高于1 min及5 min组。对比表2中的热分析数据,浸泡3 min后的睾丸组织熔融焓值低于1 min及5 min组,说明3 min组在降温过程中抑制组织内形成冰晶的能力较高,对管腔造成的机械损伤较小。此外,虽然DSC结果显示睾丸组织浸泡5 min后的结晶量低于1 min,但睾丸组织在保护剂溶液中长时间浸泡受到了较大的毒性损伤,导致5 min组管腔完整率低于1 min组。对比体积分数为20%的DMSO溶液中浸泡不同时间后冻融后的精原细胞凋亡情况,可以得出,随着浸泡时间的增加,精原细胞凋亡率显著增加。这可能是由于精原细胞位于管腔外周,其凋亡率易受管腔外溶液影响,与高体积分数保护剂溶液接触时间越长,精原细胞受到的毒性损伤越大。而精子细胞随浸泡时间呈现的凋亡规律与精原细胞相反,随着浸泡时间的增加,精子凋亡率下降。精子位于生精小管内部,组织内细胞种类复杂,且生精小管呈圆柱形,体表比值较大,对保护剂的渗透率较低,因此加载时间越长,保护剂渗透传质行为进行得越充分,越能实现对内部精子的保护作用。
当DMSO体积分数为30%时,浸泡3 min管腔完整率为71.9%,高于 1 min及5 min组。对比表2,睾丸组织在30%DMSO中浸泡3 min相比于1 min组结晶量降低,说明相较于浸泡1 min,浸泡3 min后组织在冻融过程中受到的冰晶机械损伤较小,因此管腔完整率较高。而5 min组在DSC热分析中显示可在降温过程中实现非晶态固化,但在升温过程中出现了反玻璃化现象。G. M. Fahy等[17]研究指出复温过程中的反玻璃化现象,极易造成细胞在复温过程中死亡。对于大体积样本而言,升温速率难以提高,若在复温过程中造成重结晶,将对细胞带来致命伤害。因此受反玻璃化影响,浸泡5 min组的管腔完整率仅为45.9%,显著低于3 min组。体积分数为30%组的冻后精原细胞及精子凋亡规律与体积分数为20%实验组相似,位于管腔外侧的精原细胞凋亡率随浸泡时间的增加而增加,而位于管腔中心的精子细胞凋亡率随加载时间增大而减小。
当DMSO体积分数为40%时,浸泡3 min后的管腔完整率(84%)高于1 min及5 min组。相比于对照组,在体积分数为40%的DMSO溶液中睾丸组织冻后精原细胞凋亡率显著提高,不同浸泡时间后的精原细胞凋亡情况无显著性差异。此外,由于体积分数为40%的DMSO浓度较高,组织内外的渗透压差较大促进了传质速率,因此,保护剂渗透至管腔内部的所需时间较短,随加载时间增加,管内精子与高体积分数保护剂接触时间增加,因此精子凋亡率随浸泡时间增加呈上升趋势。
综合分析可知,在相同的浸泡时间下,管腔完整率随保护剂体积分数的增加而增加。同时,相同浸泡时间下,高体积分数组的生精细胞凋亡率高于低体积分数组,虽然高体积分数保护剂可以促进组织内形成玻璃态,但高体积分数保护剂带来的较大毒性损伤使得组织内细胞凋亡率显著高于低体积分数组。现有研究表明,细胞的损伤与CPA的渗透和毒性作用有关[18]。J. D. Benson等[19]建立了积累性毒性损伤模型J,表明加载时间越长细胞所受累积性毒性损伤越大。现有研究多采用HE染色结果分析生精小管的组织的形态学完整性[18],但该方法的所得管腔完整率被证实还不能确切地评估睾丸组织内生殖细胞功能[20-21]。J. P. Milazzo等[21]表明Tunel染色所测定的细胞凋亡与睾丸组织功能丧失成正相关。因此,综合考虑几种生殖细胞的凋亡阴性率,筛选出运用塑料载片进行的睾丸组织玻璃化实验中,加载最优方案为体积分数为20%的DMSO保护剂加载1 min。现有研究[7-10,22]多认为高浓度保护剂对玻璃化冻存睾丸组织的效果优于低浓度保护剂。这可能是因为他们采用冻存管实现“玻璃化”,冻存体积较大,且冻存管管壁材质传热性能较低,导致组织在降温过程中可实现的降温速率较低,因此需要高浓度保护剂与低降温速率相匹配。而本实验所用冷冻载体为塑料薄片,提高了降温速率,且组织在装载前用吸水纸吸去表面多余保护剂,减小了冷冻体积,所需保护剂浓度降至体积分数为20%,并因此降低了细胞所受毒性损伤。
2.3 玻璃化冻存与慢速冻存的结果对比
将上述玻璃化冻存最优结果与郭莹莹[15]之前优化的睾丸组织慢速冷冻结果进行对比,如表4所示。慢速冷冻保存睾丸组织管腔完整率高于玻璃化组,生殖细胞凋亡阴性率均显著高于玻璃化组,且与对照组无显著性差异。B. S. Pukazhenthi等[23]研究指出冻存方法将影响冻后异种移植效果,对于新生羔羊睾丸组织,慢速冷冻保存优于快速及玻璃化冻存。C. Yildiz等[7]在冻后移植小鼠睾丸组织,结果表明慢速冷冻可维持支持细胞产生雄激素能力,而玻璃化组移植后支持细胞产生激素能力显著降低。然而,S. F. Moraveji等[22]将小鼠睾丸组织在体积分数为7.5%的EG+体积分数为7.5%的DMSO中浸泡10 min后转移至体积分数为15%的EG+体积分数为15%的DMSO中浸泡2 min,装载于冻存管投入液氮,组织冻后管腔完整率达79%,显著高于常用慢速冷冻组(62%)。M. Abrishami等[24]对比了慢速冷冻与固体表面玻璃化冷冻对小鼠睾丸组织低温保存的影响,结果显示,以DMSO作为保护剂时,在玻璃化溶液中浸泡5 min后的固体表面冷冻组织细胞存活率(80%)优于慢速冷冻组(75%)。由以上对比可知,现有研究由于样本体积、载体类型、保护剂种类与浓度及加载方案等因素的不同,对玻璃化和慢速冷冻两种冻存方法的对比并未得出统一的结论。
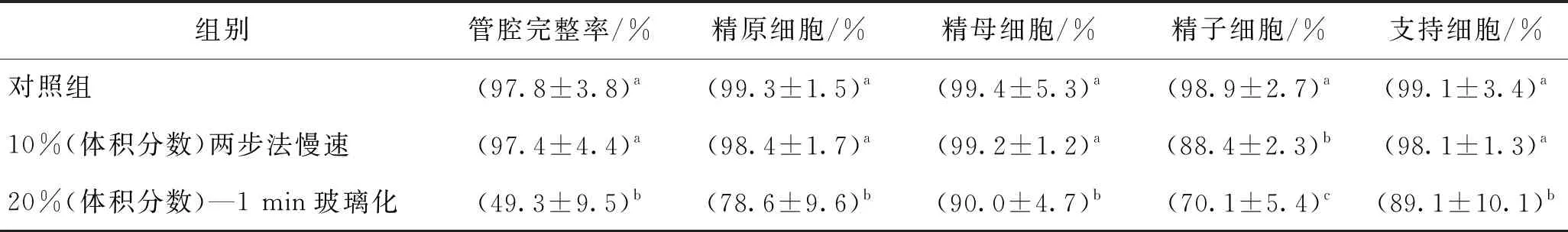
表4 玻璃化与慢速冷冻方法的冻后管腔完整率及细胞凋亡阴性率
慢速冷冻通过使用较低浓度保护剂使得在降温过程中在组织外形成冰晶以使细胞脱水,从而降低细胞内结晶的几率。郭莹莹[15]对常用的睾丸组织慢速冷冻方法进行改进,提出了改进的两步法冷冻方案,减小了保护剂加载时间,提高了慢速冷冻两个阶段的降温速率,且慢速冷冻最优组所需保护剂浓度较低(体积分数为10%的DMSO)。而玻璃化冻存是让高浓度保护剂中的细胞在降温速率较高的情况下胞内形成玻璃态,理论上避免了胞内冰晶的形成以减小对细胞的冰晶损伤。但高体积分数保护剂造成的较大毒性损伤限制了组织浸泡时间,且组织对保护剂的渗透能力低于单细胞,在有限的浸泡时间内组织内保护剂浓度难以达到玻璃化所需浓度,加上睾丸组织由于自身形成了较大热阻,在冷冻过程中降温速率难以提高至与单细胞相同的高降温速率,因此在实际降温过程难以实现完全玻璃化,在20%(体积分数)-1 min的DSC热分析中同样显示,降温过程中将出现组织内冰晶。因此,如果用并未实现完全玻璃化的结果和慢速冷冻结果进行对比,来评价玻璃化方法相比于慢速冷冻方法的优劣是不合适的,但我们可以认为,在目前的冷冻条件下,慢速冷冻更适用于块状睾丸组织冻存。
3 结论
本文对小鼠块状睾丸组织的玻璃化保存方法进行了研究,运用差示扫描量热仪,对在不同体积分数保护剂中浸泡了不同时间后的小鼠块状睾丸组织进行热分析,随后对其进行玻璃化冻存,并将睾丸组织慢速冷冻保存与玻璃化冻存进行了对比,得到如下结论:
1)低体积分数保护剂组在降温过程中检测到了组织内冰晶形成,而高体积分数保护剂组在降温过程中实现了玻璃化冷冻,未有冰晶形成。
2)以生精细胞的凋亡阴性率为依据,筛选出体积分数为20%DMSO保护剂溶液中浸泡1 min后进行玻璃化冻存为最优玻璃化加载方案,其冻后各生殖细胞凋亡阴性率分别为精原细胞78.6%,精母细胞90%,精子细胞70.1%,支持细胞89.1%。
3)与玻璃化冻存相比,慢速冷冻保存更能维持睾丸组织的冻后形态学完整性,并减小冻后生精细胞的凋亡率,是更适用块状睾丸组织冷冻的方法。
本文受上海市促进市级医院临床技能与临床创新能力三年行动计划重大临床研究项目(SHDC2020CR3077B)资助。(The project was supported by Clinical Research Plan of Shanghai Hospital Development Center(No.SHDC2020CR3077B).)
