纳米药物在胰腺癌治疗上的进展
2022-04-07王智弘花苏榕廖泉
王智弘,花苏榕,廖泉
(中国医学科学院北京协和医院基本外科,北京100730)
胰腺癌是一种高度恶性的疾病,在全球癌症病死率中排名第七[1-2],然而常规的化疗药物如吉西他滨不仅因肿瘤的耐药性而疗效不佳,还伴随严重的不良反应[3],靶向药物也面临同样困境。近年来,对于胰腺癌的肿瘤微环境(tumor Microenvironment,TME)研究发现胰腺癌周围累积了大量的星状胰腺细胞(pancreatic stellate cells,PSCs)以及癌症相关成纤维细胞(cancer associated fibroblasts,CAFs)[4]。它们分泌大量的纤维蛋白、胶原蛋白等基质,压缩肿瘤体积,并压迫肿瘤内部淋巴管、血管,迫使其关闭,进而出现缺氧、低灌注的现象,而缺氧、低灌注又进一步促进了TME中基质的分泌,形成恶性循环[5]。这种特殊的TME使得在血液中药物输送向胰腺癌细胞时受到严重阻碍,导致胰腺癌出现非常强的耐药性。因此,有效突破胰腺癌的TME,向胰腺癌细胞有效输送药物是目前的热点研究方向。
纳米药物是将药物包装在直径为10~200 nm内的纳米颗粒中,利用高渗透长滞留效应(enhanced permeability and retention effect,EPR)在癌细胞的TME中有效累积,并通过pH响应或热响应等方式精准释放载体药物分子[6],是一个很有前景的解决方案。目前,对于纳米药物治疗癌症的研究越来越多,但在胰腺癌治疗中的应用报道较少。本文回顾了纳米药物解决胰腺癌耐药的机制,总结了纳米药物在胰腺癌治疗上近期的进展。
1 胰腺癌的肿瘤微环境特点
胰腺癌的TME包括星状胰腺细胞、癌症相关成纤维细胞、免疫系统细胞、内皮细胞、周细胞等[3,5],最大的特点在于它的基质纤维化程度非常高,可以占到85%~90%。它存在丰富的纤维增生,并营造了一个缺氧的基质环境。这是因为胰腺癌在进展时所释放的炎症因子会促使基质中累积大量的PSCs,并诱导CAFs的形成[7],而这些细胞将分泌出大量的纤维蛋白、蛋白聚糖等,形成高度纤维化的基质环境[8]。这些基质压缩肿瘤组织,促使肿瘤内部的淋巴管和血管关闭,血管开窗不良,且诱导胰腺癌细胞周围覆盖上一层致密的周细胞[9],这使得氧气及传统的化疗药物难以通过血液系统进入TME。缺氧的微环境被证实将进一步诱导缺氧诱导因子的产生,进而诱导CAFs产生及纤维分泌,形成恶性循环。此外,致密的基质以及血管渗漏使得间质液的压力急剧升高[10],变得与毛细血管压力相当,从而阻碍了传统化疗药物通过压力梯度进入肿瘤,进一步增加了药物输送的难度。
PSCs及CAFs被认为是塑造胰腺癌TME的关键细胞。PSCs在正常组织中仅扮演储存脂质和维生素A的作用,但一旦被胰腺癌细胞激活,PSCs将分泌IL-1、IL-6以及TGF-β,激活PI3K、Wnt等信号途径[11-12],并转化为CAFs。它可以诱导细胞外基质的异常合成,上调细胞因子如Gal1[13]及Periostin[14]的表达,并可以激活胰腺癌细胞的EGFR/ERK通路,使胰腺导管腺癌获得恶性表征[12,15]。这都提示了CAFs可以作为药物的一个重要的靶点。有趣的是,常规化疗即可损伤CAFs,从而在初始剂量时抑制肿瘤的发生。然而,CAFs的损伤反而会导致癌症生长因子(如WNT16B等)以旁分泌的形式增加[16],并导致周围的血管通透性也增加,从而促进癌细胞在全身的传播和转移。这种现象已经在动物实验[17]及临床试验[18]中得到了证实。因此,对于较厚的TME基质,不能急于将其破坏,实验表明慢性破坏基质可提高总生存率和化疗药物的治疗潜力[19]。总而言之,在以PSCs及CAFs为靶向时,应尽量减少对基质的破坏,以防止胰腺导管腺癌出现转移及耐药性的提升。
2 纳米药物可突破TME递送到靶细胞
TME不仅阻挡了传统化疗药物递送到靶细胞,同时也减少了肿瘤抗原的暴露,因而导致靶向药物的疗效不佳。纳米技术是使用特定材料形成纳米级结构,可以增加药物的比表面积、效率和反应性,并提高药物的生物利用度[20],因此纳米药物可以穿透TME,并靶向癌细胞。根据其组成可分为有机纳米药物和无机纳米药物,包括脂质体、聚乙醇聚合物、白蛋白、金、银纳米药物等[21]。纳米药物的直径普遍在10~200 nm左右[22],过小则容易穿过正常组织的紧密连接间隙(<10 nm)[23],过大则不易透过肿瘤微环境内的间隙[24]。EPR效应是由于胰腺癌淋巴液引流不畅,适宜大小的纳米药物可以通过小血管相对不紧密的细胞间隙进入肿瘤,在肿瘤中停留数天的时间,并被动富集至一个相对高的浓度的现象,目前被认为是纳米药物靶向肿瘤的主要效应[25]。不过一些观点认为EPR效应在实体癌中也许并非起主导效应[26],原因与肿瘤的血管内皮内衬、血小板以及周细胞可以阻止药物扩散有关[27-28]。但纳米药物还能耦联配体,通过配体加强与靶细胞的交互,如抗体-金纳米药物[29]、PSGL-1[30]等进一步增加靶细胞的亲和性。此外,重塑血管网络[31]、利用药物降低细胞外基质的密度[32]、搭载维生素D[33]等策略也被提出以重塑TME,辅助纳米药物更顺畅地通过肿瘤微环境,但目前此类研究均仅限于探索性实验阶段。
尽管纳米药物可以有效地靶向癌细胞,然而有研究估计使用传统的纳米药物进行药物递送时仅有0.7%的药物可以成功递送到靶细胞内[34]。为了减少脱靶,增加进入癌细胞的概率,人们提出了pH响应、热响应或射线响应等策略增加纳米药物递送入细胞的概率[35-41]。由于纳米药物主要通过胞吞作用进入细胞内,在血液及早期内体环境中pH为中性环境(pH=7.4),但在溶酶体融合后形成的晚期内体环境中,pH会骤然降至6.4~6.5。pH响应的策略正利用了这一点,研究者[35-37]设计了在中性环境中保持稳定的有机聚合物,在感应到酸性环境后外表即崩解,破坏晚期内体的细胞膜,避免药物被晚期内体所降解,从而大大增加药物释放的效率,这项技术已被广泛应用于各种临床纳米前药物。热响应、射线或磁响应等策略则是利用一些在正常人体环境下保持稳定而在特定条件下(如高温、射线、磁场等)会被激活的物质如热敏感脂质体[38]、磁场敏感的超顺磁性氧化铁纳米粒子[39],以及受到特定光线后激活的物质如LiYF:Ce3+[40]等,这些仅在特殊条件下被激活的药物,可有效避免其他组织的毒性,减少脱靶作用。此外,Cai等[41]尝试将巨噬细胞的细胞膜包裹在纳米药物外侧,成功减少了网状内皮细胞对纳米药物的吞噬作用。总之,目前研究结果表明可以通过多种策略成功将纳米药物送至靶细胞内。
3 纳米药物在胰腺癌治疗中的研究进展
纳米药物已成功应用于其他癌症治疗中。早在2005年,纳米白蛋白-紫杉醇(AbraxaneTM)就已获得美国食品及药物管理局(Food and Drug Administration,FDA)批准上市应用于治疗乳腺癌,并随后在该领域得到大量的应用。多柔比星-脂质体(Doxil®)则在次年获得FDA批准上市治疗卵巢癌及乳腺癌。目前,包括白血病、卡波西肉瘤、前列腺癌等目前都已有相应的纳米药物可进行治疗。近年来,纳米药物应用于胰腺癌上的研究同样进展迅速。目前纳米药物靶向胰腺癌的治疗策略有许多,目前正在进行临床试验的纳米药物及其研究概况,主要包括以下几种。
3.1 铁死亡诱导型纳米药物
铁死亡即过量的铁离子被细胞摄入后游离于细胞质内,这些铁离子与过氧化物发生芬顿反应,积累活性氧,并形成过氧化脂质,破坏细胞膜的稳定性,且诱导细胞发生程序性死亡。这一现象由Dixon等[42]首次报道,随后在多种肿瘤中被发现如胰腺癌[43]、肝癌[44]、肺癌[45]、乳腺癌[46]等。研究表明铁死亡的机制主要涉及3条途径,包括:⑴细胞内铁的代谢,包括铁的摄入如TfR1[47]、输出如SLC40A1[48]及铁稳态的异常,导致铁代谢异常,自由基生成增加;⑵自由基清除系统包括谷胱甘肽过氧化物酶(GPX4)[49-50]及Xc-[51]系统等的异常,其中Xc-系统负责转运半胱氨酸生成谷胱甘肽(glutathione,GSH),GPX4则使用GSH还原活性氧自由基(Reactive Oxygen Species,ROS),阻止ROS的产生;⑶ACSL4[52]等蛋白增多将导致过氧化脂质产生的底物增加,导致过氧化脂质的生成增多。在铁死亡中,p53[53]及核因子erythroid-2(NRF-2)[54]都发挥了重要的效应。然而,单独递送铁离子并无法诱发癌细胞铁死亡,这是因为癌细胞会大量生成GSH以对付活性氧的产生[55]。因此,目前铁离子常与GSH抑制剂共递送,如GPX4抑制剂RSL3[56]及GSH转运系统Xc-系统抑制剂erastin[42],它们都能抑制GSH的产生,从而诱导铁死亡的产生。关于胰腺癌的临床前研究中,erastin类似物[57]及GPX4抑制剂(热休克蛋白家族A成员5,HSPA-5)[58]均被证实可以触发胰腺癌的铁死亡,但它们均需通过形成纳米药物的形式才能稳定地靶向胰腺癌细胞。此外,青蒿琥酯[59]、Ruscogenin[43]可以通过影响转铁蛋白的水平来诱导胰腺癌中的铁死亡,随着铁死亡机制的深入研究,铁死亡纳米药物将逐渐成为未来胰腺癌治疗中一个很有前景的策略。
3.2 搭载/联合传统药物
结合传统化疗药物如紫杉醇是纳米药物中较为成熟的治疗策略。理论上,形成纳米药物后,因脱靶造成的全身副作用将明显减少,载药剂量也可减低,相对更安全。目前,大部分的纳米药物已开展相关的临床试验(表1)[60-73]。最早开始研究的纳米药物是搭载紫杉醇的白蛋白纳米药物,目前已展开至III期临床研究[69],该研究纳入了861例转移性胰腺癌患者,对比了吉西他滨加纳米药物与吉西他滨单药治疗的安全性和有效性,发现白蛋白纳米药物能提高患者的总生存率,但增加了骨髓移植及周围神经病变的不良反应比例。搭载5-氟尿嘧啶及叶酸的伊立替康脂质体纳米药物在转移性胰腺癌患者中展开了III期试验[67],相对于吉西他滨单药治疗使用纳米药物治疗使患者的1年生存期从16%增长到了26%(n=417),且未观测到显著的不良反应增加,目前该伊立替康脂质体已在2020年在日本成功上市(Onivyde®)用于治疗IV期转移性胰腺癌。总体而言,目前研究显示大部分纳米药物均未表现出同传统化疗类似的严重不良反应,并且有效延长了患者的生存期,但药物相关的长期不良反应尚待观察。
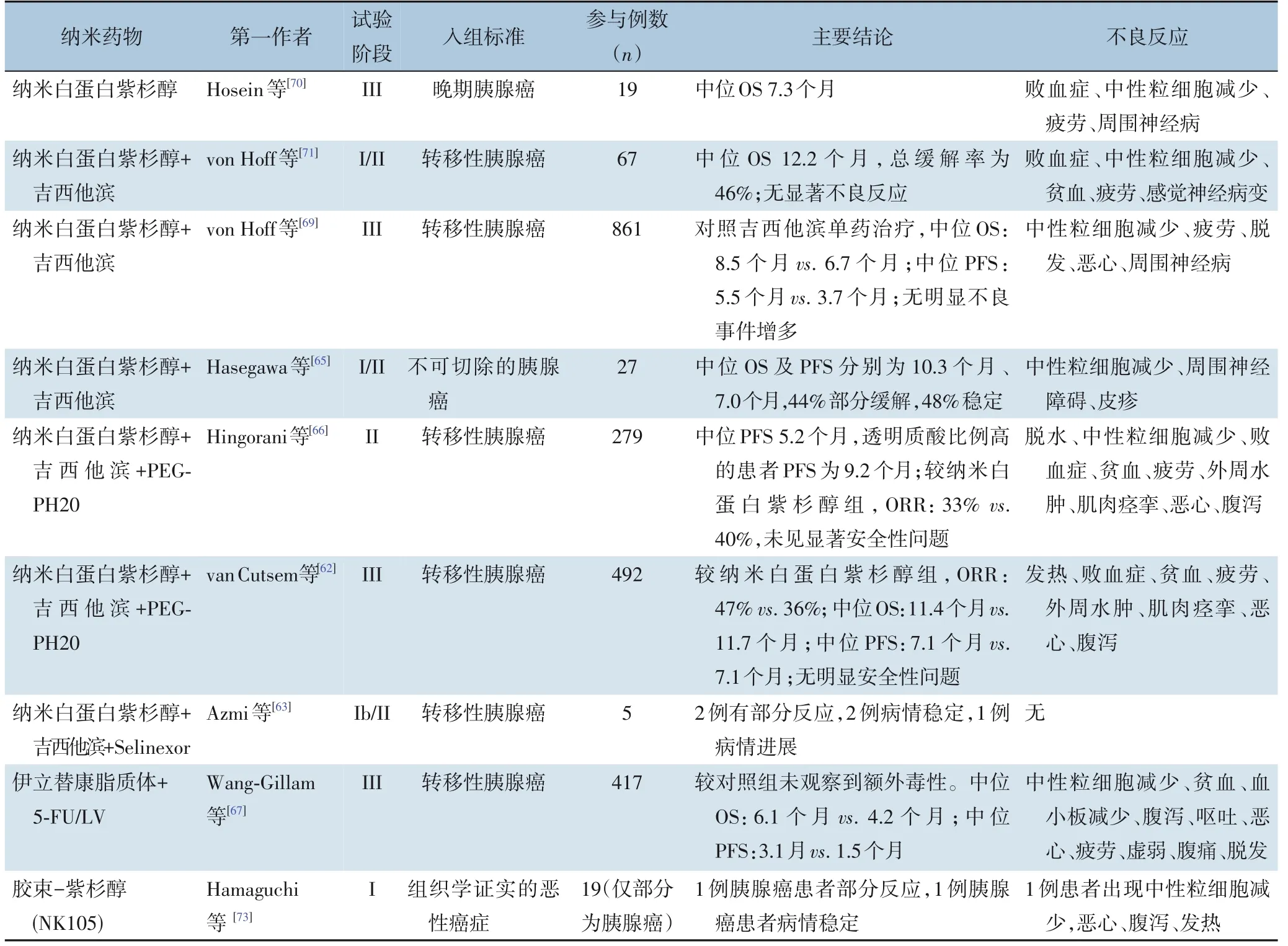
表1 纳米药物相关的胰腺癌临床试验总结Table 1 Summary of clinical trialsabout nanomedicinesin pancreatic caner
3.3 搭载小干扰核糖核酸
小干扰核糖核酸(small interfering RNA,siRNA)的优势在于siRNA能靶向任意的目标基因/蛋白,拓宽治疗的可能性。然而,如何运输siRNA一直是一个挑战。纳米药物能有效保护裸露的siRNA不被循环系统降解,还能帮助分子量大、负电荷多的siRNA进入靶细胞[74],在被细胞内体降解前逃逸出细胞[75],从而有效发挥基因沉默功能。2019年,包载有siRNA的脂质体LNP(ONPATTRO®)[76]已被FDA批准上市治疗遗传性转甲状腺素蛋白淀粉样变性,但癌症相关的siRNA临床试验目前表现尚不理想。在临床前实验中,胰腺癌相关的siRNA研究所针对的蛋白多种多样,包括HER-2[77]、K-ras[78]等常规的原癌基因,也包括如VEGF[79]、HIF-1α[80]、RRM2[81]、PLK-1[82]、EPAS1[83]等针对TME的位点。Zhao等[80]最先尝试在原位胰腺癌小鼠模型试验siRNA治疗,将靶向HIF-1α的siRNA及吉西他滨搭载到阳离子疏水性聚合物及脂质体中,结果显示,全身给药有效减少了HIF-1α的表达并缩小了小鼠胰腺癌肿瘤的体积。此外,结合其他治疗策略的siRNA颗粒也被开发出来,如Yin等[78]报道了结合光激活策略的纳米药物治疗小鼠中胰腺癌肿瘤的案例。纳米药物中包含K-ras siRNA和多柔比星,在注射到肿瘤汇总后,接受655 nm的红外光刺激时,药物将被统一释放出来,从而杀伤癌细胞。
3.4 光动力药物纳米载体
光动力治疗是新兴的胰腺癌治疗策略,用于治疗不可切除的局部胰腺癌。它通过给胰腺癌肿瘤瘤体输注光敏剂,随后利用光纤对靶区进行照射,光敏剂产生充足的单线态氧和其他形式的活性氧破坏癌细胞,从而最大限度减少了对其他组织的损害。然而,光动力治疗在胰腺癌治疗中面临诸多问题,如光敏剂递送不足、聚集诱导猝灭效应以及肿瘤环境缺氧等限制,因此疗效不佳[84]。纳米药物可以稳定疏水的光敏剂,使它们不再互相聚集并发生自猝灭[85-86],同时增加了靶向癌细胞的能力,从而减少副作用如消化道出血的发生[87]。纳米药物在光动力治疗中最重要的应用在于建立一个富氧环境,改善TME中缺氧的条件,从而最大化光敏剂的杀伤作用。主要策略有两种,一是使纳米药物直接携带吸氧材料,例如Cheng等[88]使用氟化碳携带O2进入TME;二是通过如Fe-多金属盐[89]、等催化TME中丰富的H2O2分解为O2。此外,由于纳米药物可以同时搭载多种治疗剂,因此在光动力治疗上结合声动力治疗[91]、光热治疗[92]也成了近年来的焦点。
3.5 其他
许多新的植物源药物,例如姜黄素[93]、阿魏酸[94]、小檗提取物[95]、雷公藤内酯[96]、类黄酮[97]等被开发应用于纳米药物,这些药物在实验室中被发现有很强的抗癌活性,但却因水溶性差而不能稳定存在于血液中,形成纳米药物后则能稳定存在。目前有关姜黄素的研究开展较多,姜黄素通过阻断NF-κB途径,上调Bax促进细胞凋亡,抑制SHH和CXCL12通路,减少TME与肿瘤细胞间的相互作用[93],结合了姜黄素的纳米药物在Mia PaCa-2细胞中被有效内化,并在动物模型中被证实可以减小胰腺癌的体积,延长小鼠的存活时间[98]。因此,姜黄素被认为是最有希望的新型抗癌药物之一。
免疫治疗方面,阻断PD-1/PD-L1通路激活T细胞是一种常见的策略,如搭载抑制剂HAS-BMS[38]、JQ-1[99]、抑制吲哚2,3双加氧酶(IDO)[100]等都被证实对胰腺癌细胞或肿瘤有一定的作用。Ray等[37]使用ERK抑制剂促进吉西他滨杀伤胰腺癌,在动物体内取得了疗效。Lorkowski等[101]使用纳米药物同时搭载TLR4抑制剂及STING激动剂,不仅增加TGF-β的分泌,激活树突状细胞的抗原提取能力,还增加了INF-β的分泌,从而进一步募集抗原呈递细胞以激活机体的免疫功能。
此外,Shim等[102]提出使用产气荚膜梭菌肠毒素破坏胰腺癌细胞的紧密连接的策略,在原位肿瘤模型中证实了该策略能缩小胰腺癌的体积。Liu等[103]则另辟蹊径,使用纳米药物搭载MUC4β制作了胰腺癌疫苗,并在小鼠中验证了其免疫原性,但未验证其能否诱导肿瘤杀伤效果。Borchardt等[104]探索了纳米药物结合miRNA替代疗法在胰腺癌细胞中的可行性,证实了miR24-3p在胰腺癌细胞内的通路,诱导了细胞的死亡。
4 纳米药物临床转化的困难
尽管上述研究结果可以表明纳米药物可能成为未来治疗胰腺癌的潜在手段,但在临床转化的过程中却遭遇到了不少困难,最大的问题在于纳米药物的监管问题。由于在构建纳米药物时选择的不同的载体类型、粒径、表面电荷分布、表面化学反应等理化性质差异,致使纳米药物间的理化性质异质性非常大,这使得纳米药物在生产方式的标准化及质量控制、安全性及毒性评价上难以得到统一的评价标准,导致纳米药物的监管及评价的困难。在纳米药物研究蓬勃发展的今天,各国政府已认识到加快制订纳米药物统一监管要求的紧迫性,如我国已于去年出台了纳米药物质量监控、非临床安全评价及非临床药代动力学的指导原则(试行)[105],进一步规范行业的发展。其次,无论是使用何种动物模型(如基因工程小鼠或种植患者来源癌细胞的免疫抑制小鼠),最终与真正人体环境均存在差异,故临床研究中与临床前研究中纳米药物的药代动力学、毒理学及疗效可能会出现不可预期的差异,减缓了纳米药物临床研究进展的步伐。另外,许多纳米药物的制备工艺复杂,难以大规模量产。总之,纳米药物的临床应用尚不成熟,统一纳米药物的监管、评价要求将极大促进纳米药物的临床开发与应用。
5 结论与展望
纳米药物可以通过EPR效应、搭载配体等多种途径突破胰腺癌的TME,并利用pH响应等方法有效进入胰腺癌细胞,攻克胰腺癌耐药的难题。铁死亡、搭配传统化疗药物以及siRNA等治疗策略已开始临床前试验或临床试验,取得了良好的结果。但在进行纳米药物临床转化过程中还面临挑战和困难,还需进一步加强监管、验证其应用效果。
利益冲突:所有作者均声明不存在利益冲突。
