叶绿素荧光成像技术的葡萄霜霉病早期检测
2022-04-06姚志凤苏宝峰宋怀波何东健胡静波
张 昭, 姚志凤, 王 鹏, 苏宝峰, 刘 斌,宋怀波, 何东健*, 徐 炎, 胡静波
1. 西北农林科技大学机械与电子工程学院,陕西 杨凌 712100 2. 宝鸡文理学院电子电气工程学院,陕西 宝鸡 721016 3. 农业农村部农业物联网重点实验室,陕西 杨凌 712100 4. 陕西省农业信息感知与智能服务重点实验室,陕西 杨凌 712100 5. 西北农林科技大学信息工程学院,陕西 杨凌 712100 6. 西北农林科技大学园艺学院,陕西 杨凌 712100 7. 旱区作物逆境生物学国家重点实验室,陕西 杨凌 712100
引 言
葡萄霜霉病是葡萄霜霉菌(plasmopara viticola, PV)引起的真菌病害,该病侵染能力强,扩展速度快,尽早防治是关键。 若能在潜伏期实现霜霉病侵染的早期检测,就能及早制定防治方案,阻断霜霉病的蔓延和流行,保证葡萄的品质和产量。 然而在没有病症的霜霉病潜伏期,田间观察无法判断霜霉病侵染,近年来兴起的聚合酶链反应(polymerase chain reaction,PCR)技术可通过DNA定量扩增技术准确确定病原菌,并通过检测病原菌相对生物量判断侵染程度,但PCR技术制备样本耗时费力,必须在实验室完成,无法在田间实现霜霉病症前快速无损检测。 作为一种无损检测的新技术,脉冲调制叶绿素荧光(pulse amplitude-modulated chlorophyll fluorescence,PAM-ChlF)成像技术在植物病害早期检测方面应用广泛[1-2]。 Cen等[3]用PAM-ChlF成像技术揭示了柑橘黄龙病的光合指纹,综合荧光图像和参数特征的SVM模型对健康、黄龙病侵染和营养缺乏叶片检测准确率为97.00%。 Tung等[4]利用PAM-ChlF成像技术对接种炭疽病菌的本氏烟叶片侵染程度进行了量化分析,发现在接种96 h用Fv/Fm图像量化的病变面积与显症后的病斑数量存在显著的线性关系。 上述研究表明,PAM-ChlF成像技术能够对多种植物病害进行有效检测,但现有研究多用单一参数和图像进行分析,缺乏从霜霉病侵入到显症连续多天的叶绿素荧光数据,尚未建立综合各个叶绿素荧光参数,能准确进行霜霉病早期检测的方法和模型。
为了提供一种葡萄霜霉病症前早期检测的方法和技术,采用PAM-ChlF成像技术,从暗适应—光适应—暗弛豫3个光合生理状态连续变化过程中,研究霜霉病侵染对叶片光合作用的影响,分析接种和健康叶片正面的叶绿素荧光动力学曲线和图像特征,考察从接种到显症连续6 d叶绿素荧光参数的动态变化规律,寻找对霜霉病侵染敏感的叶绿素荧光参数,探索有效识别健康与侵染霜霉病叶片的模型与方法,以期为葡萄霜霉病病光合表型分析和早期检测提供一种快速、准确的手段。
1 实验部分
以葡萄叶片为研究对象进行叶绿素荧光成像技术检测霜霉病实验。 实验分为供试叶片的制备、叶绿素荧光成像和PCR检测、数据分析与建模3个阶段(图1)。 首先制备供试叶片,将休眠期葡萄幼苗移植于花盆中,并在温室中培养,待霜霉病在田间发病后,进行霜霉菌离体接种和培养实验;之后连续6 d每天进行叶片正面叶绿素荧光图像采集和霜霉病PCR检测;最后对获取的接种和健康叶片数据进行叶绿素荧光动力学曲线、图像和参数变化分析,应用特征选择算法筛选出叶绿素荧光参数最优特征子集,输入分类器建立霜霉病早期检测模型并验证模型的识别效果。

图1 实验流程图Fig.1 Flow chart of the experiment
1.1 供试叶片的制备
2020年1月,将全球种植面积最大的葡萄品种 “赤霞珠”一年生幼苗移植于花盆中,在温室中培养。 7月摘取新发枝条6~8节上完全展开的健康叶片,清洗消毒后置于用滤纸保湿的培养皿中;按照霜霉病离体接种方法,接种前一天将田间发病的霜霉病叶片采下带回实验室清洗后保湿24 h,用洁净毛笔刷下叶片背面重新长出的新鲜霉层于无菌水中,离心富集后,使用血球计数板计数,配制成105个孢子囊·mL-1的孢子囊悬浮液;将配制好的孢子悬浮液均匀喷施于需要接种的健康叶片背面,相同数量的健康叶片喷等量无菌水作为对照。 将盛有叶片的培养皿封口后放入温度18℃、相对湿度84%、照度为12 000 lux的光照培养箱(RXZ型,宁波江南仪器厂)中,进行16 h光照、8 h黑暗光照控制培养。
接种后叶片发病情况如图2所示,健康叶片在实验周期内保持鲜绿[图2(a)]。 1~5 DPI叶片上无任何症状,直到6 DPI接种叶片背面均出现不同程度的白色霜霉层,部分叶片背面区域有病症[图2(b)],部分叶片背面布满了霜霉层[图2(c)]。

图2 接种后第6天的健康叶片和接种叶片(a): 健康叶片;(b): 区域发病;(c): 全叶片发病Fig.2 Healthy leaves and inoculated leaveswith disease spots at 6 DPI(a): Heathy leaf;(b): Leaf with scattered lesions; (c): Leaf covered with lesions
1.2 叶绿素荧光图像采集和PCR检测
1.2.1 叶绿素荧光图像采集
叶绿素荧光数据采集从接种后第1天(1 DPI)开始,用图3所示FluorCam FC 800开放式荧光成像系统,连续6 d每天获取葡萄叶片的叶绿素荧光参数图像和动力学曲线。 FluorCam FC 800系统主要由CCD相机(分辨率696 px×520 px)、镜头(SV-0614H,VS Technology)、4个LED 光源板(2个红色(620 nm)和2个蓝色(450 nm)LED面板,对称布置,分别与载物台成45°)、控制器、计算机、载物台和软件系统(Fluocam7.0)等组成,成像面积为20 cm×20 cm。 为消除外部光线干扰,成像背景用黑布遮盖。

图3 叶绿素荧光成像系统Fig.3 Chlorophyll fluorescence imaging system
叶绿素荧光成像系统的光源包括测量光、光化光和饱和光(图4)。 测量光是为测量叶片荧光强度而经过频率调制的光脉冲,本研究采用波长620 nm,强度0.02 μEinsteins·m-2·s-1,脉冲宽度10 μs橙红色光脉冲为测量光,系统获取与测量光同频的荧光。 光化光是叶片进行光化学反应的光源,选用波长620 nm,强度206 μEinsteins·m-2·s-1的稳定光源作为光化光,持续照射70 s。 饱和光使用波长450 nm,脉宽800 ms,强度为2 806 μEinsteins·m-2·s-1的蓝色光脉,暂时抑制叶片光合作用,使叶绿素荧光强度达到最大。
测量程序控制激发光源照射叶片产生叶绿素荧光,在叶绿素荧光强度动态变化的不同时刻,利用高灵敏度的CCD快速进行图像采集。 图像采集前,首先对叶片进行20 min暗适应,以使光合器官回到初始状态。 采集时,调节升降台使镜头和叶片间的距离保持在22 cm,用吸水纸吸去叶片表面水分,依次将健康和接种叶片放在载物台上,每次3个叶片同时采集[图2(c)]。 叶绿素荧光图像采集耗时192 s,包括暗适应(约0~22 s)、光适应(23~92 s)和暗驰豫(93~192 s)三个连续的光合生理状态(图4)。

图4 叶绿素荧光测量步骤Fig.4 Chlorophyll fluorescence measurement procedure
每天采集叶绿素荧光数据,观察并用手机拍摄记录叶片发病状况,之后将叶片放回培养皿,喷无菌水保湿,封口胶缠绕后继续培养,直到6 DPI叶片背面出现霜霉层。
1.2.2 葡萄霜霉病PCR检测
采用实时荧光定量PCR仪(LightCycler 96 System,Roche)测定叶片是否受到葡萄霜霉菌的侵染及侵染程度,研究参考Lei等[5]方法,以葡萄霜霉菌的相对生物量为指标进行实验。 分别在1~6 DPI每天对健康和接种叶片取样,液氮速冻后存放于-80 ℃超低温冰箱备用。 根据文献[6]设计引物如表1所示,由杨凌天润奥科生物科技有限公司合成。 用植物基因组DNA提取试剂盒(DP305,北京天根生化科技)提取样品的总DNA并将浓度调整至50 ng·mL-1,分别以葡萄霜霉菌PvActin及葡萄VvActin为内参基因进行实时荧光定量PCR,用2-△△CT法计算葡萄霜霉菌的相对生物量。
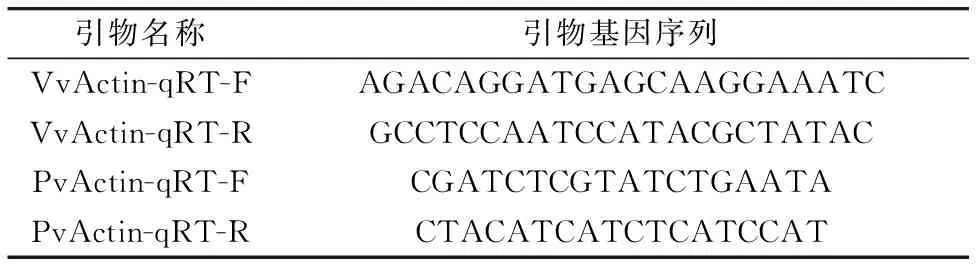
表1 实时荧光定量PCR引物Table 1 Real time fluorescent quantitative PCR primers
1.3 数据分析与建模
1.3.1 数据分析方法
实验共获取160个供试叶片(健康和接种各80个)连续6 d(1DPI~6DPI)的叶绿素荧光数据,包括叶绿素荧光动力学曲线、98个叶绿素荧光参数图像和参数值。 98个参数中有19个参数是叶绿素荧光成像系统直接采集获得的基础荧光参数,其余79个参数是2~5个基础荧光参数通过相应公式运算得到的,其中植物胁迫检测常用叶绿素荧光参数如表2所示。

表2 植物胁迫检测常用荧光参数Table 2 Fluorescence parameters commonly usedin detection of plant stress
首先通过PCR检测数据和霜霉病显症后的叶片RGB图像,对霜霉病的侵染程度和接种效果进行判断。 之后对比健康和接种叶片叶绿素荧光动力学曲线和图像,探明出现差异的时间和大小。 为揭示从接种到显症叶绿素荧光参数连续6 d的动态变化规律,对每个叶绿素荧光参数,分别计算健康和接种叶片在不同DPI的均值和方差,并通过单因素方差分析计算健康和接种叶片在各个荧光参数下的差异显著水平,探究各个荧光参数对霜霉病侵染的敏感性。
1.3.2 霜霉病早期检测模型的构建与验证
在数据分析的基础上建立霜霉病早期检测模型。 获取的98个叶绿素荧光参数,采用序列浮动前项选择(sequential floating forward selection,SFFS)算法[7]作为特征选择策略进行特征子集优选,并以Relief算法为对照,其中SFFS算法分为4个步骤(图5):
第1步: 输入全体特征数据,并初始化变量。
第2步: 添加特征h+。
第3步: 删除特征h-。
第4步: 输出。 重复进行添加和删除特征操作,当达到最大搜索次数(m=M)时,输出评估函数(Bayes)交叉验证平均准确率最高时的最优特征子集Zm*。
如图5所示,筛选出的最优特征子集分别输入逻辑回归(logic regression,LR)、线性判别分析(linear discriminant analysis, LDA)和BP神经网络分类器进行霜霉病检测机器学习模型的训练,10折交叉验证的平均准确率作为特征子集和分类器选择的依据。 将筛选的最优特征子集数据输入到训练后的霜霉病早期检测模型进行不同DPI的健康和接种叶片的识别,对模型识别效果进行验证。

图5 特征选择(SFFS)和模型构建流程图Fig.5 Flow chart of feature selection algorithm (SFFS) and model construction
以上数据分析、特征选取算法和模型的实现均在MATLAB R2017b 环境下完成。
2 结果与讨论
2.1 葡萄霜霉病PCR检测结果分析
为了对叶片内部霜霉病侵染状况进行评估,对接种后健康和接种叶片连续6 d的样本进行PCR检测。 如图6所示,健康叶片的霜霉菌相对生物量从1~6DPI始终为0,证明供试健康叶片未受到霜霉菌的侵染。 接种霜霉菌叶片其相对生物量1~3DPI缓慢增加,4~6DPI快速升高,1DPI为1.00,6DPI达到6.70,表明在肉眼不可见的潜育期霜霉病的侵染在持续加剧。 霜霉菌孢子接种到叶片表面,在水的作用下通过气孔侵入,并逐渐在叶肉组织内生长,侵染初期霜霉菌侵染产生的核酸物质累积较少,相对生物量增长缓慢(1~3DPI),随着霜霉菌在叶片内部扩展定殖,侵染程度不断加深,孢囊梗从气孔伸出,迅速繁殖,引起相对生物量急剧升高(4~6DPI)。 样本方差从1DPI的0.10增加到6DPI的0.87,表明不同叶片及叶片上不同位置的侵染程度差异大。

图6 健康和接种样本连续6 d PCR检测结果
2.2 叶绿素荧光动力学曲线对霜霉病侵染的响应分析
叶绿素荧光动力学曲线是在测量程序控制下叶绿素荧光强度随时间的变化,是直接测量获得的基础荧光数据,可以用来检测胁迫。 典型的健康和接种叶片叶绿素荧光动力学曲线如图7所示,绿色线表示健康叶片,红色线表示接种叶片。 1 DPI[图7(a)]健康和接种样本曲线基本重合,从2DPI开始在光适应阶段(23~92 s)接种叶片荧光强度高于健康叶片[图7(b)],6DPI差异继续变大[图7(c)]。 接种叶片健康和接种叶片光适应状态下叶绿素荧光强度的显著差异表明叶片光合作用因为霜霉病的侵染变化明显,接种叶片的荧光淬灭速率大于健康叶片。
2.3 叶绿素荧光图像对霜霉病侵染的响应分析
对比1DPI,2DPI和6DPI(显症当天)的叶正面叶绿素荧光图像和叶片背面的RGB图像,为方便观察,将叶正面叶绿素荧光图像以中间主叶脉为轴进行了左右镜像,如图8所示。 1~2DPI叶片RGB图像上没任何病症,1DPI叶绿素荧光参数图像均匀一致,2DPI该叶片叶绿素荧光参数图像空间异质明显,橙黄色高亮区域(Ft-L4图像)和深蓝色低暗区域(qN-L3和Rfd-L2图像)与6DPI 的RGB图像中病斑(白色霜霉层)的数量、位置、大小和形状高度一致,荧光参数图像中病斑位置颜色深浅与RGB图像中发病部位霜霉层的密集程度与十分匹配,表明叶片叶绿素荧光参数图像时空异质是霜霉病侵染引起的,qN-L3,Rfd-L2,Ft-L4对霜霉病早期侵染敏感,在接种后2 d(显症前4 d)能从叶片正面检测到霜霉病的侵染,比文献[8]用高光谱成像技术在显症前1~2 d发现光谱显著差异提前了2~3 d。 同样NPQ,Fm,Fv/Fm等参数图像也因霜霉病侵染体现出随时空变化的异质性。 但F0和Fp等参数图像接种前后没有显著变化,对霜霉病早期侵染不敏感。
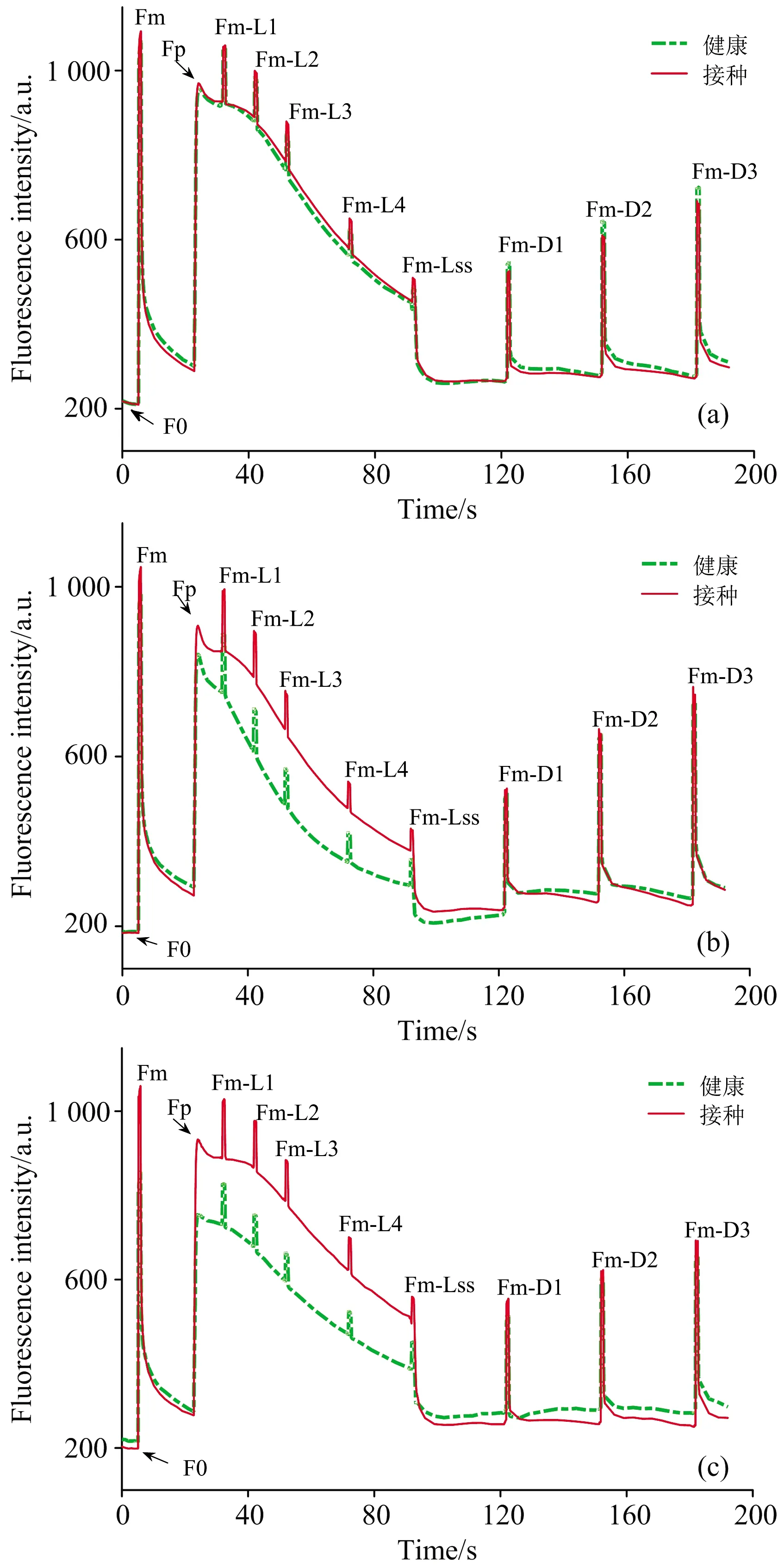
图7 健康和接种叶片的叶绿素荧光动力学曲线(a): 1 DPI;(b): 2 DPI;(c): 6 DPIFig.7 Representative kinetic chlorophyll fluorescencecurves of healthy and inoculated leaves(a): 1 DPI;(b): 2 DPI;(c): 6 DPI

图8 接种霜霉病叶片RGB图像和叶绿素荧光参数图像
2.4 叶绿素荧光参数对霜霉病侵染的响应分析
为了研究不同叶绿素荧光参数对霜霉病侵染的响应,在图像分析基础上,以叶片为感兴趣区域,计算各个荧光参数的均值和标准差,对比健康和接种叶片叶绿素荧光参数均值随DPI的变化,并对叶绿素荧光参数逐一进行单因素方差分析。 如图9所示,健康叶片叶绿素荧光参数随DPI变化较小,而接种叶片叶绿素荧光参数随DPI变化较大,其中qN,NPQ,Rfd,Fv/Fm等参数值随着DPI增加而逐渐下降,从2DPI开始显著低于健康叶片;Ft和Fm等参数值随着DPI增加不断升高,从2DPI开始显著高于健康叶片。 如图9(a)所示接种叶片qN-L3在2DPI较健康叶片显著下降(p<0.01),为(0.38±0.13),6DPI继续下降到(0.31±0.15),与健康叶片差距持续变大(p<0.001)。 与qN-L3变化趋势相反,接种叶片Ft-L4从1DPI的(400±67)持续增加到6DPI的(603±116),从2DPI开始显著高于健康叶片(p<0.01)[图9(b)]。Rfd-L2与qN-L3有着相同变化趋势[图9(c)],F0数值在整个实验周期波动很小,在1DPI~5DPI健康和接种叶片无显著差异[图9(d)],直到6DPI健康叶片F0数值显著高于接种配片(p<0.05)。

图9 接种和健康叶片连续6 d的叶绿素荧光参数变化 显著性: *p<0.05; **p<0.01; ***p<0.001
*p<0.05; **p<0.01; ***p<0.001
叶绿素荧光参数的上述变化是因为霜霉病菌的侵染阻碍了葡萄叶片光合器官功能的正常发挥,随着DPI增加,叶片光合作用减弱,光化学猝灭速率减小(Rfd变小),光合效率不断降低(Fv/Fm变小),叶片活力和光保护能力持续衰退(NPQ和qN变小),叶片吸收的光能更多以荧光的形式释放出来(Ft和Fm变大)。 不同荧光参数值随时间的变化从光能的吸收、传递、耗散和分配等不同方面反映了霜霉病对光合作用的影响,表明霜霉病侵染程度随DPI增加在不断加深。
2.5 霜霉病早期检测模型的建立与验证
上述分析表明,Fo和Fp等参数对霜霉病侵染不敏感,同时NPQ-L3,Rfd-L3和qN-L3(r>0.85,p<0.01)等参数对霜霉病检测的贡献相似,因此,分别用SFFS和Relief算法作为特征选择策略获取最优特征子集,并输入LR,LDA和BP神经网络分类器建立霜霉病早期检测模型。 数据集为160个葡萄叶片(80片接种,80片健康对照)连续6 d的98个叶绿素荧光参数值,分类器参数选择准确率最高的参数组合,使用交叉验证的分类器平均准确率进行模型评估。 其中BP网络为单隐层结构,采用L-M训练算法,传输函数输入层到隐层选用Tansig函数,隐层到输出层为Sigmoid函数。 结果如表3所示,SFFS最优特征子集在3种分类模型中的准确率均高于Relief特征子集,Relief算法虽然运行效率高,搜索速度快,但算法稳定性差,容易陷入局部最优。 SFFS算法稳定性好,多次运行最优特征子集均为qN-L3,Rfd-L2,NPQ-L1和Fv/Fm-D1,此4个特征属于表2中的胁迫检测常用叶绿素荧光参数,也是叶绿素荧光参数图像分析和参数方差分析中均对霜霉病侵染敏感的参数。 对比不同分类器的识别效果,BP分类器在SFFS、Relief最优特征子集的准确率分别为85.94%和81.40%,均高于LDA(83.57%,78.22%)和LR(80.95%,75.43%)。 在特征选择策略与分类器组合中,基于SFFS最优特征子集和BP神经网络分类器的SFFS-BP模型具有最高的识别准确率。

表3 基于SFFS和Relief叶绿素荧光最优特征子集的三个分类器识别结果
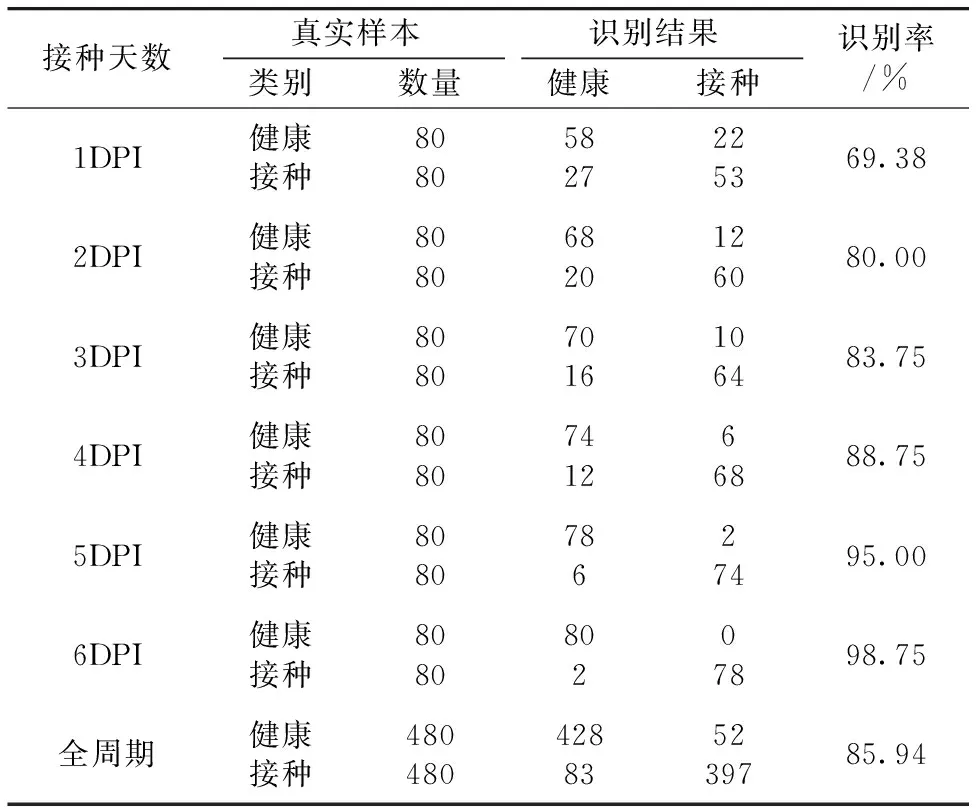
表4 基于SFFS-BP模型不同DPI健康和接种叶片识别结果
训练后的SFFS-BP模型对1~6DPI的健康和接种叶片进行识别,结果如表4所示。 随着接种天数增加,分类准确率逐渐升高,从1DPI的69.38%,增加到3DPI的83.75%,6DPI时达到98.75%,全实验周期连续6 d的准确率为85.94%,成功实现了霜霉病的早期检测。 本方法比文献[9]使用多光谱荧光技术从叶片背面检测葡萄霜霉病方法1DPI、3DPI和全实验周期的准确率分别提高了3.78%,3.30%和1.34%,而且采用叶绿素荧光成像技术从叶片正面检测霜霉病侵染比从叶片背面检测更方便实用。 通过识别结果可以看出,识别错误的样本中,将接种叶片误识别为健康样本的数量远大于将健康样本误识别为接种样本,这是由于在霜霉病培养过程中,叶片侵染程度不同,其中有的接种叶片发病轻微,叶绿素荧光参数图像和参数值与健康叶片没有显著差异,容易造成识别错误。
3 结 论
以接种和健康对照葡萄叶片为研究对象,以实现葡萄霜霉病早期检测为目标,PCR检测数据作为霜霉病侵染的依据,验证了PAM-ChlF成像技术进行霜霉病早期检测的可行性。 从暗适应到光适应再到暗豫驰3个光合生理状态连续变化过程中,得到健康和接种葡萄叶片连续6 d的98个荧光参数图像,通过数据分析和研究发现:
(1)PCR检测结果表明,接叶片侵染程度在不断加深,在2DPI,叶绿素荧光图像能从叶片正面检测到侵染,病斑区域出现时空异质,健康和接种叶片参数均值差异显著(p<0.05)。
(2)随着接种天数增加,霜霉病侵染导致接种叶片光化学淬灭速率减小(Rfd变小),光合效率降低(Fv/Fm变小),叶片活力和光保护能力衰退(NPQ和qN变小),叶片吸收的光能更多以荧光的形式释放出来(Ft和Fm变大)。
(3)基于特征选择算法(SFFS和Relief)和机器学习分类器(LR,LDA和BP)的叶绿素荧光参数早期检测模型成功实现了霜霉病的早期检测,其中基于SFFS算法优选的特征子集(qN-L3,Rfd-L2,NPQ-L1和Fv/Fm-D1)和BP神经网络分类器的SFFS-BP模型对3DPI健康和接种叶片识别准确率为83.75%,全实验周期连续6 d平均准确率达到85.94%。
