红甜菜多糖提取条件优化的研究
2022-04-06郭庆晖张琨霖司茜媛赵娇娇张静刘欢欢李贞景
郭庆晖,张琨霖,司茜媛,赵娇娇,张静,刘欢欢,3,李贞景,3
(1.天津市活力源饮料有限公司,天津 300000;2.天津科技大学食品科学与工程学院,天津 300457;3.省部共建食品营养与安全国家重点实验室,天津 300457)
0 引言
红甜菜是藜科甜菜属二年生草本植物,其叶片小,叶柄、叶脉和块根均为红色[1],俗称紫菜头[2]。大约在公元前5 世纪,甜菜由阿拉伯人通过丝绸之路从波斯传入中国,至今已种植2 500 多年。1986年红甜菜首次引入东北地区,目前在中国东北、华北及山东等地种植。
红甜菜营养丰富,其膳食纤维具有减肥、预防糖尿病、促进消化、降低胆固醇、预防心脑血管疾病等功能[3],甜菜多糖对肿瘤细胞均具有一定的体外抑制作用[4]。经常食用,可显著增加血红蛋白量,改善贫血,增强血液携氧能力,增加免疫力、预防骨质疏松和甲状腺肿[5-6]。红甜菜中还含有皂苷、甜菜碱和甜菜色素等一些功能性成分[7]。红甜菜中所含的大部分糖很容易被人体消化和吸收。其中,膳食纤维能促进胃肠蠕动,促进矿物质如锌和铁的吸收,帮助人体排泄废物和减少毒素在身体内积聚[8]。2003年,红甜菜被世界卫生组织评选为13 种最佳蔬菜之一[9]。红甜菜提取物在食品、医药和化妆品等行业用于抗菌作用[10]。多糖是天然高分子化合物,其由单糖聚合而成且广泛存在于植物、动物和微生物组织中[11]。其中,植物多糖是由许多相同或不同的具有α-或β-糖苷键的单糖组成的在天然植物界普遍存在的化合物。大多数植物多糖不溶于冷水,并且在热水中呈粘液形态,具有构成生命活动、维持生命功能的作用。甜菜多糖具有免疫调节、抗肿瘤、抗衰老、降血糖和抗凝血作用[12]。因此,对甜菜多糖的研究越来越引起人们的关注。
水提醇沉法是利用多糖易溶解于水,但是在高浓度乙醇中难以溶解的性质,把多糖提取出来的方法[13]。此方法广泛应用于植物多糖的提取分离。水提醇沉法一般分为冷水提取、热水提取、酸水提取和碱水提取4种方法。其中热水提取法以环保、低毒、操作简单、对设备参数要求不高等特点成为提取多糖的最常用方法[14]。目前,红甜菜在国内外广泛栽培,然而,对甜菜的应用主要以传统的食品加工业为主,尚未对其进行科技含量更高的开发利用,造成一定的资源浪费[15]。因此,研究红甜菜多糖的提取方法对于开发红甜菜资源具有重要意义。本试验对红甜菜多糖的提取工艺进行优化,以获得最优工艺条件,为红甜菜多糖的进一步研究提供理论支持。
1 材料与方法
1.1 供试品种与试剂
红甜菜品种为‘甜研红1号’,天津市活力源饮料有限公司提供。供试试剂:无水乙醇、苯酚、硫酸、磷酸(天津市江天化工技术有限公司);胰蛋白酶、木瓜蛋白酶、风味蛋白酶、复合蛋白酶、碱性蛋白酶、牛血清蛋白、葡萄糖、考马斯亮蓝G-250(北京索莱宝科技有限公司);试剂均为分析纯。
1.2 仪器与设备
BJ-800A 型多功能粉碎机,拜杰公司;PB-10 型pH 计,赛多利斯科学仪器(北京)有限公司;AX622ZH/E型电子天平,奥豪斯仪器(常州)有限公司;SQP型电子天平,赛多利斯科学仪器(北京)有限公司;FD-10型冷冻干燥机,北京德天佑科技发展有限公司;RE-2000A型旋转蒸发器,上海亚荣生化仪器厂;TDZ5-WS型低速多管架自动平衡离心机,长沙高新技术产业开发区湘仪离心机仪器有限公司。
1.3 试验方法
1.3.1 样品预处理
将切碎、烘干的红甜菜用多功能粉碎机粉碎后,过80目筛,筛下物装入自封袋,放入干燥器中备用。
1.3.2 单因素试验
(1)最佳料液比试验:称取20 g 甜菜根粉末,单因素试验每个处理组重复3次,分别按照料液比(g/mL)为1∶10、1∶20、1∶30、1∶40、1∶50,在温度为80 ℃,时间为1.5 h,不断搅拌的条件下进行热水提取,提取次数为3次,4 000 r/min离心20 min,合并滤液,测定多糖含量,计算提取率。
(2)最佳提取温度试验:称取20 g 甜菜根粉末,按照料液比(g/mL)为1∶30,分别在温度为20、40、60、80、100 ℃,时间为1.5 h,不断搅拌的条件下进行热水提取,提取次数为3 次,4 000 r/min 离心20 min,合并滤液,测定多糖含量,计算提取率。
(3)最佳提取时间试验:称取20 g 甜菜根粉末,按照料液比(g/mL)为1∶30,分别在时间为0.5、1.0、1.5、2.0、2.5 h,温度为80 ℃,不断搅拌的条件下进行热水提取,提取次数为3 次,4 000 r/min 离心20 min,合并滤液,测定多糖含量,计算提取率。
(4)最佳提取次数试验:称取20 g 甜菜根粉末,按照料液比(g/mL)为1∶30,在温度为80 ℃,时间为1.5 h,不断搅拌的条件下进行热水提取,分别提取1、2、3、4、5次,4 000 r/min离心20 min,合并滤液,测定多糖含量,计算提取率。
1.3.3 正交试验
依照参考文献[16],以上述单因素试验为基础,选择料液比(A)、提取温度(B)、提取时间(C)为试验考察因素,以红甜菜多糖提取率为评价指标,通过正交试验,每个处理组重复3次,探索红甜菜多糖提取的最优工艺条件。正交试验因素和水平如表1所示。

表1 正交试验因素和水平Table 1 Factors and levels of orthogonal experiment
1.3.4 最佳除蛋白方法的考察
取500 mg 粗多糖,加入15 mL 蒸馏水充分溶解,调节pH=7,分别加入1.5%胰蛋白酶、风味蛋白酶、木瓜蛋白酶、复合蛋白酶、碱性蛋白酶,酶解时间为3 h,酶解温度为50 ℃,反应结束后沸水浴10 min,冷却至室温,4 000 r/min离心20 min除去沉淀,测定上清液中蛋白含量和多糖含量,筛选出最佳除蛋白方法。
多糖含量的测定采用苯酚-硫酸法[17]。蛋白含量的测定采用考马斯亮蓝G-250比色法[18]。
1.4 数据分析
采用Microsoft Excel 2010进行数据的整理、分析和作图。
2 结果与分析
2.1 单因素试验的结果
2.1.1 料液比对红甜菜多糖提取率的影响
料液比是影响多糖提取率的一个重要因素[19]。如图1A 所示,随着料液比增加,多糖提取率也增加,当液料比增至1∶30(g/mL)时,多糖提取率达到最高值。继续加大料液比,多糖提取率反而出现下降。当料液比为1∶20、1∶30、1∶40时,多糖提取率无显著差异,分别比液料比1∶50的多糖提取率增加7.57、11.05、10.90个百分点,因此,选择料液比为1∶30(g/mL),较为适宜。
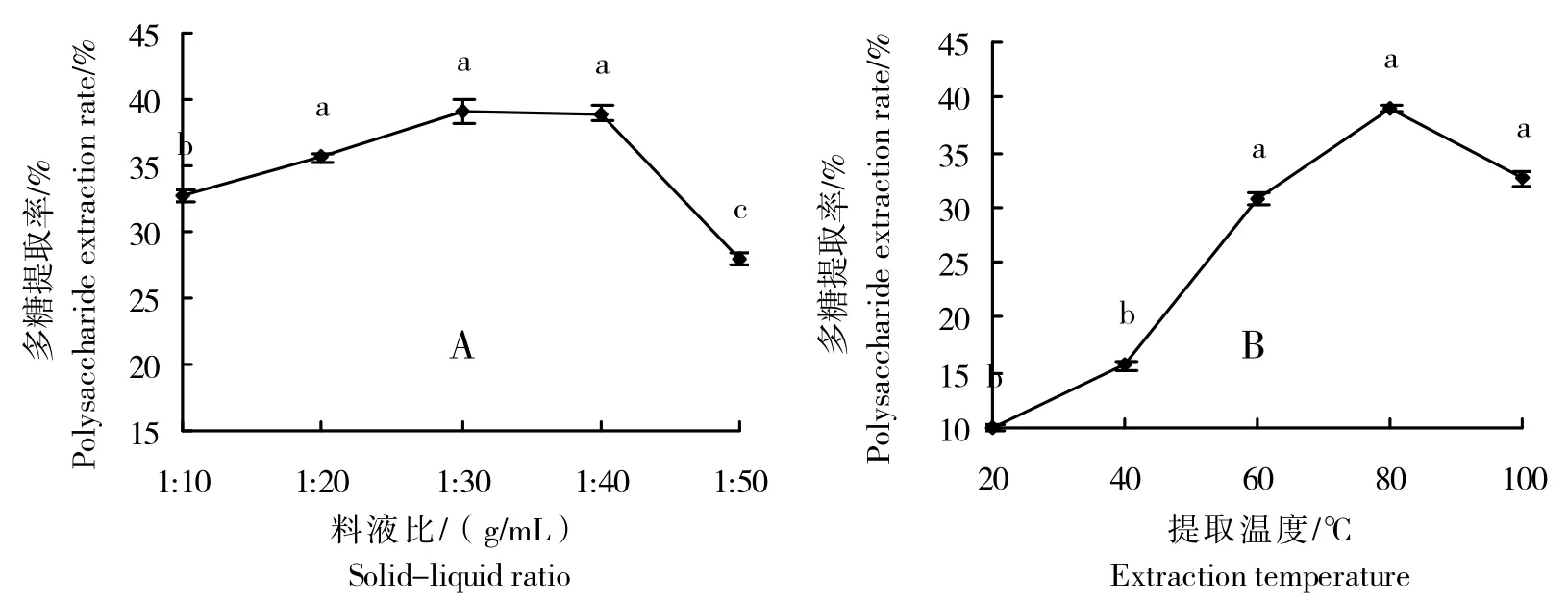
图1 料液比(A)和提取温度(B)对红甜菜多糖提取率的影响Fig.1 Effect of solid-liquid ratio(A)and extraction temperature(B)on extraction rate of polysaccharide from red beet
2.1.2 提取温度对红甜菜多糖提取率的影响
由图1B可知,红甜菜多糖提取率随着提取温度的升高而增加,当提取温度为80 ℃时,多糖提取率最大。当提取温度高于80 ℃时,多糖提取率开始出现降低。提取温度为40、60、80、100 ℃的多糖提取率分别比20 ℃时的多糖提取率增加5.68、20.76、29.06、22.55个百分点。当提取温度为60、80、100 ℃时,多糖提取率无显著差异。因此,选择提取温度为80℃,较为适宜。
2.1.3 提取时间对红甜菜多糖提取率的影响
由图2A 可知,红甜菜多糖提取率随提取时间的增长而增加,当提取时间为1.5 h 时,多糖提取率最大。提取时间多于1.5 h时多糖提取率呈下降趋势。提取时间为1.0、1.5、2.0、2.5 h时的多糖提取率分别比0.5 h时增加10.54、28.76、20.25、19.45 个百分点。当提取时间为1.5、2.0、2.5 h 时,多糖提取率无显著差异。因此,选择提取时间为1.5 h,较为适宜。
2.1.4 提取次数对红甜菜多糖提取率的影响
由图2B可知,随着提取次数的增加,红甜菜多糖提取率呈增加趋势。提取次数为2、3、4、5次时,多糖提取率分别比提取次数1 次时增加5.45、18.86、17.80、17.48 个百分点。当提取次数为3、4、5 次时,多糖提取率无显著差异。考虑经济因素,选择提取次数为3次,较为适宜。
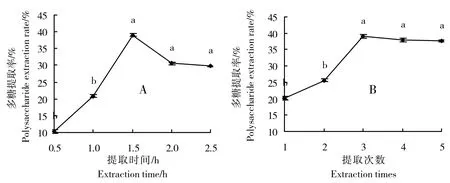
图2 提取时间(A)和提取次数(B)对红甜菜多糖提取率的影响Fig.2 Effect of extraction time(A)and extraction times(B)on extraction rate of polysaccharide from red beet
2.2 优化试验
2.2.1 正交试验
上述单因素试验确定了正交试验的因素和水平,以多糖提取率为指标,进行L9(33)正交试验。由极差分析结果可知(表2),影响多糖提取率的因素主次顺序为料液比(A)>提取时间(C)>提取温度(B),最优水平组合为A3B2C2,即料液比(g/mL)为1∶40,提取温度为80 ℃,提取时间为1.5 h。
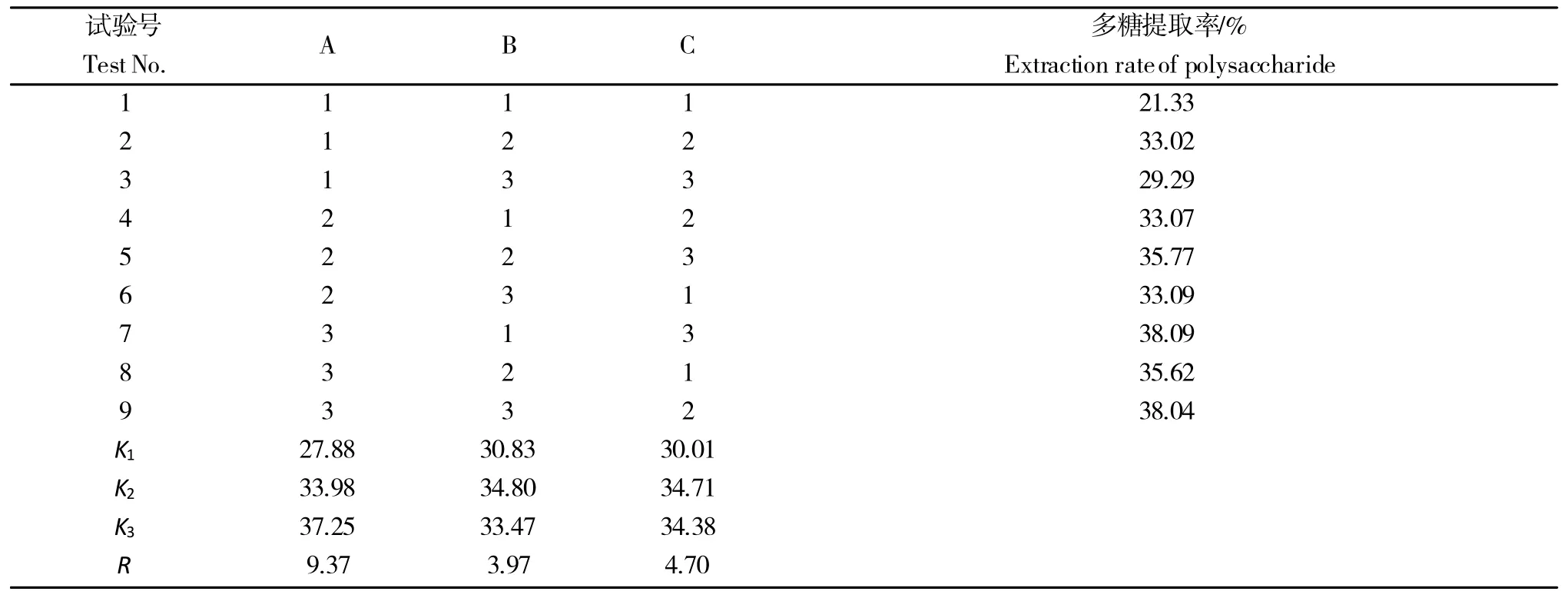
表2 正交试验极差结果Table 2 Range of orthogonal test results
2.2.2 验证试验
由于最优组合A3B2C2未出现在正交表中,因此与正交表中的最高得分组A3B1C3进行验证试验。验证试验结果A3B2C2的多糖提取率38.92%高于A3B1C3的多糖提取率38.09%,证明A3B2C2为最优组合。
2.3 除蛋白质方法的考察结果
如表3所示,在其他条件相同的情况下,分别加入不同的蛋白酶,其除蛋白效果不尽相同。其中,胰蛋白酶的蛋白脱除率较其他4种蛋白酶最高,且多糖的损失率最小。方差分析显示,胰蛋白酶的蛋白质脱除率与风味蛋白酶无显著性差异,与木瓜蛋白酶、碱性蛋白酶、复合蛋白酶有显著性差异;胰蛋白酶的多糖损失率与风味蛋白酶、复合蛋白酶无显著性差异,与木瓜蛋白酶、碱性蛋白酶有显著性差异。综合分析后得,采用胰蛋白酶解法除蛋白的效果最好,蛋白质洗脱率为42.32%,多糖损失率为0.63%,比复合蛋白酶蛋白质洗脱率增加20.42个百分点,比碱性蛋白酶多糖损失率降低10.35个百分点。

表3 各种蛋白酶除蛋白质效果比较Table 3 Comparison of deproteinization effect of variousproteases
3 讨论与结论
料液比、提取温度、提取时间是影响多糖提取率的主要因素。本试验研究表明,影响多糖提取率的因素主次顺序为料液比>提取时间>提取温度。料液比是影响多糖提取率的最主要因素。其作用机理可能是随着溶剂量的增加,体系的扩散压也随之增大,促进了多糖分子向体系外围扩散,有利于多糖的提取,使得提取率上升并达到平衡状态;而溶剂量过大,杂质分子也被溶出,挤占多糖分子的空间,造成提取率下降。这一结果与杨申明等[20]的研究结果较为一致。多糖提取率也与提取温度有关,研究表明,一定范围内,多糖的溶解度随着温度的升高而增加。当提取温度高于80 ℃时,多糖分子间的氢键因高温而被破坏,造成糖链断裂,多糖水解成单糖和寡糖,导致多糖提取率降低[21]。此外,多糖提取率的下降也可能与多糖因加热时间过长而被降解有关[22]。
本试验联合采用单因素试验和正交试验,分析了料液比、提取温度、提取时间和提取次数关键工艺因素对多糖提取率的影响,最终确定了红甜菜多糖提取的最优工艺条件,即料液比(g/mL)为1∶40,提取温度为80 ℃,提取时间为1.5 h,提取次数为3次。在该工艺条件下,红甜菜多糖的提取率为38.92%。同时比较不同蛋白酶除蛋白的效果,发现胰蛋白酶解法除蛋白的效果最好。
本试验所优化的红甜菜多糖提取方法操作简单,可重复性好,准确性高,适合红甜菜多糖的提取,并为红甜菜多糖的进一步研究提供了依据。
