超声心动图指导双腔起搏患者房室间期优化的研究
2022-04-06李丽娜张姝兰强佳琪岳庆雄
李丽娜 刘 佳 张姝兰 强佳琪 董 敬 岳庆雄
双腔DDDR型起搏器植入已广泛应用于Ⅲ度房室传导阻滞患者的临床治疗中,房室间期是保障起搏器植入患者心脏良好同步性的重要参数,也是获得血流动力学最大化的关键,直接影响患者的心功能及预后[1]。目前临床医师多采用起搏器出厂默认的房室间期保持不变,但由于患者房室间传导的延迟程度不同,故默认的出厂设置并非适用于所有患者。本研究应用超声心动图对双腔起搏患者房室间期进行个体化调节,探讨其优化效果。
资料与方法
一、研究对象
选取2018年1月至2019年12月在我院植入双腔起搏器(DDDR 型,美敦力公司)术后3个月的患者80例,初始房室间期均为出厂默认设定[起搏房室间期(PAV)150.0 ms,感知房室间期(SAV)120.0 ms]。纳入标准:①持续性Ⅲ度房室阻滞;②首次植入双腔起搏器;③电极置于右心耳及右室间隔部;④近期未使用影响心脏功能的药物,且随访期间未更改药物治疗方案。排除标准:①术前有心房颤动(以下简称房颤)病史、左室射血分数(LVEF)<40%、中度及以上二尖瓣反流;②先天性心脏病、心肌病、严重心脏瓣膜病、心肌梗死、慢性阻塞性肺疾病、肝功能和肾功能不全等疾病患者;③超声图像质量不理想者。根据简单随机法将80 例患者分为优化组和非优化组,每组各40 例。优化组中男21 例,女19 例,年龄53~76 岁,平均(62±12)岁;非优化组中男24例,女16例,年龄50~74岁,平均(59±13)岁。两组年龄、性别比、高血压病史、糖尿病史、冠状动脉粥样硬化性心脏病史、吸烟史、饮酒史、用药史等比较差异均无统计学意义;研究期间两组患者均未出现头晕、夜间阵发性呼吸困难、端坐呼吸、晕厥、肺水肿等症状。本研究经我院医学伦理委员会批准,所有患者均知情同意。
二、仪器与方法
1.仪器:使用GE Vivid E 90彩色多普勒超声诊断仪,M5S探头,频率1.5~4.6 MHz;配备EchoPac分析工作站。
2.食管心电图检查:使用DF-5A 心脏电生理刺激仪(苏州市东方电子仪器厂)。患者取平卧位,5 极电极导管经鼻腔插入食管,调整深度至食管导联记录到高大P 波,记录窦性心律或起搏心律下的体表12 导联和食管导联同步心电图,测量房间传导时间(IACT)、心房感知心室起搏的IACT(IACTs)及双腔起搏的IACT(IACTp)。继续下探电极导管直至食管导联清晰显示左室除极波,测量室间传导时间(IVCT),上述参数均测量3 次取平均值,所有操作均由同一心电生理科医师完成。
3.超声心动图检查:所有受检者均于静息状态下同步连接心电图,取左侧卧位,采集连续3个心动周期的心尖四腔心、三腔心、两腔心的二维动态图像,帧频<60帧/s,存盘以备分析。根据美国超声心动图学会(ASE)指南[2],应用Simpson 双平面法测量左室舒张末期容积(LVEDV)、收缩末期容积(LVESV)和LVEF,左房最大容积通过体表面积校正后得到左房容积指数(LAVI),获得二尖瓣口舒张早期血流峰值流速(E),组织多普勒测量二尖瓣环室间隔侧舒张早期运动速度(e’),计算E/e’。使用EchoPac 工作站脱机分析,沿心内膜边界手动调节感兴趣区,计算左室整体纵向平均应变(GLS-Avg)。所有参数均测量3次取平均值。
4.房室间期优化方法:于起搏器植入术后3 个月(观察基点)进行房室间期优化,检测全天心率分布主要区间的IACT 和IVCT,然后于超声心动图指导下调节左房室间期(每次调节间隔10 ms)进行优化,通过公式确定最佳房室间期(PAV 或SAV),房室间期=左房室间期+IACT-IVCT。最佳房室间期的评价标准[3-4]:二尖瓣血流频谱中E 峰与A 峰的总持续时间(即有效舒张时间)最长,且E、A 峰形态良好,既无E-A峰融合,也无A峰切尾。
5.其他随访事件收集:①以起搏器存储的心房高频事件中心房率<350 次/min 作为房颤事件,持续时间<48 h 者记录为阵发性房颤;②其他并发症及心源性再入院事件包括低血压、晕厥、心肌梗死、心功能衰竭、心律失常等。
6.观察时点及内容:以起搏器植入术后3 个月为观察基点,术后6、12、18 个月为随访时点。于观察基点记录患者的一般资料、食管心电图和常规超声心动图检查情况。优化组于超声心动图指导下行起搏器程控优化,记录优化前后超声心动图参数;非优化组房室间期为出厂默认设定,全程不优化。于各随访时点比较两组超声心动图检查结果,记录房颤及其他并发症事件。
三、统计学处理
应用SPSS 17.0统计软件,符合正态分布的计量资料以x±s表示,多组比较采用单因素方差分析,两组比较行独立样本t检验;计数资料以例表示,行χ2检验。最佳左房室间期与心率的相关性采用Spearman 相关分析法。P<0.05为差异有统计学意义。
结果
一、优化组优化前后超声心动图参数比较
优化组优化后有效舒张时间较优化前即刻延长(P<0.05),余超声心动图参数比较差异均无统计学意义。见表1和图1。
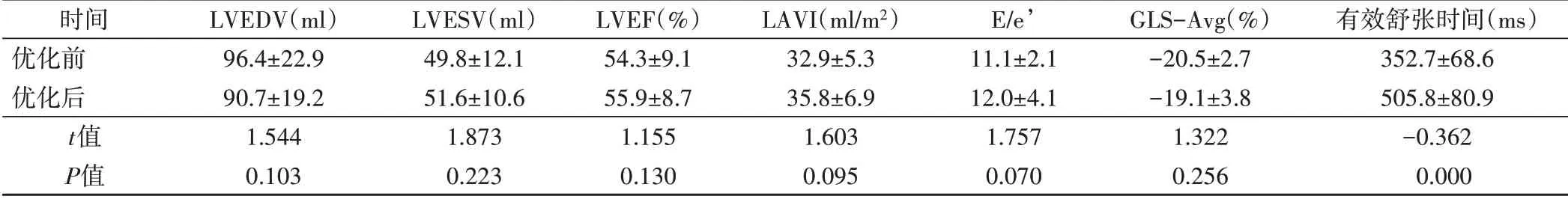
表1 优化组优化前后超声心动图参数比较(x±s)
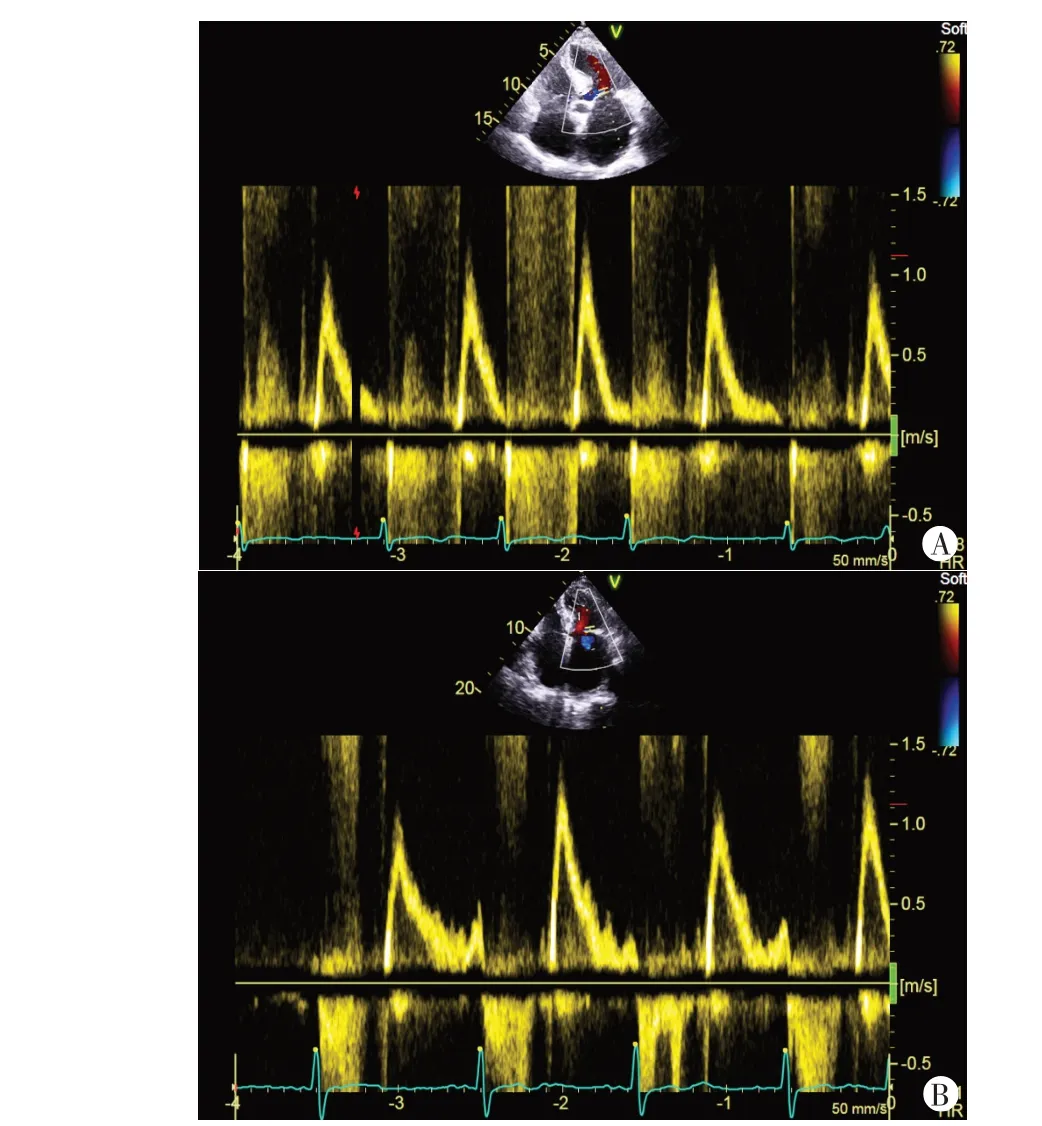
图1 优化前PAV为150.0 ms,左房室间期为170.0 ms,见E-A峰融合(A);优化后PAV 为120.0 ms,左房室间期为140.0 ms,见E-A 峰重叠比例较优化前下降,有效舒张时间为582.7 ms(B)
二、两组食管心电图检查结果比较
观察基点测得两组IACTs、IACTp、IVCT及IACTs、IACTp 对应的左房室间期比较差异均无统计学意义。见表2。优化组优化后PAV 和对应的左房室间期均较优化前明显延长[(162.5±21.3)ms vs.150.0 ms,(131.5±11.9)ms vs.(120.7±14.7)ms],差异均有统计学意义(均P<0.05);优化后SAV 和对应的左房室间期与优化前比较差异均无统计学意义[(125.0±22.6)ms vs.120.0 ms,(128.8±12.2)ms vs.(123.6±16.8)ms]。鉴于IACT 在心率无明显变化时相对固定,IACT、IVCT 未行优化前后比较,视为固定值。
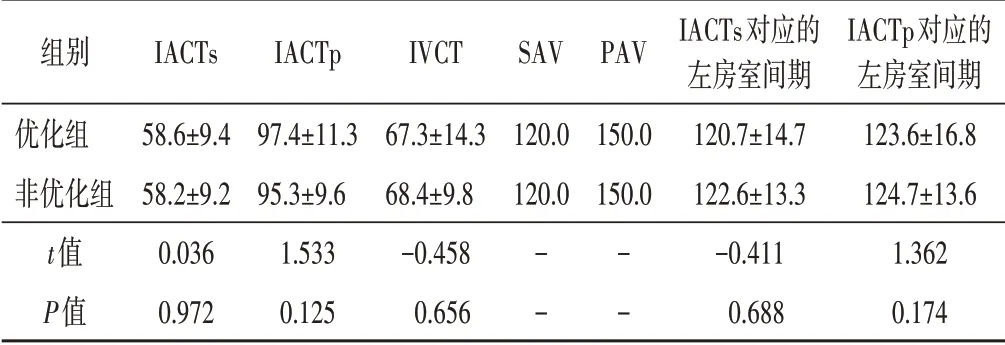
表2 两组观察基点食管心电图测量参数比较(x±s) ms
三、两组超声心动图参数比较
1.组间比较:观察基点优化组与非优化组超声心动图各参数比较差异均无统计学意义。优化组术后6、12、18 个月GLS-Avg、有效舒张时间均高于非优化组,术后12、18个月LAVI均低于非优化组,术后18个月LVEDV、LVEF 均高于非优化组,LVESV、E/e’均低于非优化组,差异均有统计学意义(均P<0.05)。
2.组内比较:非优化组GLS-Avg 术后12、18 个月依次降低,LVEF 术后18 个月低于术后12 个月,差异均有统计学意义(均P<0.05)。优化组GLS-Avg 术后6、12、18个月依次增高,术后6个月有效舒张时间大于观察基点,术后18个月LVEDV、LVEF均较术后12个月增加,LVESV 减小,差异均有统计学意义(均P<0.05)。见表3和图2,3。
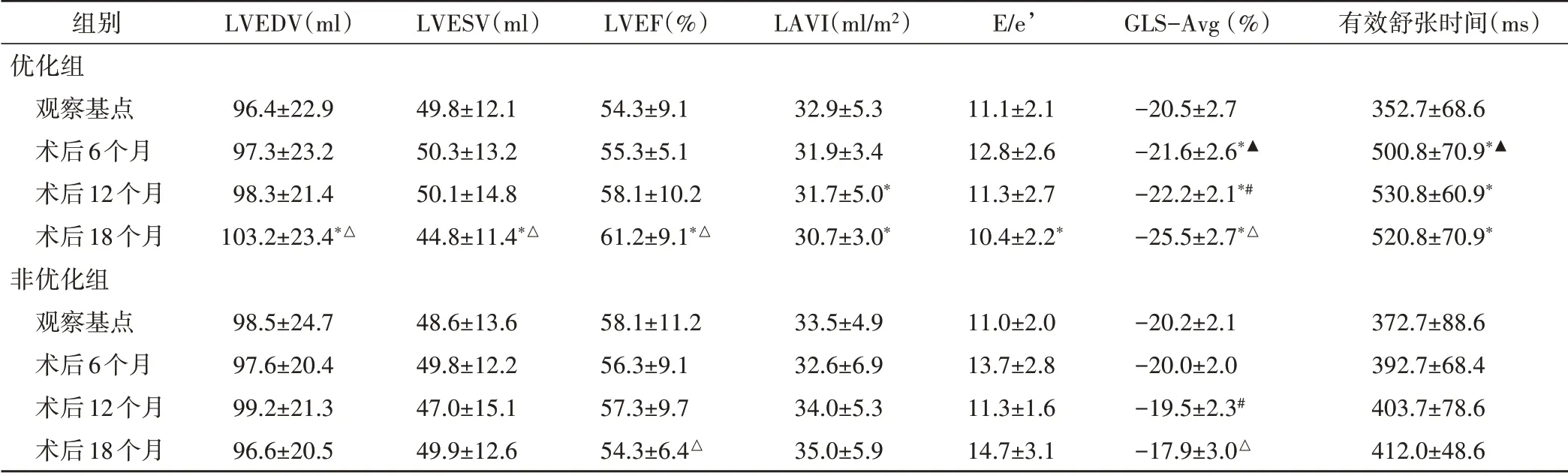
表3 两组不同时间点超声心动图参数比较(x±s)
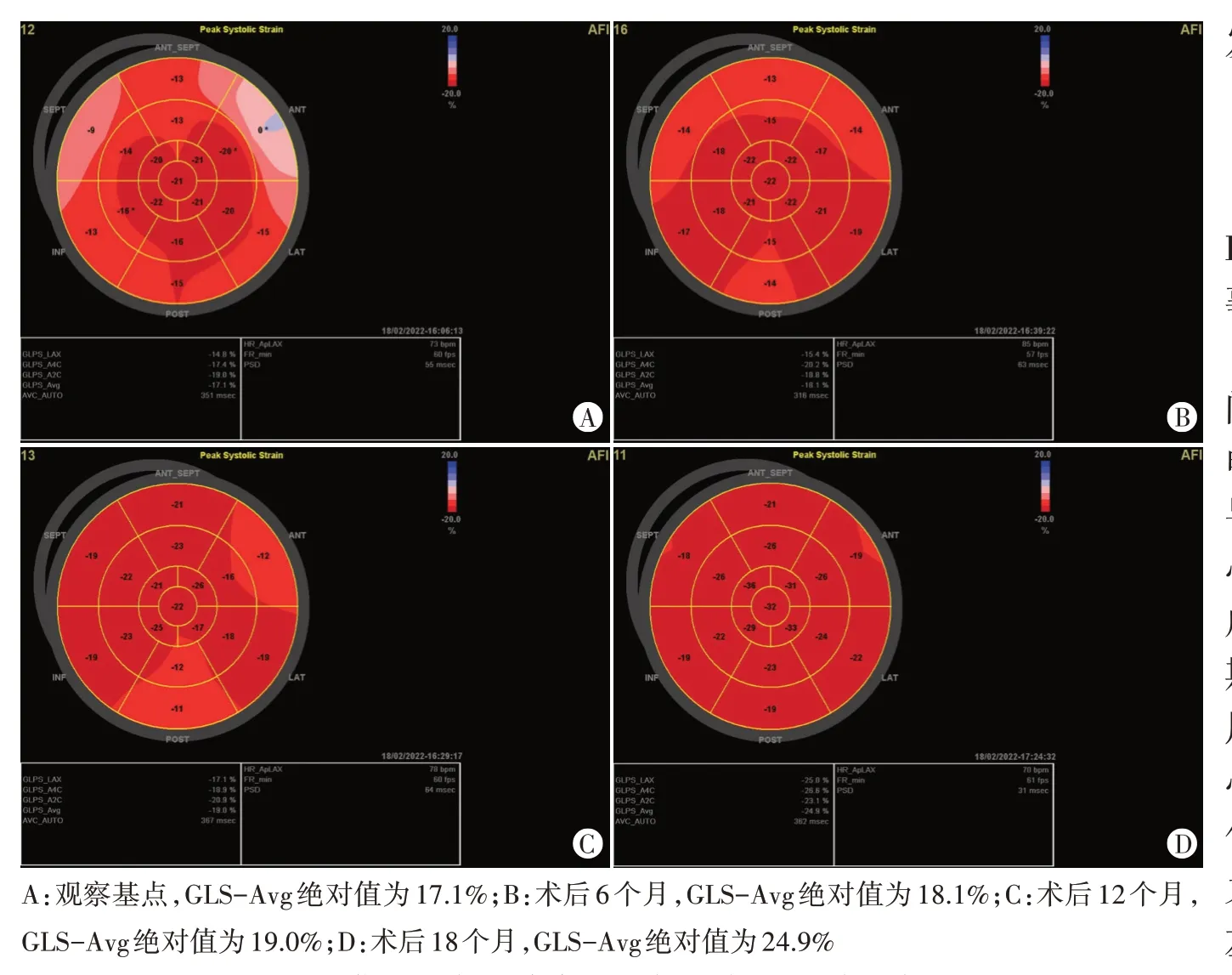
图2 优化组同一患者术后不同时间点二维斑点追踪图
四、相关性分析
Spearman 相关分析显示,优化组心率与最佳左房室间期呈负相关(r=-0.911,P=0.000)。见图4。
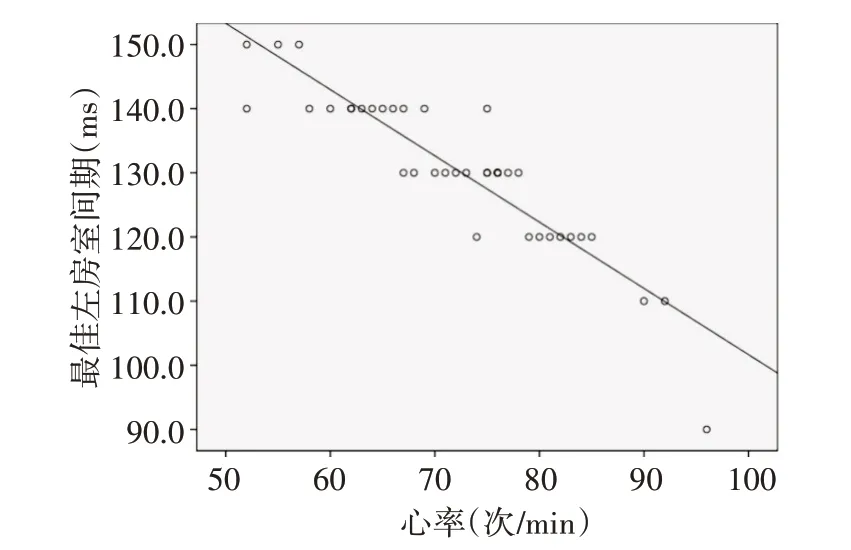
图4 优化组心率与最佳左房室间期的相关性分析散点图
五、两组随访情况比较
优化组术后12、18个月新发房颤比例均低于非优化组,差异均有统计学意义(均P<0.05)。见表4。随访至终点,两组患者均未发生低血压、晕厥等其他并发症及心源性再入院事件。
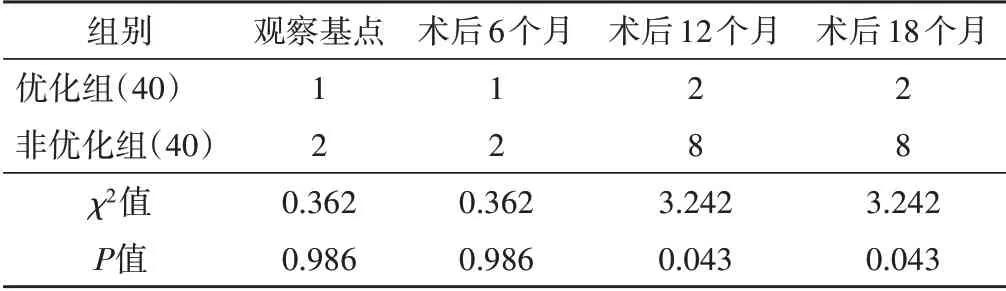
表4 两组不同时间点新发房颤比较 例
讨论
起搏器房室间期相当于心脏的PR 间期,是在一次感知或起搏心房事件后,起搏器在起搏心室前等待自身心室波出现的时间。最优房室间期可获得心房收缩和心室收缩的电-机械同步性,而不良房室间期可导致较差的血流动力学结果,诱发心功能下降并增加房颤发生率,造成远期预后不良[5]。在优化房室间期的众多方法中,超声心动图最常用,以往多通过程控房室间期观察心输出量或Tei 指数的变化进行优化,需要多数据重复计算,耗时耗力,且体表心电图很难获得左房及左室除极波的起点,故不能明确左房室间期。本研究拟结合食管心电图探讨应用超声心动图中舒张频谱进行房室间期优化的应用价值。
本研究以有效舒张时间最长,且既无E-A峰融合,也无A 峰切尾为评估标准,优化房室间期并获得最佳左房室间期。结果显示,优化后有效舒张时间较优化前即刻延长(P<0.05),这是由于优化左房室间期后,左房室间的机械协调性即刻得到改善,故心脏血流动力学指标有效舒张时间迅速延长。有效舒张时间延长后左房压会降低,左房压长期降低有效避免了左房的扩大,本研究优化组患者术后12、18个月LVAI均低于非优化组(均P<0.05),也证明了这一结论。本研究发现优化组最佳左房室间期与心率呈负相关(r=-0.911,P=0.000)。对于心率较快的患者,房室间期出厂设置会表现为E、A峰融合,这种效应在患者心率<90次/min时尤为显著,此时通过调低左房室间期,可以增加充盈时间,降低重叠比例。该现象与Andreas等[6]发现血流动力学最佳房室间期随心率增快而缩短的结论一致,表明临床治疗中进行个体化房室间期设定十分必要。
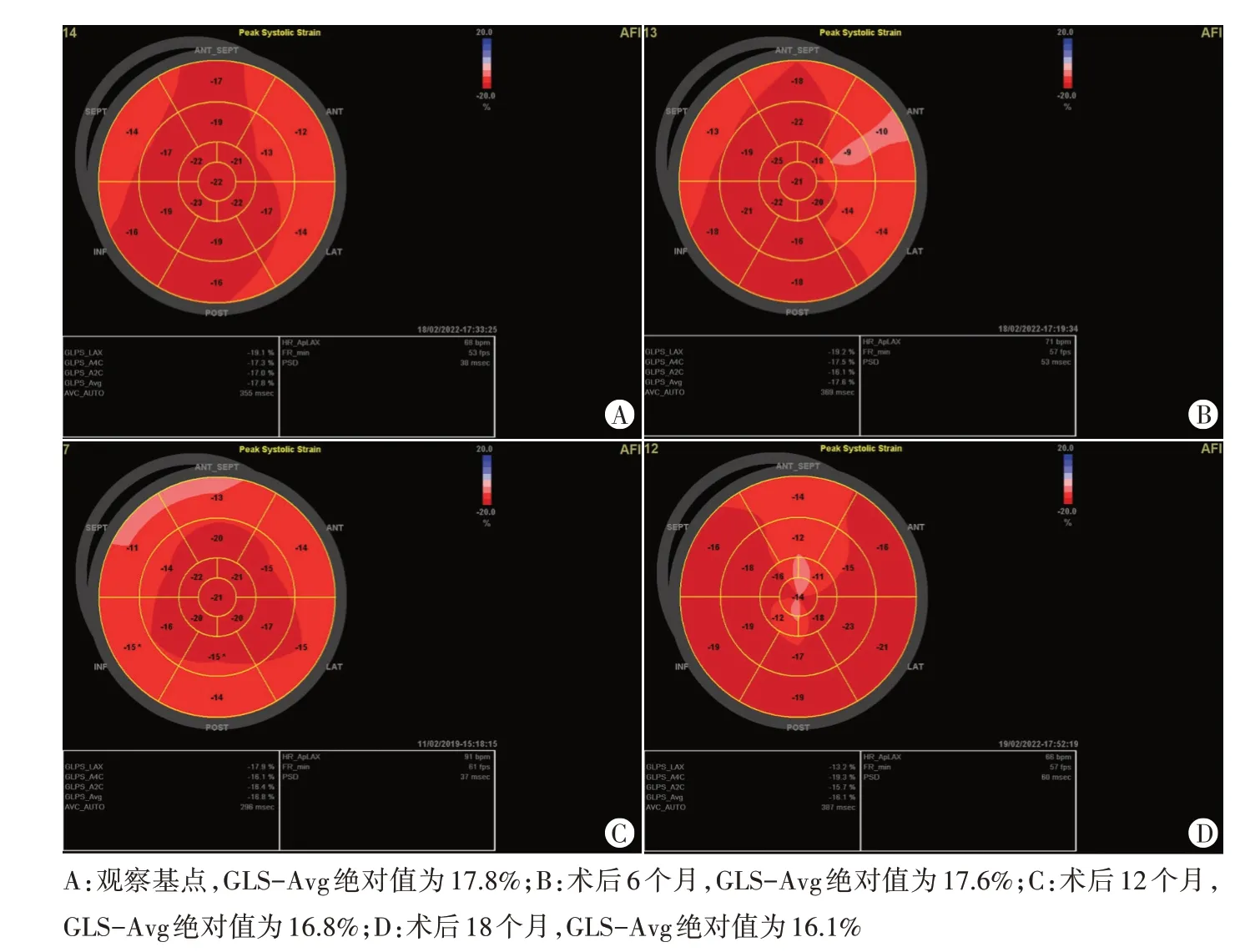
图3 非优化组同一患者术后不同时间点二维斑点追踪图
本研究食管心电图检测结果显示,优化组优化后PAV 为(162.5±21.3)ms,较默认值150.0 ms 明显延长,对应的左房室间期为(131.5±11.9)ms,亦较优化前(120.7±14.7)ms明显延长,差异均有统计学意义(均P<0.05)。最佳房室间期的数值变化范围较大,分析原因为:①部分双腔起搏患者存在明显的IACT 或IVCT 延长;②部分患者心律偏快;上述两种情况均会导致房室间期出厂设定相对过短或过长。舒张期心室快速充盈产生E 峰,舒张末期心房收缩产生A 峰,当房室间期过短时,心室充盈时间缩短,A 峰将被提早关闭的二尖瓣终止,超声心动图显示A 峰被切尾,左房对左室的充盈作用部分或完全丧失;由于心率偏快,房室间期过长,表现为E、A 峰融合,心室舒张时间缩短,心室收缩时房室瓣仍处于开放状态,造成二尖瓣反流,上述效应长期存在会使左房容积增大,房性心律失常的发生率增加,这也表明术后优化房室间期十分必要。
本研究于术后3 个月(观察基点)观察两组患者超声心动图检查情况,发现各参数比较差异均无统计学意义,优化组术后12、18 个月LAVI、新发房颤比例均低于非优化组(均P<0.05),术后18 个月优化组LVEDV、LVESV、LVEF 、E/e’与非优化组比较差异均有统计学意义(均P<0.05)。分析原因为:①植入双腔起搏器后,由于是右房和右室起搏,心脏正常的传导顺序发生了改变,可能导致左房室传导时间过长或过短,降低了左房室的机械同步性,可能降低诱发心功能及增加房颤发生的风险[7];②优化组通过个体化调节房室间期获得了最佳的血流动力学,使左室舒张更加充分,恢复了心房收缩功能,从而延缓左房增大,降低了房颤的发生风险;③个体化房室间期调节能更充分地发挥左房辅助泵作用,使舒张时间合理延长,左室充分充盈。文献[8]报道超心动图声指导最佳房室间期设置可使左室充盈增加20%,这也可能是本研究优化组LVEDV高于非优化组的原因,术后18个月时反映舒张功能的指标E/e’亦优于非优化组(P<0.01)。根据Frank-Starling定律[9],心室舒张末期容积的适当增大可增强心室收缩力,故术后18 个月优化组LVESD 和LVEF与非优化组比较差异均有统计学意义(均P<0.05)。本研究优化组GLS-Avg 术后6 个月即出现改善,并于术后12、18 个月依次增高,差异均有统计学意义(均P<0.05)。这是因为斑点追踪技术通过对心肌斑点逐帧追踪来定性和定量显示心肌运动轨迹,对容量负荷的变化十分敏感,可以早期敏感评价容量负荷对心肌收缩力的影响[10]。而传统LVEF 是观察室壁形变,通过室壁运动幅度来计算心肌收缩力,不能早期反映左室收缩功能的改变,故应用GLS-Avg 可对优化效果进行早期评价。
综上所述,相对于出厂默认房室间期设定,以舒张期二尖瓣血流频谱持续时间最长且形态良好进行优化,效果直观,操作简便易行,可实现左室舒缩功能的改善,减少或延缓房颤的发生,左室整体纵向应变可早期评价优化效果。但本研究纳入患者均无明显心力衰竭,今后需进一步探讨心功能损伤患者的优化情况。
