C1q肿瘤坏死因子相关蛋白6破坏大鼠脑缺血再灌注损伤后血脑屏障的机制研究
2022-04-06马晓晴任宇倩倪钦帅李广文郭云良
马晓晴,任宇倩,倪钦帅,李广文,郭云良
缺血性卒中具有发病率高、致残率高、死亡率高的特点,是威胁人类生命与健康的最主要疾病之一[1]。缺血损伤后继发的炎性反应、血脑屏障破坏、神经元坏死对缺血性卒中的预后产生重要影响[2]。血脑屏障由内皮细胞、周细胞、星形细胞末端足和基底膜组成,调节中枢神经系统和外周血循环之间的物质交换,在中枢神经系统稳态中发挥着重要作用[3-4]。血脑屏障的破坏和功能障碍进一步导致白细胞浸润、脑水肿和出血性转化是卒中发作后的常见机制[5],维持血脑屏障的稳定性和功能正常以保护中枢神经系统免受继发性损伤是治疗缺血性卒中的潜在策略[6]。血脑屏障的物理屏障由多种因素促成,包括脑血管内皮细胞和复杂的紧密连接结构[7]。内皮细胞是血脑屏障最重要的组成部分[8],内皮细胞闭合蛋白(occludin)和闭锁小带蛋白-1(zonula occludens 1,ZO-1)是血脑屏障最重要的紧密连接蛋白,对维持血脑屏障的完整性发挥着至关重要的作用[9]。紧密连接结构中断是缺血性卒中后血脑屏障细胞旁通透性增加的主要原因[10]。C1q肿瘤坏死因子相关蛋白6(C1q and tumor necrosis factor related protein 6,C1QTNF6)是脂联素旁系同源蛋白家族的成员[11],可正向调节炎症因子IL-1β,导致缺血再灌注后的心肌损伤加重[12],但对缺血性卒中血脑屏障破坏的机制尚不十分清楚[13]。既往研究证实,IL-1β促使脑血管内皮紧密连接蛋白occludin、ZO-1发生溶解,增加了血脑屏障的渗透性,从而加重脑损伤[14],并且IL-1β会延迟血脑屏障修复的时间[15]。本研究旨在探讨脑缺血再灌注损伤后C1QTNF6能否促使IL-1β释放,降低occludin和ZO-1的表达,进而破坏血脑屏障的完整性,加重缺血后脑损伤。
1 材料与方法
1.1 材料 成年健康雄性S D大鼠3 6只,体质量23 0~260 g,无特定病原体(specific pathogen free,SPF)级,合格证编号:20210427Aazz0619000368。实验前大鼠被置于动物房适应性饲养5 d,自由进食、饮水,室温25±2 ℃,自然光照。短发夹R NA(short hairpin RNA,shRNA)C1QTNF6(shRNAC1QTNF6)慢病毒载体(序列:GCT GAC ACG GTC AAT GCT GTT)用于沉默C1QTNF6 信使RNA(messenger RNA,mRNA)水平,转染试剂Lipofectamine®RNAiMAX Reagent用于转染慢病毒载体,大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)线栓用于模型建立(货号:2636)。
1.2 方法
1.2.1 动物分组与造模 将36只SD大鼠随机分为假手术组10只、模型(MCAO/R)组13只和转染(shRNA-C1QTNF6)组13只。采取尾静脉注射法,将shRNA-C1QTNF6慢病毒载体100 μL加入Lipofectamine®RNAiMAX Reagent转染试剂35 μL混匀,取大鼠两侧尾静脉下1/3处进行静脉注射,假手术组与MCAO/R组各注射相同体积生理盐水。注射3 d后采用线栓法建立大鼠大脑中动脉闭塞/再灌注(MCAO/R)模型。大鼠术前禁食12 h,腹腔注射10%水合氯醛(3 mL/kg)麻醉,仰卧位固定于手术台。无菌操作,将线栓通过左侧颈外动脉(external carotid artery,ECA)插入颈内动脉(internal carotid artery,ICA),到达大脑中动脉(middle cerebral artery,MCA),缺血2 h后将线栓拔出,恢复血流再灌注。大鼠造模后和再灌注24 h后应用改良神经功能缺损评分(modified neurological severity score,mNSS)进行评估,将造模后mNSS 7~12分的18只大鼠视为成功模型纳入实验。不成功和死亡9只,其中假手术组去除1只意外死亡大鼠,MCAO/R组和shRNA-C1QTNF6组各去除4只造模失败大鼠。
1.2.2 评价指标
(1)行为测试评估神经行为功能:于手术前后、取材前,应用mNSS评定各组大鼠的神经行为功能,包括运动测试、感觉测试、平衡测试、反射测试和异常运动5个方面,总分0~18分,评分越高说明大鼠神经行为功能损伤越重。
(2)TTC染色比较脑梗死体积比值:于再灌注24 h后,每组随机选6只大鼠,麻醉后右心室灌注0.9%氯化钠注射液200 mL,断头取脑,用大鼠切脑模具自前向后连续冠状切片,厚度2 mm,切6片,其中第2片和第4片用作蛋白质印迹法(western blot,WB)蛋白含量检测,第1、3、5、6片置于2% TTC染色液于恒温箱37 ℃避光孵育15 min。正常的脑组织被染为红色,梗死的脑组织被染为白色。按切片顺序排序,正反拍照后应用ImageJ图像分析软件计算脑梗死体积比值。脑梗死体积比值=脑梗死体积/全脑体积×100%。
(3)WB检测C1QTNF6、IL-1β、occludin、ZO-1的表达水平:取上述(2)步骤中第2、4片梗死区顶叶半暗带脑组织80 mg,按脑组织和裂解液20 mg∶100 μL的比例加入RIPA裂解液(1 mL裂解液+10 μL苯甲基磺酰氟),4 ℃冰浴中超声研磨,置于4 ℃摇床30 min充分裂解,在4 ℃下以8000 r/min转速离心10 min,吸取上清液,BCA法测定蛋白浓度,加十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液(5×)混匀后沸水加热5 min,-80 ℃保存。取蛋白样品15 μg,SDS-PAGE分离蛋白,半干法转膜。聚偏二氟乙烯膜室温封闭2 h,用含5%脱脂奶粉的TBST缓冲液配制一抗,4 ℃摇床孵育过夜,TBST洗膜3次,每次10 min,配制辣根过氧化物酶标记的二抗稀释液室温孵育2 h,TBST洗膜3次,每次10 min。加入200 μL显影液混匀,化学发光多色荧光及活体成像系统(Vilber Fusion FX7,法国)曝光显影,应用ImageJ图像分析软件分析各组C1QTNF6、IL-1β、occludin、ZO-1各条带灰度值,目的蛋白条带灰度值与β-actin条带灰度值的比值即目的蛋白的相对含量。重复测定5次,取其均数。
(4)尼氏染色计数尼氏小体数量:脑缺血再灌注24 h后,每组选取余下的3只大鼠,腹腔麻醉后右心室灌注0.9%氯化钠注射液200 mL,断头取脑,将新鲜脑组织置于4%多聚甲醛溶液固定24 h后,置于4 ℃的30%蔗糖溶液至沉底,选取视交叉后脑组织20 μm厚度冠状切片,贴片法置于黏附性载玻片储存于-20 ℃冰箱。将冷冻脑组织切片采用PBS缓冲液洗涤后置于尼氏染色液中染色3 min,蒸馏水洗涤2次,每次10 s,再依次经70%、80%、90%乙醇各30 s梯度脱水,经二甲苯Ⅰ、二甲苯Ⅱ各1 min透明化,中性树胶封片。染色后尼氏小体呈深蓝色,细胞核呈淡蓝色。将其倒置于显微镜(10×、40×)下于梗死区顶叶半暗带皮质区随机选取5个视野拍照,用Image-Pro Plus 5.0图像处理软件计数尼氏小体数量。
(5)苏木精-伊红染色观察细胞的病理变化:取上述(4)步骤冷冻脑组织切片PBS缓冲液洗涤,无水乙醇固定30 s,蒸馏水洗涤,苏木精液染色1 min后流水冲洗30 s,1%盐酸乙醇浸泡30 s,流水冲洗30 s返蓝,伊红染色1 min,流水冲洗30 s后,置于70%、80%、90%乙醇各30 s梯度脱水,经二甲苯Ⅰ、二甲苯Ⅱ各1 min透明化,中性树胶封片。显微镜(10×、40×)下观察细胞核被染为蓝色,细胞质被染为红色。于梗死区顶叶半暗带皮质区随机选取5个视野拍照,观察细胞的病理变化。
(6)Tunel/Neun荧光染色检测梗死区顶叶半暗带神经元凋亡:取上述(4)步骤冷冻脑组织切片PBS缓冲液洗涤,置于10%羊血清封闭液中封闭2 h,先孵育一抗Neun,再用配制好的原位凋亡染色试剂盒Tunel检测液滴于脑组织切片之上,37 ℃避光孵育1 h,1×PBS缓冲液冲洗3次,每次5 min,DAPI染色液标记细胞核,室温(20~25 ℃)孵育15 min,抗荧光淬灭封片剂封片。于梗死区顶叶半暗带皮质区随机选取5个视野,于20×物镜下观察和拍照,其中细胞核被染为蓝色,Tunel阳性细胞被染为红色,Neun阳性细胞被染为绿色。Image-Pro Plus 5.0图像处理软件计数每个视野Tunel/Neun双阳性细胞数量,每张脑组织切片取5个视野的均数。
1.3 统计学方法 采用SPSS 22.0软件对数据进行统计分析。计量资料若符合正态分布且方差齐,以表示,采用单因素方差分析进行统计比较,然后采用Turkey法进行两两比较。设定P<0.05为差异有统计学意义。
2 结果
2.1 神经行为功能缺损评分 造模前3组大鼠的mNSS均为0分,差异无统计学意义。造模后,3组mNSS整体差异有统计学意义,MCAO/R组、shR NA-C1QTNF6组高于假手术组(均P<0.0001),shRNA-C1QTNF6组低于MCAO/R组(P=0.0003)。再灌注24 h,3组mNSS差异有统计学意义,MCAO/R组、shRNA-C1QTNF6组高于假手术组(均P=0.0001),shRNA-C1QTNF6组低于MCAO/R组(P=0.0001),差异均有统计学意义(表1)。
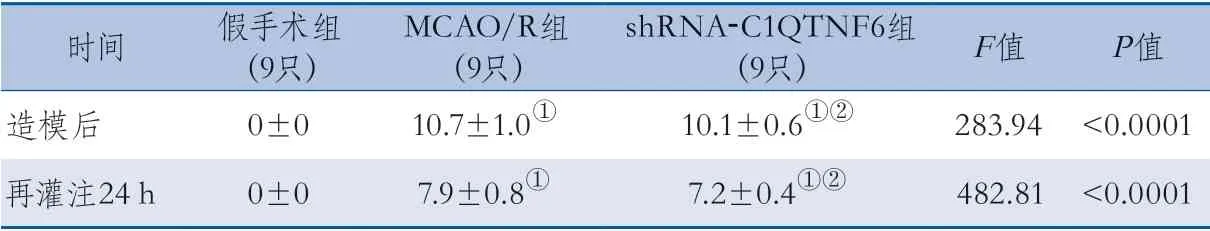
表1 造模后、再灌注24 h大鼠mNSS比较[单位:分]
2.2 脑梗死体积比值 3组TTC染色结果见图1。假手术组呈均匀红色,MCAO/R组可见大片白色梗死病灶。假手术组脑梗死体积比值为0±0,MCAO/R组为40.56%±7.74%,shRNAC1QTNF6组为26.32%±5.71%,3组整体差异有统计学意义。MCAO/R组、shRNA-C1QTNF6组高于假手术组(均P<0.0 0 01),sh R NAC1QTNF6组低于MCAO/R组(P=0.0004),差异均有统计学意义。
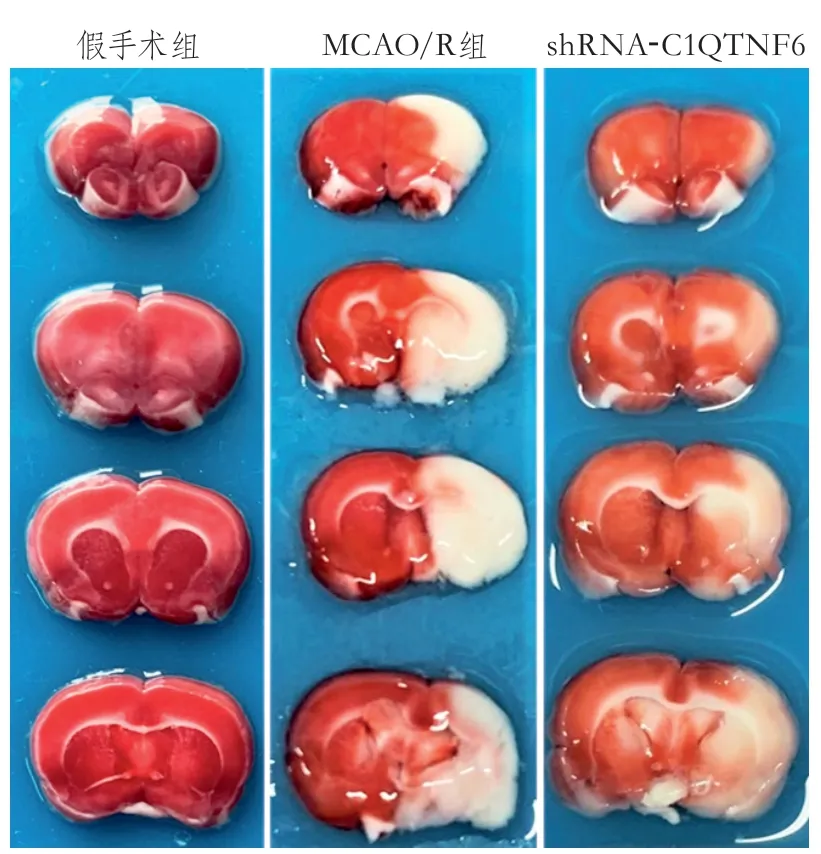
图1 大鼠脑缺血再灌注损伤TTC染色结果
2.3 梗死区顶叶半暗带脑组织C1QTNF6、IL-1β、occludin和ZO-1的蛋白表达水平 WB检测结果显示,各组梗死区顶叶半暗带脑组织C1QTNF6、IL-1β、occludin和ZO-1表达整体差异均有统计学意义(均P=0.0001)。shRNA-C1QTNF6组C1QTNF6的表达低于MCAO/R组和假手术组(P=0.0001、0.0067),MCAO/R组C1QTNF6的表达高于假手术组(P=0.0229)。MCAO/R组和shRNA-C1QTNF6组IL-1β的表达均高于假手术组(P=0.0001、0.0118),shRNA-C1QTNF6组IL-1β的表达低于MCAO/R组(P=0.0123)。occlud i n、ZO-1在MCAO/R组和sh R NAC1QTNF6组的表达均低于假手术组(P=0.0001、0.0124、0.0001、0.0038),在shRNA-C1QTNF6组的表达高于MCAO/R组(P=0.0003、0.0001),差异均有统计学意义(图2、表2)。
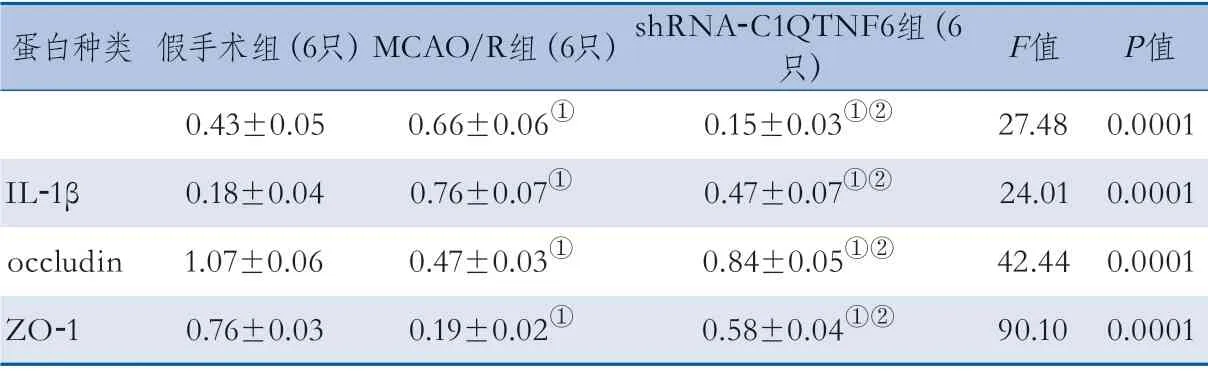
表2 各组大鼠C1QTNF6、IL-1β、occludin、ZO-1蛋白相对含量比较

图2 C1QTNF6对大鼠脑缺血再灌注损伤后脑组织IL-1β、occludin和ZO-1表达的影响
2.4 梗死区顶叶半暗带皮质区神经元尼氏小体的改变 尼氏染色结果见图3。假手术组神经元尼氏小体丰富,分布均匀,形态完整;MCAO/R组及shRNA-C1QTNF6组可见尼氏小体数量均有减少,形态有不同程度的改变,MCAO/R组出现大量网泡状结构,尼氏小体破碎,甚至消失,shRNA-C1QTNF6组尼氏小体破损程度较轻,排列较为整齐。假手术组尼氏小体数量为587.2±20.0个,MCAO/R组为181.6±21.5个,shRNA-C1QTNF6组为361.4±18.3个,3组尼氏小体数量整体差异有统计学意义(F=98.99,P<0.0 0 01)。假手术组尼氏小体数量最多,MCAO/R组和shRNA-C1QTNF6组尼氏小体数量少于假手术组(均P=0.0001),shRNAC1QTNF6组尼氏小体数量多于MCAO/R组(P=0.0001)。

图3 C1QTNF6对大鼠脑缺血再灌注损伤后神经元尼氏小体的影响
2.5 梗死区顶叶半暗带细胞形态的改变 苏木精-伊红染色结果显示,假手术组大鼠大脑皮质组织完整,神经元形态规则,排列整齐,无损伤变形,神经纤维走向排列规则;MCAO/R组大脑皮质组织出现断裂变形,神经元排列紊乱,出现大量变性坏死,神经纤维出现网状和条索状变形;shRNA-C1QTNF6组大脑皮质组织较为完整,神经元排列较为整齐(图4)。
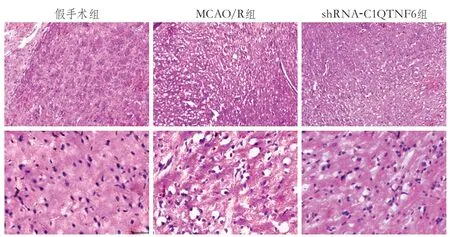
图4 C1QTNF6对大鼠脑缺血再灌注损伤后细胞形态的影响
2.6 梗死区顶叶半暗带神经元凋亡变化 神经元凋亡染色结果显示,假手术组神经元数量丰富,形态完整,分布均匀,无凋亡;MCAO/R组神经元数量减少,凋亡数量增多;shRNA-C1QTNF6组神经元数量有所减少,凋亡数量较多(图5)。假手术组Tunel/Neun双阳性细胞数量为4.00±1.52个,MCAO/R组为45.00±2.89个,shR NAC1QTNF6组为19.67±0.88个,3组整体差异有统计学意义(F=112.20,P<0.0001)。MCAO/R组和shRNA-C1QTNF6组数量多于假手术组(P=0.0001、0.0031),shRNA-C1QTNF6组数量少于MCAO/R组(P=0.0002)。

图5 C1QTNF6对大鼠脑缺血再灌注损伤后梗死区顶叶半暗带神经元凋亡的影响
3 讨论
本研究提示,脑内C1QTNF6表达在缺血再灌注24 h后明显上调,同时炎症因子IL-1β表达升高,进一步抑制血管内皮紧密连接蛋白ZO-1和occludin的表达,加剧血脑屏障的破坏和神经元凋亡;采用慢病毒尾静脉注射转染的方式对靶蛋白C1QTNF6进行mRNA基因沉默后,炎症因子IL-1β表达量明显下降,相应的血管内皮紧密连接蛋白ZO-1、occludin表达上升,神经元凋亡数量减少。研究结果表明,C1QTNF6在缺血再灌注损伤后血脑屏障破坏和神经元凋亡中发挥着重要作用。
C1QTNF6作为C1q/TNF相关蛋白家族成员之一,由4个独立的域组成,包括N端信号肽、短的可变域、胶原结构域和C端C1q球状结构域[16]。C1QTNF6主要在脂肪组织、心脏、脑组织及外周炎症细胞中表达,在脂肪酸代谢、肿瘤及炎症反应中发挥重要作用[17]。研究发现,小鼠心肌缺血后梗死区心肌细胞内C1QTNF6的表达显著降低,可进一步通过激活AMP活化蛋白激酶和磷脂酰肌醇-3-激酶/苏氨酸蛋白激酶B信号通路引起梗死心肌周围炎性因子(TNF-α、IL-1β和IL-6)的表达升高,而抗炎因子IL-10的表达下降[12]。基础研究还发现,在C1QTNF6基因敲除小鼠体内,外周血白细胞的数量和炎性因子分泌明显减少,提示C1QTNF6基因可以抑制外周炎症细胞凋亡,促进体内的免疫炎性反应[18]。新近研究发现,C1QTNF6的过表达促进了IL-1β的表达,进而加重颗粒物诱导的炎症反应[19]。本研究结果与上述研究相符合,脑缺血再灌注损伤后C1QTNF6表达显著升高,进而上调炎症因子IL-1β表达,参与脑缺血后的病理生理过程,而沉默C1QTNF6表达后,IL-1β的表达明显降低,卒中后的炎症反应减轻。以上数据提示在中枢神经系统中,C1QTNF6同样发挥着重要的促炎作用。
血脑屏障的完整性对于维持脑缺血损伤后中枢神经系统的稳态极为重要[8]。炎症反应是脑缺血后血脑屏障损伤的主要病理因素之一,IL-1β的表达上调可加速血管内皮紧密连接蛋白的瓦解[20],损害内皮细胞的屏障功能。IL-1β可调高MMP-9的表达,加重血脑屏障的破坏[21]。既往研究提示,炎症因子的过度表达是继发脑损伤加重的重要原因之一,脑内IL-1β可诱导血管内白细胞黏附,破坏血脑屏障完整性,导致外周白细胞向缺血脑组织浸润,加重脑组织炎症反应[22]。本研究结果表明,脑缺血再灌注损伤24 h内大鼠脑组织内IL-1β表达升高,同时内皮细胞紧密连接蛋白occludin和ZO-1表达显著下降,提示IL-1β可通过抑制occludin和ZO-1的表达,破坏血脑屏障的完整性,加重继发脑水肿和脑损伤;而抑制IL-1β的表达可恢复occludin和ZO-1水平,从而减轻缺血脑损伤导致的神经元凋亡,产生神经保护作用。
综上所述,脑缺血再灌注损伤后,脑组织内C1QTNF6表达上升,上调炎性因子IL-1β的表达,进而抑制内皮细胞紧密连接蛋白occludin和ZO-1的表达,破坏血脑屏障的完整性,从而加剧缺血区神经元的凋亡。抑制C1QTNF6表达后可通过保护血脑屏障完整性,对缺血再灌注后的神经元产生神经保护作用,为治疗缺血性卒中提供新的治疗思路。C1QTNF6作用于炎性分子的机制还需进一步研究,C1QTNF6低表达是否促进缺血再灌注后神经功能的恢复也有待进一步的探讨。
【点睛】本研究提示,C1QTNF6的沉默可减轻缺血再灌注损伤后血脑屏障破坏和神经元凋亡,为进一步研究缺血性卒中的神经保护机制提供了新的方向。
