神经影像模型对短暂症状伴梗死患者预后的预测作用研究
2022-04-06曹爽赵璐裴璐璐杨书祥高远方慧孙石磊吴军宋波许予明
曹爽,赵璐,裴璐璐,杨书祥,高远,方慧,孙石磊,吴军,宋波,许予明
TIA是缺血性卒中的高危因素,也是卒中防控的最佳窗口期[1-3]。TIA后发生卒中的风险取决于患者的临床特征、潜在的病理生理学差异和早期干预方式[4]。识别高危TIA人群并对其进行干预对卒中的预防极为重要[5]。近期研究表明,对于TIA或轻型卒中患者,更细节的脑组织影像学特征可能有更高的预测卒中发生的价值。一项纳入4789例TIA和小卒中的全球多中心的TIA登记研究(TIAregistry.org)显示,详细的脑组织影像学特征,如MRI DWI序列显示弥散异常提示TIA和轻型卒中患者卒中复发风险增加[6]。氯吡格雷用于急性非致残性脑血管病事件高危人群(clopidogrel in high-risk patients with acute nondisabling cerebrovascular events,CHANCE)研究也证实利用DWI影像特点可有效地对卒中复发风险进行分层[7]。
DWI异常的TIA患者其卒中风险远高于DWI正常的TIA患者[8-10],如将两者归为一类,则可能误判其卒中风险,延误有效干预的时机。因此研究者提出,出现T I A症状且DW I异常代表一种极不稳定的综合征——短暂症状伴梗死(transient symptoms with infarction,TSI)[11]。鉴于TSI的高卒中发生风险,临床上急需可识别高危TSI患者的工具以对这类患者采取早期干预治疗。既往研究报道,基于神经影像特征的综合卒中复发模型(comprehensive stroke recurrence model,CSR)对预测首发卒中患者的长期卒中复发风险具有较高的价值[12]。目前,CSR在TSI人群中预测卒中风险的价值尚未得到验证,故本研究探索CSR评分预测TSI人群短期和长期卒中风险的价值,并与传统的基于临床危险因素的评分进行比较。
1 对象与方法
1.1 研究对象 本研究基于郑州大学第一附属医院TIA数据库[13-14],前瞻性连续性纳入2010年10月-2017年8月的TSI患者。TSI定义为突然出现的局灶性或全脑神经功能障碍,持续时间不超过24 h,且MRI DWI序列存在弥散受限证据[15]。纳入标准:①符合TSI诊断标准;②年龄≥18岁;③最后一次TIA症状发作至入组时间<7 d;④TIA症状发作7 d内完成头颅影像学检查。排除标准:①因各种原因未完成头颅影像及血管影像的相关评估(无法获取CSR评分);②随访期间接受了血管内治疗(如颈动脉内膜切除术或支架置入术);③拒绝参加研究。
本研究经郑州大学附属第一医院伦理委员会审核通过(批准文件号:2010年科研第45号),所有参加该项研究的患者或其法定代理人均签署书面知情同意书。
1.2 基线及影像学数据收集 由经培训的医师收集患者的基线信息,包括人口学信息(性别、年龄),吸烟,既往病史(高血压、糖尿病、脂代谢紊乱、冠心病、心房颤动、卒中史),影像检查结果及二级预防用药情况。根据临床指标评定Essen卒中风险评分(Essen stroke risk score,ESRS)和ABCD2评分。标准的头颅MRI检查包括DWI、ADC、T1WI、T2WI、FLAIR等序列。标准的血管影像学检查至少包括一项颅内血管检查及一项颅外血管检查。颅内血管检查包括MRA、CTA或DSA;颅外血管检查包括颈部血管超声(artery ultrasonograph,US)、TCD、CTA或DSA。影像学检查由两名经培训的神经内科医师独立进行判读,如有分歧则由第三名医师(上级医师)判定。
1.3 随访与结局事件 在TSI后7 d及1年,由经培训的神经内科医师通过门诊或电话进行随访。终点事件为缺血性卒中的发生。缺血性卒中诊断标准为持续24 h以上的与新发梗死相关的局灶或全脑功能障碍,且经影像学证实[16]。
1.4 不同卒中风险评分标准
1.4.1 CSR评分 包括不同时期梗死、孤立皮层梗死、严重白质高信号、陈旧性腔隙性梗死及相关动脉狭窄5个分项,共8分[12]。
不同时期梗死:符合下列条件中的任何2项或以上,赋值3分。①ADC序列低信号,FLAIR序列等信号(超急性期);②ADC序列低信号,FLAIR序列高信号(早急性期);③ADC序列等信号,FLAIR序列高信号(急性期晚期或亚急性期)。
孤立皮层梗死:DWI序列上病变部位仅累及皮质区而不累及其他部位,赋值1分。
严重白质高信号:脑白质病变在FLAIR序列上为高信号,且无空洞形成。其严重程度使用Fazekas量表判定,分别对皮质下和脑室周围的白质高信号进行评分,总分≥3分为严重白质高信号,赋值1分。
陈旧性腔隙性梗死:轴向面最大直径≥3 mm的清晰病灶,与脑脊液具有相同的信号特征。判读陈旧性腔梗数量(n),并赋予相应分值(n=0,赋值0分;1≤n≤2,赋值1分;n>2,赋值2分)。
相关动脉狭窄:影像学(US、TCD、MRA、CTA或DSA)发现导致神经系统症状的颅内或颅外动脉≥50%狭窄,赋值1分。
1.4.2 ABCD2评分 包括年龄(1分)、高血压(1分)、临床特征(肢体无力2分,不伴肢体无力的言语障碍1分)、症状持续时间(<10 min:0分;10~59 min:1分;≥60 min:2分)和糖尿病史(1分),共7分。1.4.3 ESRS 来源于氯吡格雷与阿司匹林相比用于缺血事件高危患者(clopidogrel versus aspirin in patients at risk of ischaemic events,CAPRIE)试验,包括年龄(<65岁:0分;65~75岁:1分;>75岁:2分)、高血压(1分)、糖尿病(1分)、既往心肌梗死(1分)、其他心血管疾病(除外心肌梗死和心房颤动,1分)、外周动脉疾病(1分)、吸烟(1分)和既往缺血性卒中/TIA史(1分),共9分[17]。
1.5 统计学方法 使用SPSS 25.0对资料进行统计分析。正态分布的连续变量以表示,组间比较采用独立样本t检验。非正态分布的连续变量以M(P25~P75)表示,采用Mann-WhitneyU检验进行组间比较。分类变量以频数(率)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。计算CSR不同分值的缺血性卒中发生风险,并用Cochran-Armitage趋势性检验验证其趋势是否具有统计学意义。绘制各个评分的ROC曲线,计算AUC,应用Medcalc软件中的Delong方法进行不同量表的AUC比较,计算Z值及P值。计算不同CSR评分的约登指数并确定最佳截断点,据此将患者分为高CSR评分组和低CSR评分组,采用Kaplan-Meier法绘制终点事件的累积曲线,并用Log-rank检验对不同组别的卒中风险进行比较。
2 结果
2.1 基线特征 郑州大学第一附属医院TIA数据库在2010年10月-2017年8月期间纳入TIA病例1652例,其中554例(33.5%)患者MRI检查DWI阳性,诊断为TSI。排除无完整CSR评分(79例)、接受血管内治疗(21例)和失访(13例)患者后,最终共纳入441例患者。纳入和排除患者的基线特征比较差异无统计学意义(表1)。

表1 研究纳入和排除患者的基线特征比较
2.2 TSI患者发生缺血性卒中的影响因素 最终纳入的441例患者年龄范围18~86岁,平均年龄57.5±11.9岁,女性153例(34.7%),男性288例(65.3%)。7 d和1年随访时,分别有45例(10.2%)和97例(22.0%)患者发生缺血性卒中。1年随访时,与未发生卒中的患者相比,发生卒中的患者中高血压病史、卒中史比例更高,ABCD2评分≥4分及ESRS≥3分的比例更高,CSR评分总分及其分项指标的比例均更高,差异有统计学意义(表2)。
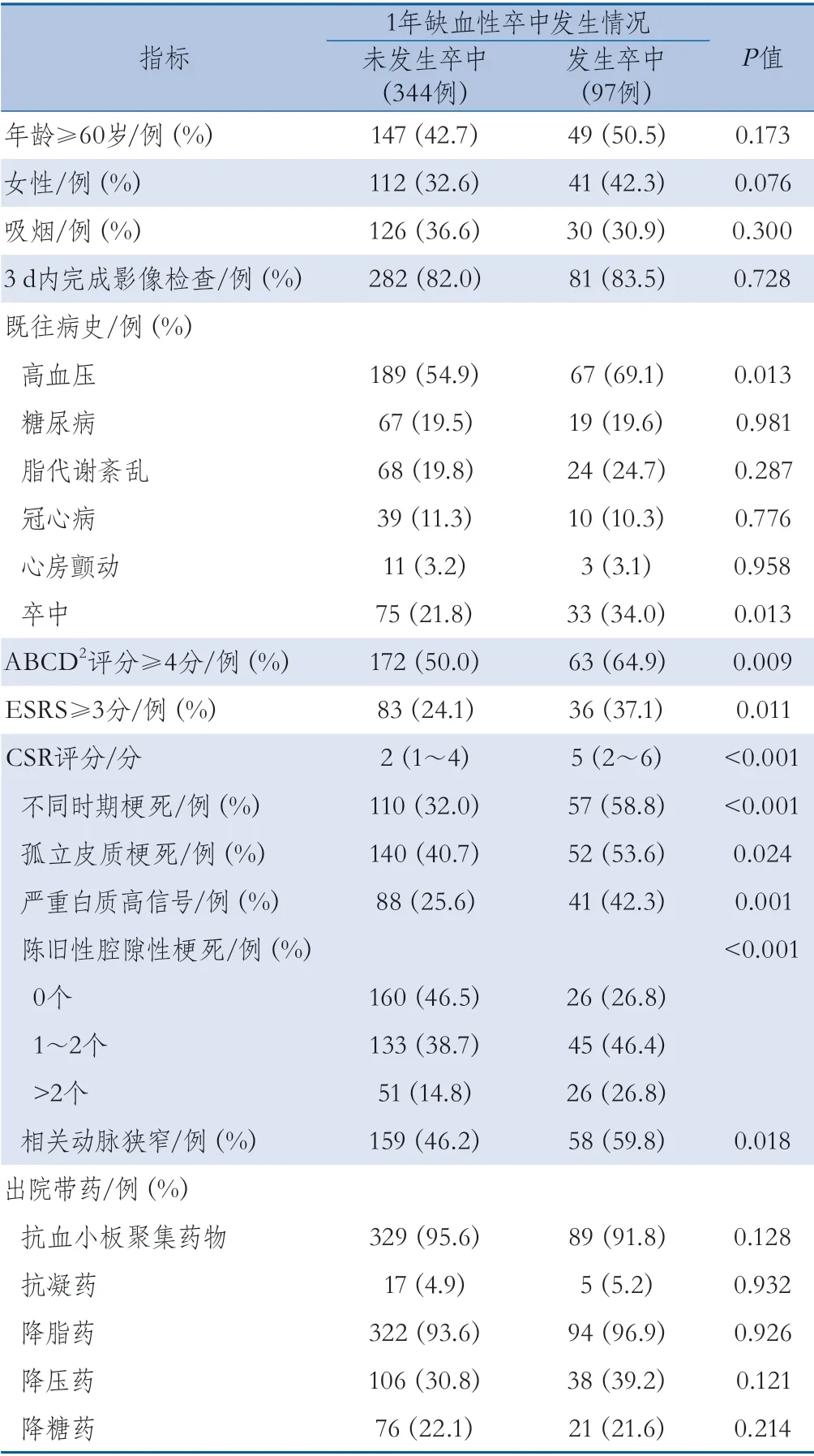
表2 随访1年是否发生卒中的TSI患者的基线特征比较
对不同CSR评分的TSI患者缺血性卒中的发生风险进行分析,结果显示随着CSR评分的增加,卒中风险增大(表3)。Cochran-Armitage检验显示这一趋势具有统计学意义(7 d,Z=-4.2081,P<0.001;1年,Z=-6.1108,P<0.001)。
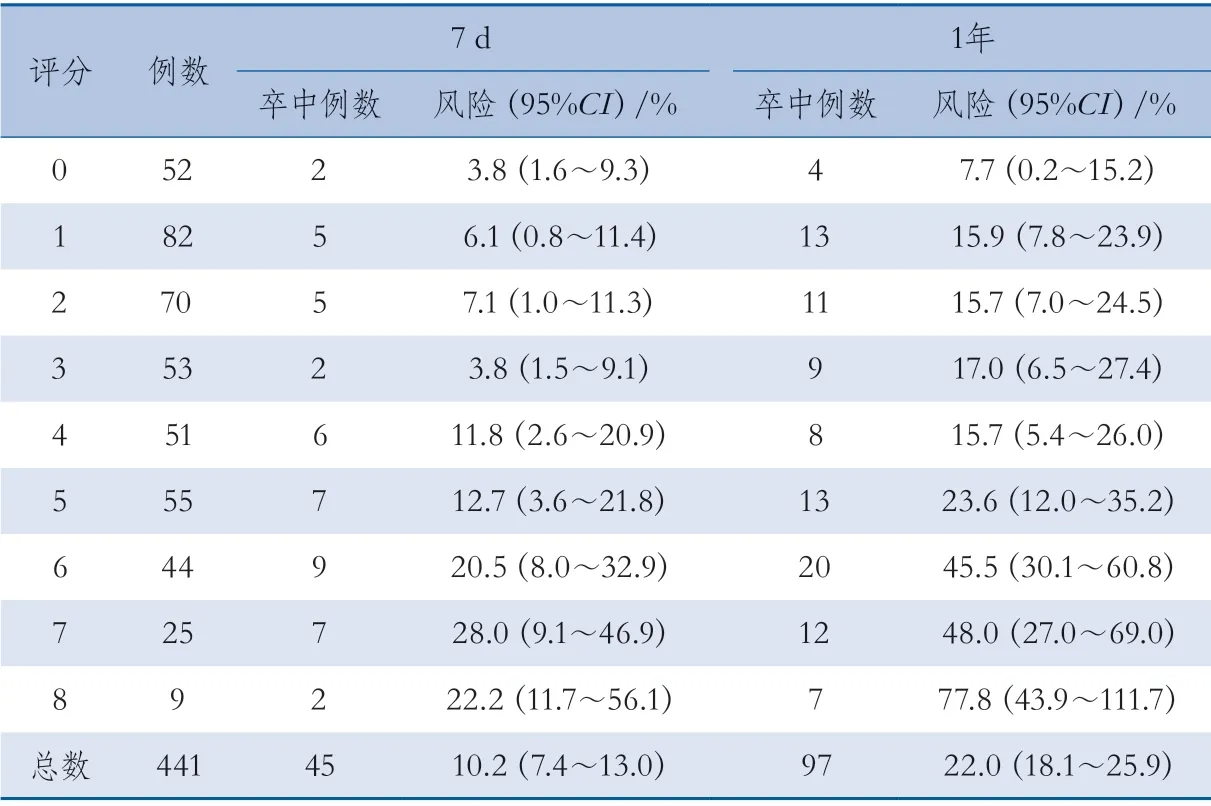
表3 不同CSR评分TSI患者的缺血性卒中发生风险
以1年随访是否发生缺血性卒中计算不同CSR评分的约登指数,以最大约登指数确定最佳截断点为5分。将TSI患者分为低CSR评分组(0~4分)和高CSR评分组(5~8分)。绘制不同评分组终点事件的累积曲线(图1)。数据分析表明,高CSR评分组比低CSR评分组有更高的卒中发生风险(log-rank检验,P<0.001)。
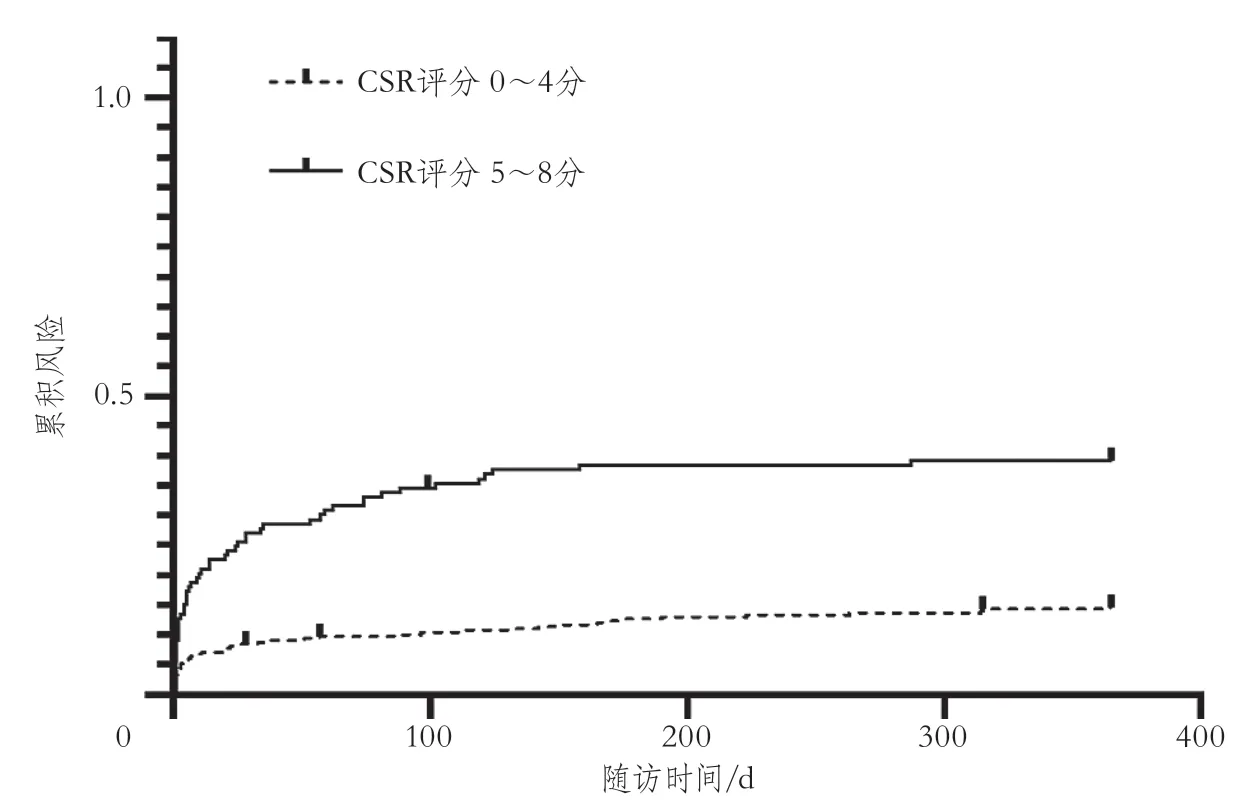
图1 不同CSR分值TSI患者缺血性卒中事件的累积风险
绘制各个评分的R O C 曲线并进行短期和长期卒中风险预测价值的比较(图2)。结果显示,C S R评分(AUC 0.681,95%CI0.635~0.724)对TSI后7 d缺血性卒中风险的预测价值与ABCD2评分(AUC 0.642,95%CI0.595~0.687,Z=0.687,P=0.498)和ESRS(AUC 0.577,95%CI0.530~0.624,Z=1.709,P=0.087)相比差异无统计学意义。CSR评分对1年缺血性卒中风险的预测价值(AUC 0.688,95%CI0.642~0.731)高于ABCD2评分(AUC 0.579,95%CI0.531~0.625,Z=2.466,P=0.014)和ESR S(AUC 0.580,95%CI0.532~0.626,Z=2.550,P=0.011)。

图2 不同评分预测TIS患者缺血性卒中风险的ROC曲线
3 讨论
随着MRI在临床上的广泛应用,大约有1/3的临床明确诊断的TIA患者可在DWI上发现有异常高信号[18-19]。本研究通过对纳入患者进行影像学评估发现,TSI患者占TIA患者的33.5%,与既往研究结果相似[18-19]。本研究中TSI患者7 d和1年卒中的发生率分别为10.2%和22.0%,证实TSI存在高卒中发生风险。另外,本研究结果还显示,基于神经影像特征的CSR评分在评估TSI患者的缺血性卒中风险方面,在短期随访时与传统临床评分如ABCD2、ESRS预测能力相当,在长期随访时,其预测能力高于ABCD2和ESRS评分。
ABCD2评分和ESRS是目前临床上常用的预测TIA和轻型卒中患者短期和长期卒中风险的量表[20]。ABCD2评分多被用来预测TIA后短期发生卒中的风险[21],可区分真正的TIA和可疑TIA,帮助社区和急诊对TIA患者进行分类,以快速识别需要入院的患者[22]。本研究结果表明,ABCD2评分预测短期卒中风险的AUC为0.642,与既往多中心队列的研究结果相似(AUC=0.68)[23],预测长期卒中风险的AUC为0.574,与福冈卒中登记中心的研究结果相似(AUC=0.570)[21]。ESRS是预测急性缺血性卒中和TIA患者长期卒中风险的经典评分工具[20],既往研究中,ESRS预测1年卒中复发风险的AUC多在0.6左右[24-25],本研究结果与既往研究一致。最近的研究显示,除临床危险因素外,神经影像学亦有助于判断TIA患者的预后[6]。Prabhakaran等[26]的研究结果显示,DWI阳性的TIA患者再发TIA或发生卒中的风险显著高于DWI阴性的患者,本研究与上述研究结果相似。
多项研究证实,基于临床危险因素的卒中复发预测工具虽然能够对卒中复发进行有效预测,但预测的准确度存在瓶颈,而最新的研究证明,影像标志能够极大地提高预测的准确性[6]。决定卒中复发最关键的因素是卒中的发病原因和机制。传统危险因素只能间接反映缺血性卒中的病因和发病机制,而在影像指导下,能够更明确地区别缺血性卒中的病因和发病机制。例如,不同时期的梗死提供了有价值的时间信息,即患者有复发事件的持续风险[27];孤立皮质病变多由不稳定来源的小栓塞引起,与隐源性栓塞的发病机制有关[28-29];脑白质损害和腔隙性梗死具有相似的小血管病病理基础,可导致脑血流量下降,更易发生缺血性卒中[30-33]。既往研究报道90 d复发风险评估量表(recurrence risk estimator at 90 days,RRE-90)在预测TSI后7 d和90 d的卒中风险方面具有较高的价值[15,34]。RRE-90评分将多发急性梗死、不同时期梗死、不同循环梗死及卒中病因分型作为评分项目纳入量表,但未纳入严重白质高信号、陈旧性腔隙性梗死和相关动脉狭窄等指标,而这些项目也是预测长期卒中复发风险的重要因素。本研究表明,基于重要神经影像特征的CSR评分预测TSI后长期卒中风险能力高于基于临床危险因素的评分如ABCD2评分和ESRS。在临床实践中,使用CSR评分可以进一步识别高风险TSI患者。
与以往的回顾性研究相比,本研究是一项前瞻性队列研究,结果显示,基于神经影像特征的CSR评分对TSI患者长期卒中发生风险的预测能力高于传统临床评分,CSR评分可以帮助临床识别高风险的TSI住院患者,节省医疗资源并制订个体化的急性期治疗和二级预防策略,以降低TSI后卒中的风险。本研究也存在局限性,如本研究为单中心研究,代表性欠佳,另外只纳入了住院患者,排除了部分症状轻微的只需要门诊诊疗的TIA患者,可能造成选择性偏倚。本研究结果还需要在大规模多中心临床研究中验证。
【点睛】基于重要神经影像特征的CSR评分预测TSI后长期卒中风险能力高于基于临床危险因素的评分。在临床实践中使用该评分可进一步识别高风险TSI患者。
