黑木耳液体菌种培养基配方及培养条件优化*
2022-04-06盛立柱叶松梅叶晓菊何建芬文冬华孙孔兰林火松
盛立柱,叶松梅,叶晓菊,何建芬,文冬华,孙孔兰,林火松
(1.龙泉市食药用菌产业办公室,浙江 龙泉 323700;2.浙江双益菇业有限公司,浙江 龙泉 323700)
黑木耳(Auricularia heimuer F.Wu,B.K.Cui&Y.C.Dai),隶属于担子菌纲(Basidiomycetes)木耳目 (Auriculariaceae)木耳科 (Auriculariaceae)木耳属(Auricularia),别称黑耳、云耳、树耳等[1]。黑木耳味道独特,嫩口爽滑,营养丰富,被现代营养学家誉为“素中之荤”,世界上称之为“中餐中的黑色瑰宝”[2],兼具食(药)用价值,具有提高免疫力、抗凝血和抗肿瘤等保健效果和药用功效,其营养价值丰富、味道鲜美且口感松脆,深受消费者喜爱[3]。
随着集约化、机械化生产规模的日益扩大,以及黑木耳产业转型升级的需求提升,液体菌种生产制作技术成为食用菌企业、合作社、菇农等的迫切需求,故对黑木耳液体菌种培养基配方进行筛选优化试验,可为黑木耳产业转型升级提供技术支持。
1 材料与方法
1.1 材料
菌种:选用的黑木耳菌种“黑山”来自龙泉市张良明菌种场。
斜面培养基:马铃薯200 g(去皮煮汁)、麸皮(煮汁)40 g、葡萄糖20 g、硫酸镁1 g、磷酸二氢钾2 g、琼脂20 g,加水至1 L[4]。
液体培养基:去皮马铃薯200 g、麸皮30 g、碳源25 g、氮源25 g、磷酸二氢钾2 g、硫酸镁2 g、VB 10 mg,加纯净水至1 L,pH自然。
1.2 试验方法
1.2.1 母种制备
在超净工作台上进行操作,挑取黑木耳木粒种,接种于PDA试管中,于25℃恒温培养箱内避光培养。待菌丝长满2/3试管斜面后,挑取边缘2/3处,直径为5 mm的菌块转接于PDA平皿中进行扩繁。继续于25℃恒温培养箱内避光培养,待菌丝长满平皿后待用。
1.2.2 液体菌种培养方法
向250 mL摇瓶中加入100 mL液体培养基,接入6块直径5 mm大小的菌种块,置于25℃恒温摇床中,150 r·min-1振荡培养6 d。
1.2.3 黑木耳菌丝体生物量测定
将培养好的菌丝体装入离心管,于4 000 r·min-1离心机内离心5 min,85℃条件下烘干至恒重,记录黑木耳菌丝体生物量,进行数据统计分析[5]。
1.2.4 不同碳源试验
分别以葡萄糖、果糖、蔗糖、麦芽糖、玉米粉为碳源(2.5 g),以蛋白胨为氮源(2.5 g),其他成分不变(去皮马铃薯20 g、麸皮3 g、磷酸二氢钾0.2 g、硫酸镁0.2 g、VB 10 mg),配制供试培养基。于250 mL摇瓶中加入100 mL供试液体培养基,0.12 MPa、121℃高压蒸汽灭菌30 min。参照参考文献[6]的方法,待压力降至0时,取出供试液体培养基,冷却至室温。在超净工作台内取6块直径5 mm的活化母种块,接种于摇瓶内。后续试验方法同1.2.2,培养6 d后测量菌丝体生物量。以不加碳源的培养基为对照,每个处理3次重复。
1.2.5 不同氮源试验
分别以蛋白胨、酵母粉、麸皮、豆粕、硫酸铵为氮源(2.5 g),以葡萄糖为碳源(2.5 g),其余成分不变(去皮马铃薯20 g、麸皮3 g、磷酸二氢钾0.2 g、硫酸镁0.2 g、VB 10 mg),配制供试培养基。以不加氮源的培养基为对照,试验方法同1.2.4。
1.2.6 无机盐配比试验
选用最佳碳源、最佳氮源,使用磷酸二氢钾和硫酸镁分别设置3个添加量配比。配比1为磷酸二氢钾0.2%、硫酸镁0.1%(比例为2∶1);配比2为磷酸二氢钾0.3%、硫酸镁0.3%(比例为1∶1);配比3为磷酸二氢钾0.1%、硫酸镁0.2%(比例为1∶2)。试验方法同1.2.2,每个配比3次重复。
1.2.7 培养基配方优化试验
根据单因素试验结果,选用最佳碳源、最佳氮源、硫酸镁和磷酸二氢钾为影响因子,采用L9(34)法进行正交试验。接种量5%、25℃、150 r·min-1恒温振荡培养6 d,测量黑木耳菌丝体生物量,确定黑木耳液体培养基最优配方。每个处理3次重复。
1.2.8 摇床培养温度试验
以筛选出的最优碳源、氮源、无机盐比例配制好供试培养基,接种量5%,摇床转速150 r·min-1,培养温度设置23℃、24℃、25℃共3个试验处理。每个处理3次重复,培养6 d。
1.2.9 摇瓶培养天数试验
试验以筛选的碳源、氮源和无机盐比例配置供试培养基。接种量5%,最优培养温度为1.2.8中筛选所得,150 r·min-1进行摇床培养,试验设置为培养3 d、4 d、5 d、6 d共4个试验处理,试验方法同1.2.2,每个处理3次重复。
1.2.10 摇床转速试验
试验以最佳的碳源、氮源和无机盐比例配置好供试培养基,接种量5%,按25℃培养,摇床转速设置 140 r·min-1、150 r·min-1、 160 r·min-1,3 个处理,培养6 d,试验方法同1.2.2,每个处理3次重复。
2 结果与分析
2.1 不同碳源对黑木耳菌丝生物量的影响
不同碳源对黑木耳菌丝生物量的影响见表1。

表1 不同碳源对黑木耳菌丝生物量的影响Tab.1 Effect of different carbon source on mycelial biomass of Auricularia heimuer
由表1可知,以玉米粉为碳源的试验组菌丝生物量最高,平均达到1 630 mg·100-1mL-1;其次是麦芽糖、蔗糖,菌丝生物量分别达450 mg·100-1mL-1、313.33 mg·100-1mL-1;几种碳源对黑木耳菌丝生物量影响的排序依次为玉米粉>麦芽糖>蔗糖>果糖>葡萄糖;其中葡萄糖和果糖效果较差,低于对照。
2.2 不同氮源对黑木耳菌丝生物量的影响
不同氮源对黑木耳菌丝生物量的影响见表2。
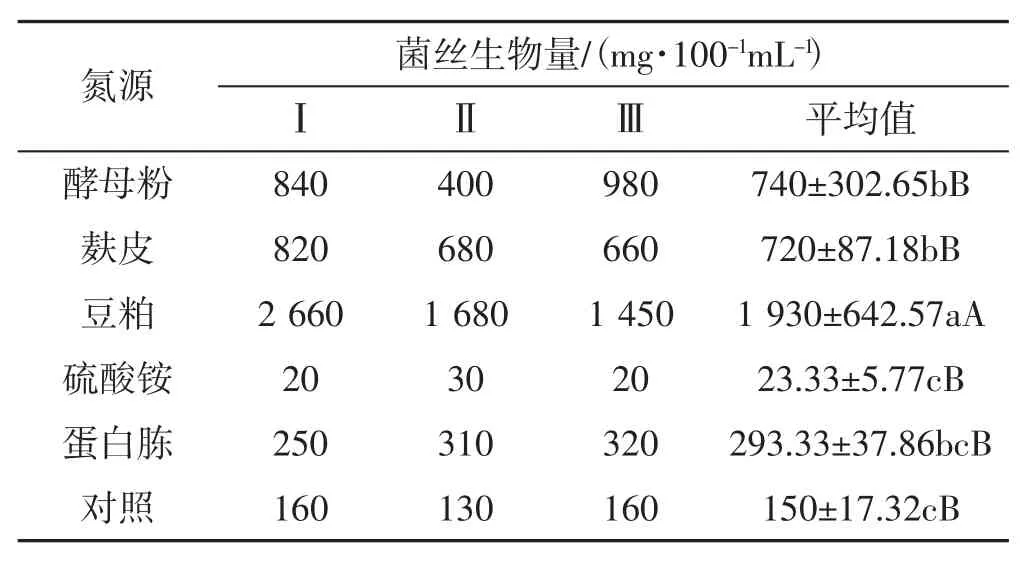
表2 不同氮源对黑木耳菌丝生物量的影响Tab.2 Effect of different nitrogen source on mycelial biomass of Auricularia heimuer
由表2可知,以豆粕为碳源的试验组黑木耳菌丝生物量最高,平均达到1 930 mg·100-1mL-1;其次是酵母粉、麸皮,菌丝生物量达740 mg·100-1mL-1、720 mg·100-1mL-1;几种氮源对黑木耳菌丝生物量影响的排序依次为豆粕>酵母粉>麸皮>蛋白胨>硫酸铵;其中只有硫酸铵效果较差,低于对照。
2.3 无机盐配比对黑木耳菌丝生物量的影响
不同无机盐配比对黑木耳菌丝生物量的影响结果见表3。

表3 不同无机盐添加量及配比对黑木耳菌丝生物量的影响Tab.3 Effect of different addictive amount ratio of inorganic on mycelial biomass of Auricularia heimuer
由表3可以看出,磷酸二氢钾和硫酸镁比例为1∶1时,黑木耳菌丝生物量最高,平均达218.33 mg·100-1mL-1;其次是比例为 2∶1时;比例为 1∶2时,黑木耳菌丝生物量最低。
2.4 黑木耳液体菌种培养基配方优化正交试验
根据单因素试验结果,采用L9(34)设计,选用最佳碳源、最佳氮源、硫酸镁和磷酸二氢钾为因子,进行L9(34)正交试验,正交试验因素水平见表4,优化结果见表5。
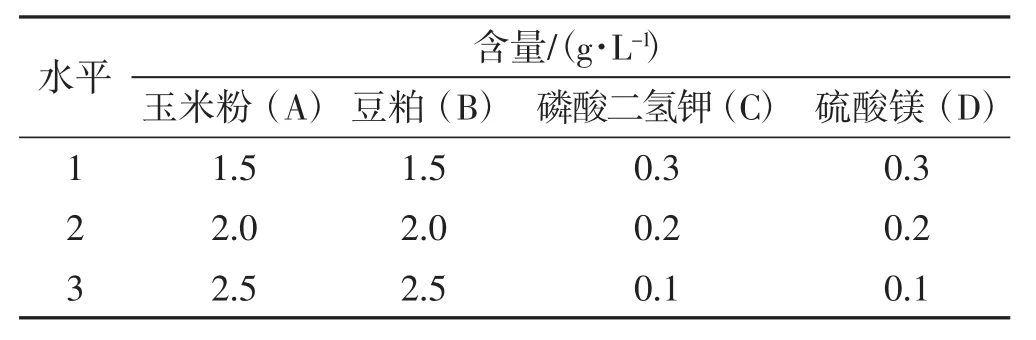
表4 正交试验因素和水平Tab.4 Factors and levels of orthogonal experiment
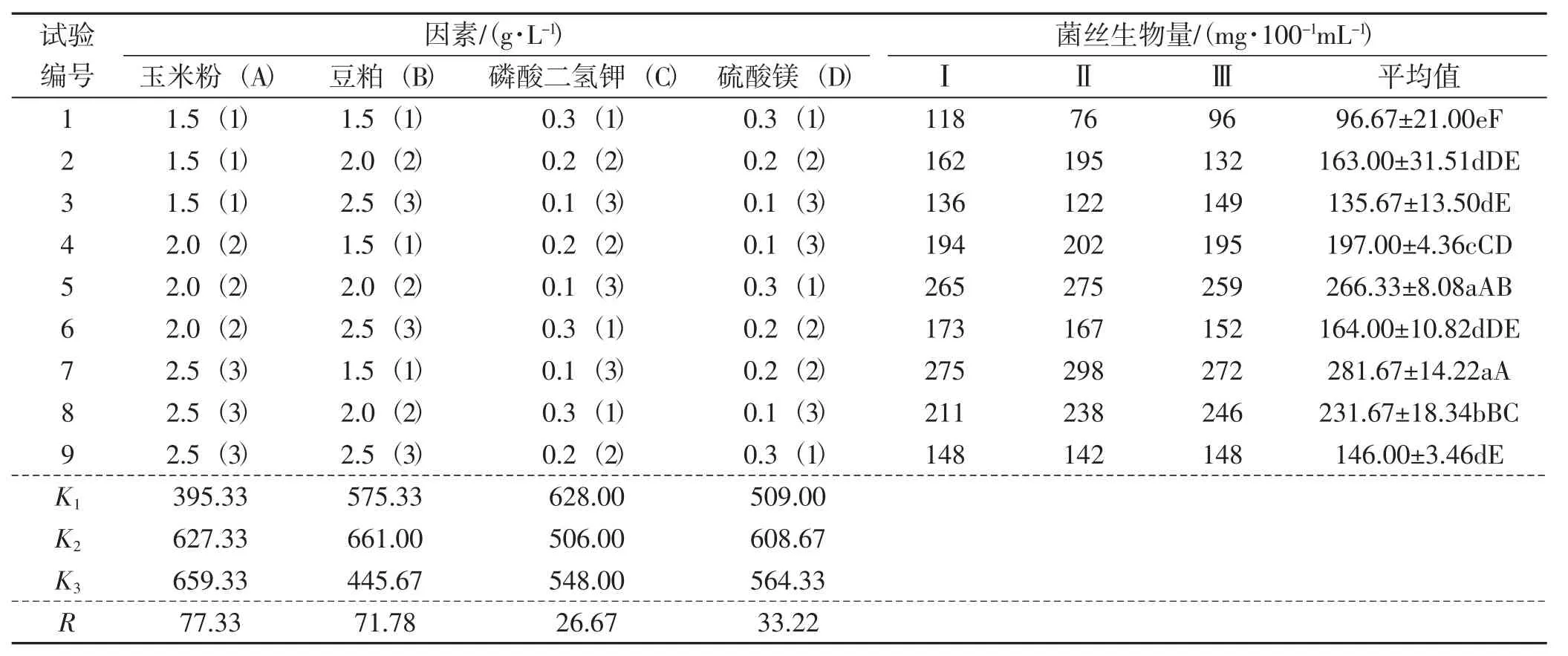
表5 L9(34)正交试验结果Tab.5 Rusult of orthogonal test
由表5可知,在4个单因子之间,对黑木耳菌丝生物量的影响排序依次为A>B>D>C;玉米粉影响最大,其次是豆粕、硫酸镁,磷酸二氢钾影响最小。从正交试验结果可以看出各因素水平的较理想培养基配方为A3B2C1D2。培养6天后菌丝生物量达296.28 mg·100-1mL-1,结果较理想。
2.5 摇床培养温度试验
摇床培养温度试验结果见表6。
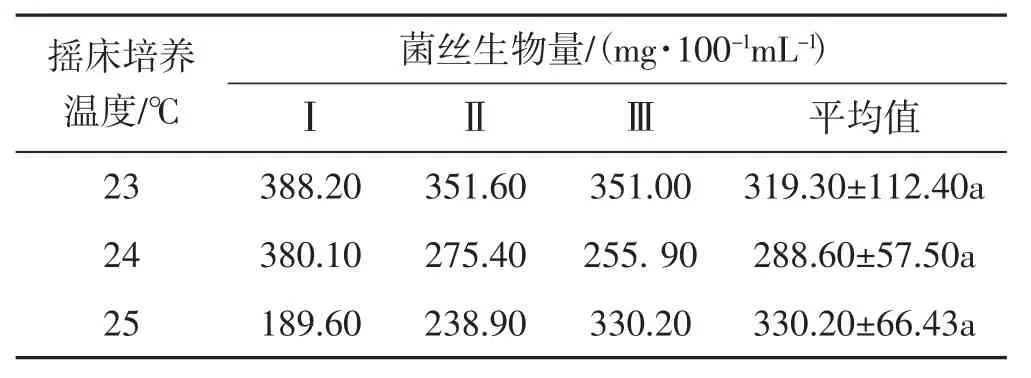
表6 摇床培养温度试验Tab.6 Temperature test of shake cultivation
由表6可知,25℃摇床培养时,黑木耳菌丝生物量最大,为330.2 mg·100-1mL-1;其次是23℃摇床培养时,黑木耳菌丝生物量达319.30 mg·100-1mL-1;24℃摇床培养时,黑木耳菌丝生物量最小,为288.60 mg·100-1mL-1;各温度对黑木耳菌丝体生物量影响排序依次25℃>23℃>24℃;但试验所设温度对摇瓶黑木耳菌丝生物量影响不大,无显著差异。
2.6 摇床培养天数试验
摇床培养天数试验结果见表7。
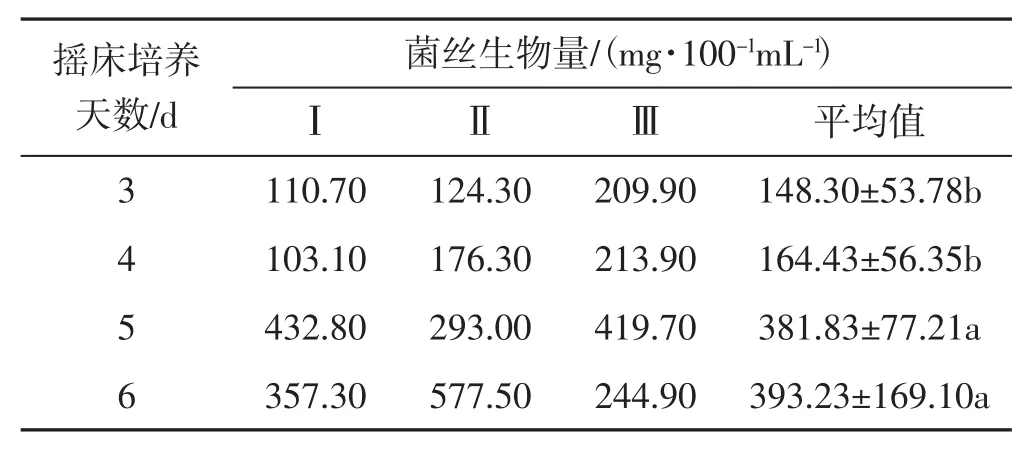
表7 摇床培养天数试验Tab.7 Test of shake cultivation for different days
由表7可知,摇床培养黑木耳液体菌种,培养6 d菌丝生物量最高,平均达393.23 mg·100-1mL-1;其次是培养5 d和4 d;培养3 d,黑木耳菌丝生物量最低,平均为148.30 mg·100-1mL-1。培养天数对黑木耳菌丝生物量影响排序依次为6 d>5 d>4 d>3 d;其中培养3 d和4 d黑木耳的菌丝生物量差异不显著;培养5 d和6 d黑木耳菌丝生物量差异不显著;培养3 d、4 d与培养5 d、6 d间黑木耳菌丝生物量差异显著。摇床培养5 d和6 d对黑木耳菌丝生物量影响较大。
2.7 摇床转速试验
摇床转速试验结果见表8。

表8 摇床转速试验Tab.8 Rotating speed of shaking table
由表8可以看出,在3个摇床转速处理中,对黑木耳菌丝生物量的影响排序依次为160 r·min-1>150 r·min-1>140 r·min-1;其中,160 r·min-1影响最大,黑木耳菌丝生物量达350.73 mg·100-1mL-1;其次是 150 r·min-1;140 r·min-1影响最小,菌丝生物量达287.70 mg·100-1mL-1。在设置的3个转速处理试验中,转速对黑木耳菌丝生物量的影响不大,无显著差异。
3 小结
从试验结果中可以看出碳源是影响黑木耳液体菌种菌丝生物量的重要因素。不同碳源对黑木耳液体菌种菌丝生物量影响程度不同,其中多糖>双糖>单糖。黑木耳液体菌种制作较适宜的碳源为玉米粉。
氮源为食用菌细胞生长必不可少的营养,可促进蛋白质和核酸的合成[7]。试验结果显示,不同氮源对黑木耳液体菌种菌丝生物量影响程度不同,其中有机氮>无机氮。黑木耳液体菌种制作较适宜的氮源为豆粕、酵母粉和麸皮。
硫酸镁是食用菌合成氨基酸过程中重要的酶激活剂;磷酸盐在培养基中起到缓冲作用;磷是蛋白质、核酸和细胞膜的重要组成部分[8]。因此不同无机盐比例对黑木耳液体菌种菌丝生物量影响不同,磷磷酸二氧钾与硫酸镁的比例为1∶1时,试验结果较理想。
不同碳源、氮源、无机盐比例,直接影响着黑木耳液体菌种的菌丝生物量。试验结果显示,玉米粉对黑木耳液体菌种菌丝生物量影响最大;其次是豆粕、硫酸镁;磷酸二氢钾影响最小。正交试验结果显示适宜的培养基配比为:玉米粉2.5 g·L-1、豆粕2.0 g·L-1、硫酸镁 0.2 g·L-1、磷酸二氢钾 0.3 g·L-1。
培养条件是黑木耳液体菌种制作的关键,不同培养条件对黑木耳菌丝生物量的影响不同。培养温度25℃时对黑木耳液体菌种菌丝生物量影响最大,但各温度试验处理对黑木耳菌丝生物量影响差异不显著;培养5 d和6 d的黑木耳液体菌种菌丝生物量和培养3 d和4 d的黑木耳液体菌种菌丝生物量差异显著,较理想的培养天数为5 d~6 d;摇床培养转速160 r·min-1时,黑木耳液体菌种菌丝生物量最大,但试验设置的3个转速处理对黑木耳液体菌种菌丝生物量影响差异不显著。
液体菌种具有生产周期短、菌龄一致[9]、菌种纯度高、省工、生产成本低等优点,大大提升了黑木耳生产效益,故黑木耳液体菌种生产技术越来越受欢迎,试验对黑木耳液体菌种培养基配方及培养条件进行优化试验,但培养条件对菌丝生物学活性的影响机制还有待进一步研究。
