随机对照临床试验CONSORT声明解读
2022-04-04王瑞平李斌
王瑞平 李斌


摘 要 隨机对照试验(randomized controlled trial, RCT)是临床研究的重要组成部分,合理设计、良好实施并规范报道的RCT临床研究通常可以为疾病的干预和治疗提供最高等级的循证医学证据。为规范RCT临床研究的结果报告和学术发表,David Moher和Drummond Rennie于1996年起草了第1版随机对照试验报告统一标准(consolidated standards of reporting trials, CONSORT)声明,并分别于2001、2010年进行修订。本文就最新版的CONSORT声明,从题目和摘要、介绍、研究方法、随机化方案、结果、讨论和其他信息等7个部分25个条目进行详细解读,为医务人员今后开展临床研究设计和临床研究结果报告撰写提供参考。
关键词 随机对照试验 临床试验 CONSORT 结果规范报告
中图分类号:R19-0 文献标志码:C 文章编号:1006-1533(2022)05-0058-05
引用本文 王瑞平, 李斌. 随机对照临床试验CONSORT声明解读[J]. 上海医药, 2022, 43(5): 58-62.
基金项目:国家重点研发计划“中医药现代化研究”重点专项(2018YFC1705301);国家自然科学基金面上项目(82174383);上海申康医院发展中心管理研究项目(2020SKMR-32);上海市皮肤病医院引进人才科研基金(2021KYQD01);上海人才发展基金(2021073)
Interpretation of CONSORT statements on randomized controlled clinical trial
WANG Ruiping, LI Bin
(Clinical Research & Innovation Center, Shanghai Skin Disease Hospital, Shanghai 200443, China)
ABSTRACT Randomized controlled trial (RCT) are essential for clinical research, and RCT that are rationally designed, well-implemented and reported can usually provide the highest level of evidence-based medical evidence for disease interventions and treatments. In order to standardize the result reporting and academic publication of RCT clinical studies, the first edition of the Consolidated Standards of Reporting Trials (CONSORT) statement was drafted in 1996 by David Moher and Drummond Rennie and revised in 2001 and 2010, respectively. The latest version of the CONSORT statement was interpretated in detail from 7 sections and 25 items including title and abstract, introduction, methods, randomization, results, discussion, and other information so as to provide reference for medical staff to carry out the writing of result report on clinical research design and clinical research in the future.
KEy WORDS RCT; clinical trials; CONSORT; specification results reporting
为规范随机对照临床试验(randomized controlled clinical trial, RCT)的结果报告,降低RCT研究的偏倚,1996年David Moher和Drummond Rennie教授起草第1版随机对照试验报告统一标准(consolidated standards of reporting trials, CONSORT)声明,该声明在很大程度上规范了RCT研究结果发表,提高了研究论文的质量[1-2]。近年来,随着临床研究方法学的进展和临床研究实践经验的积累,CONSORT声明分别于2001年和2010年进行了修订,为进一步提升RCT研究报告的质量奠定了基础。目前,全球有超过400家学术期刊采纳了CONSORT声明,以此在论文评审过程中作为判断文章撰写是否规范、能否正式发表的重要参考依据[3-5]。本文就最新版CONSORT声明(2010版),从题目和摘要(title and abstracts)、介绍(introduction)、研究方法(methods)、随机化方案(randomization)、结果(results)、讨论(discussion)和其他信息(other information)等7个部分25个条目进行详细解读,以期为临床医务人员撰写规范的RCT研究结果提供参考。
1 CONSORT声明内容
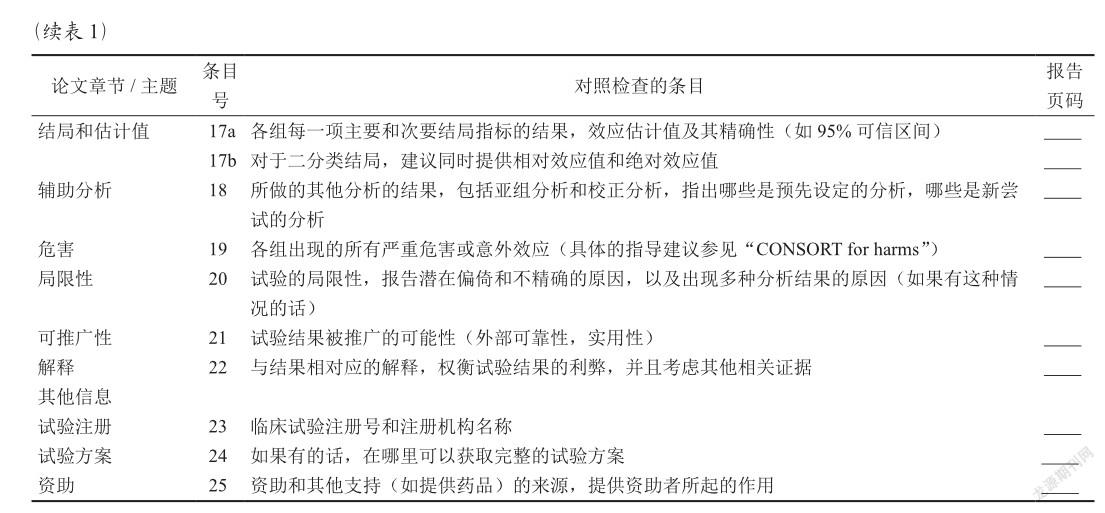
2010版CONSORT声明包括7个部分25个条目37个小项(表1),详细阐述了RCT临床研究结果报告时需要遵从的指导意见[6]。需要强调的是,CONSORT声明仅用于临床研究报告的规范性指导,并不对临床研究的设计、实施和统计分析进行推荐和评价,同时也不能作为评价临床试验质量的工具[7]。即研究者可以间接参考CONSORT声明中的内容细节,规范和完善RCT临床研究的设计和实施过程,但不能以此作为评价临床研究质量高低的参考工具,仅能作为RCT临床研究报告的规范性指导参考。gzslib202204041200

1.1 題目和摘要(title and abstract)
该部分包括1个条目2个小项(1a和1b)。其中1a是对RCT临床研究的题目进行限定,题目要使用“随机试验”字眼,便于判定研究的属性;1b是对RCT研究摘要的限定,作者应在文章摘要部分体现出“临床试验研究设计”“方法”“结果”和“结论”,这与常规结构式摘要的写法一致,但须体现出临床试验研究的设计特点。
1.2 背景介绍(introduction)
该部分包括1个条目2小项(2a和2b)。2a(background)要求作者详细阐述本研究立题的科学依据和该科学问题的合理性,包括研究的问题是什么,目前该科学问题的研究进展情况如何,是否存在未解决的问题等内容。2b(objectives)需要作者阐述本研究的科学假说,或者明确本研究的研究目标。
1.3 方法(methods)
该部分包括5个条目9小项(3a~7b)。3a和3b为“试验设计(trail design)”,3a要求作者描述清楚研究的设计类型(如同期平行对照、析因设计)及各组样本量的分配比例(如1∶1、2∶1等);3b要求作者阐述临床试验开始后对研究设计的重要修改(如研究对象的纳入标准),并给出修改的理由,如果研究者未对研究方案进行修改,3b可以写“无(NA)”。4a和4b为“受试者(participants)”,其中4a需要作者说明临床试验招募对象的合格标准(包括纳入标准、排除标准、退出标准等); 4b要求作者阐述并明确临床试验数据采集的环境和地点。5为“干预措施(interventions)”,作者需在该部分详细说明本临床试验中各个组别的干预措施(包括干预措施的定义、生产厂家、用法用量、干预频次和干预周期等),内容应详实全面,并保证其可重复性。6a和6b为“结果(outcomes)”,6a要求作者说明事先设定的主要疗效指标和次要疗效指标的确切定义,包括每一个指标的具体评估方法和时间节点;6b需要作者阐述临床试验开始后对研究评估指标任何修改,并给出修改的理由,如果研究者未修改则可以写“无(NA)”。7a和7b为“样本量(sample size)”,7a要求作者说明临床试验研究的样本量计算依据和方法;7b为备选项,如果临床试验方案设计了“期中分析”或“提前终止研究计划”,考虑到改变预期方案缩短了研究周期,多次分析方案也会导致Ⅰ类错误的损耗,因此需要对检验水准a进行调整,在样本量计算时需要进行说明。
1.4 随机化(randomization)
该部分包括5个条目9小项(8a~12b)。8a和8b为“随机数字生成(sequence generation)”,8a要求作者说明临床试验中用于随机化分组的随机数字的产生方法(如计算机产生、中央随机化系统等);8b要求阐述随机化方案类型(如简单随机化法、区组随机化法等),并描述限制性条件的具体细节(如区组的长度)。9是“分配隐藏方案(allocation concealment mechanism)”,研究者要阐述执行随机分配方案的具体细节,说明如何根据随机数字将受试者进行分组,以及在干预措施实施前保障随机化方案隐藏的具体方法(如黑色不透明信封)。10是“实施(implementation)”,作者要说明随机化分配数字生成的操作者,受试者招募的负责人,将受试者依据随机化方案被分配到不同干预组别的实施者。11a和11b是“盲法(blinding)”,11a要求研究者如果准备使用盲法,要阐述清楚设盲的具体对象(如受试者、干预实施者、研究结局评估者),并说明设盲的具体操作方案和内容;11b要求如果设盲,研究者应阐述清楚其保障不同干预组干预方案相似性以实现盲法的具体内容。12a和12b为“统计方法(statistical methods)”,12a要求研究者说明其比较不同组别主要疗效指标及次要疗效指标的统计分析方法(如t检验,χ2检验等);12b则要求研究者阐述其余数据的统计分析方法,包括亚组分析和影响因素调整分析(如logistic回归分析)。
1.5 结果(Results)
该部分包括7个条目10小项(13a~19)。13a和13b为“受试者流程(participant flow)”(图1),13a要求作者阐述不同组别的随机分配受试者人数,接受既定干预方案的人数和最后纳入主要疗效指标评估分析的人数;13b要求作者说明受试者随机分组后,不同组别对象脱落和排除的人数及原因。14a和14b为“招募(recruitment)”,14a要求作者阐述临床试验研究中受试者的招募期和随访期,须写清楚具体开始时间和结束时间。14b要求作者说明临床试验结束或终止的具体原因。15为“基线数据(baseline data)”,一般是结果部分的第一段内容,用表格的形式展示每一组受试者的基线人口学特征和临床表现。16为“统计分析数据(numbers analyzed)”,研究者须阐述每一个组别中纳入统计分析的受试者人数,并说明统计分析是否基于受试者的原始分组开展(intention to treat, ITT)。17a和17b为“结果和评估(outcomes and estimation)”,17a要求作者详细展示每个组别的主要疗效指标和次要疗效指标的分析结果,以及不同组别疗效比较的差异值大小[如风险比(risk ratio, RR)]和精度[如95%置信区间(confidence interval, CI)];17b推荐作者可以采用绝对值[率差(risk difference, RD)]和相对值[比值比(odds ratio, OR)]来反映二分类变量结局指标的疗效差异大小。18为“辅助分析(ancillary analyses)”,要求研究者对文中的亚组分析和影响因素调整分析等分析内容进行描述。19为“危害(harms)”,要求研究者阐述每个组中干预措施对受试者的危害或发生的超预期效应(包括不良事件、不良反应、严重不良反应等)。gzslib202204041200
1.6 讨论(discussion)
该部分包括3个条目3小项(20~22)。20为“局限性(limitations)”,要求研究者阐述临床试验研究存在的局限性,潜在混杂因素和影响研究结果准确性的解决方案,以及多重比较统计分析的局限性等问题。21为“外推性(generalisability)”,要求研究者阐述临床试验结果的可推广性,包括外部有效性和适用性。22为“解读(interpretation)”,则要求研究者根据主要研究结论,平衡干预措施的获益和风险,同时考虑其他相关研究证据,对研究结果做出合理的解读。
1.7 其他信息(other information)
該部分包括3个条目3小项(23~25)。23为“注册登记(registration)”,研究者须在文章中清楚描述本临床试验研究的注册登记号和注册登记的名称。24为“研究方案(protocol)”,研究者须阐述本临床试验的研究方案是否已发表,以及获取研究方案的方法。25为“经费支持(funding)”,研究者须在文章中描述本临床试验中经费与其他支持(如药物)的来源,经费提供方在本研究中的角色,及其是否存在利益冲突等情况。
2 CONSORT声明的应用
本文所解读的CONSORT声明(2010版)是最新版本,其主要目的是帮助临床试验研究者规范地撰写研究报告,同时也为杂志编辑和同行评议者判断临床试验研究文章撰写是否规范的重要参考[6]。CONSORT声明(2010版)以两组平行随机对照研究设计为例,对临床试验研究文章和报告撰写时需要注意的25个条目37小项内容进行了项目阐述。声明中的内容适合于绝大多数类型的临床试验研究,对于个别特殊类型的临床试验研究(如单臂设计临床研究),研究者、杂志社编辑和读者可以登录CONSORT网站(http://www.consort-statement. org/)获取更多的扩展内容和信息。尽管CONSORT声明的主要目的是用于指导临床研究报告和论文的规范性撰写,但研究者仍可以参考声明中的细节内容,特别是方法学和随机化方案部分,规范和完善RCT临床研究的设计和过程实施。最后,再次强调CONSORT声明仅作为RCT临床研究报告撰写的规范性指导参考,不能作为评价临床研究质量的工具。
参考文献
[1] Jüni P, Altman DG, Egger M. Systematic reviews in health care: assessing the quality of controlled clinical trials[J]. BMJ, 2001, 323(7303): 42-46.
[2] Begg C, Cho M, Eastwood S, et al. Improving the quality of reporting of randomized controlled trials. The CONSORT statement[J]. JAMA, 1996, 276(8): 637-639.
[3] Chan AW, Altman DG. Epidemiology and reporting of randomised trials published in PubMed journals[J]. Lancet, 2005, 365(9465): 1159-1162.
[4] Plint AC, Moher D, Morrison A, et al. Does the CONSORT checklist improve the quality of reports of randomised controlled trials? A systematic review[J]. Med J Aust, 2006, 185(5): 263-267.
[5] Moher D, Schulz KF, Altman DG. The CONSORT statement: revised recommendations for improving the quality of reports of parallel-group randomised trials[J]. Lancet, 2001, 357(9263): 1191-1194.
[6] Schulz KF, Altman DG, Moher D, et al. CONSORT 2010 statement: updated guidelines for reporting parallel group randomised trials[J]. BMJ, 2010, 340(3): 698-702.
[7] Moher D, Hopewell S, Schulz KF, et al. CONSORT 2010 Explanation and Elaboration: updated guidelines for reporting parallel group randomised trials[J]. BMJ, 2010, 340: c869.
