猕猴桃中桔青霉素的残留量测定
2022-04-02饶燕娜关文碧
饶燕娜,关文碧
(肇庆学院 食品与制药工程学院,广东 肇庆 526061)
猕猴桃是世界新兴水果之一,主产地包括新西兰、中国、意大利等国[1].猕猴桃果实酸甜宜人,营养丰富,维生素C含量高,深受消费者喜爱.2006~2016年,我国猕猴桃种植面积增长了3 倍,产量增长了4.5 倍.目前,我国猕猴桃种植面积和产量位居世界第一[2].猕猴桃属于浆果类水果,皮薄汁多,在采后贮藏过程中极易受到真菌侵染而导致果实腐烂.段爱莉等[3]从陕西省猕猴桃贮藏期霉烂果实中分离出30 株病原菌,主要为青霉属、木霉属、交链孢霉属、毛霉属和拟青霉属,其中青霉属为优势菌.Wang等报道,扩展青霉可引起软枣猕猴桃腐烂病,低温贮藏中的发病果实水渍状软化,病斑由淡黄色变至浅棕色,病斑处有大量青绿色孢子[4].
侵染水果的青霉属菌可产生大量的次级代谢毒素,受意大利青霉和橘青霉侵染的柑橘病斑部位桔青霉素(CIT)的含量可高达276 mg/kg[5-6].CIT(化学结构式见图1)对动物的细胞组织有很强的毒性作用,并具有潜在的致癌性和诱变性[7].2017年10月27日,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,CIT在3类致癌物清单中.根据已报道的文献资料,CIT在苹果汁、番茄汁和樱桃汁中均有检出,最大浓度为13 mg/L[8].而我国目前并没有建立水果中CIT 的残留限量标准,且猕猴桃中CIT的残留分析方法尚未见报道.

图1 CIT的化学结构式
实验采用新型纳米材料MWCNTs、硅胶键合十八烷基(silica bonded octadecyl,C18)和硅胶键合乙二胺基-N-丙基(silica bonded primary secondary amine,PSA)的混合物作为分散固相净化剂,基于改进的QuECh-ERS(quick,easy,cheap,effective,rugged and safe)方法对猕猴桃中CIT进行提取净化,结合HPLC-MS/MS技术测定其CIT残留量.
1 材料与方法
1.1 仪器设备
GZ-P01全营养破壁料理机(佛山市三加一电器有限公司),赛多利斯BSA124S-CW电子天平(赛多利斯科学仪器北京有限公司),JJ500型电子天平(常熟市双杰测试仪器厂),新芝SB-5200DT超声波清洗机(宁波新芝生物科技股份有限公司),TDL-5000bR低速冷冻离心机(上海安亭科学仪器厂),CCA-20低温冷却水循环泵(巩义市予华仪器有限责任公司),SHZ-D(Ⅲ)循环水真空泵(邦西仪器科技上海有限公司),N-1300 旋转蒸发仪(上海爱朗仪器有限公司),SB-1300水浴锅(上海爱朗仪器有限公司),湘仪H1650R冷冻高速离心机(湖南湘仪实验室仪器开发有限公司),MX-S涡旋混合器(大龙兴创实验仪器北京有限公司),液相色谱柱(Luna®Omega 1.6 μm PS C18,美国Phenomenex公司),液相色谱质谱联用仪(配置ESI电离源、四元梯度泵、高性能自动进样器)(Waters Xevo TQD,美国Waters公司).
CIT 标准品(纯度98%,北京百灵威科技有限公司),用色谱纯乙腈配制成100 mg/L 的标准储备液,置于-18℃冰箱中贮存备用.乙腈(分析纯,山东西亚化学工业有限公司),乙腈(色谱纯,德国默克股份两合公司),乙酸乙酯(分析纯,上海阿拉丁生化科技股份有限公司),氯化钠(分析纯,西陇科学股份有限公司),无水硫酸镁(分析纯,西陇科学股份有限公司),十八烷基键合硅胶(octadecyl silane,C18)(上海斯信生物科技有限公司),N-丙基乙二胺键合硅胶(primary secondary amino,PSA)(上海安谱实验科技股份有限公司),MWCNTs(纯度95%,南京先丰纳米材料科技有限公司).
1.3 样品前处理
将猕猴桃整个果实切块,匀浆备用.精确称取10 g猕猴桃果肉于50 mL具塞塑料离心管中,加入10 mL分析纯乙腈,拧紧管盖,涡旋2 min.再往离心管中加入3 g氯化钠,于25℃水浴中超声提取5 min,3 800 r/min离心5 min.精确称取150 mg C18、50 mg PSA 和5 mg MWCNTs 于2 mL 塑料离心管中,取1 mL 上清液于装有上述净化剂的2 mL 塑料离心管中,涡旋30 s,10 000 r/min 离心1 min.用1 mL 无菌注射器吸取净化液,过0.22 μm有机微孔滤膜,待测.
1.4 仪器条件
1.4.1 色谱条件
流动相:梯度洗脱程序见表1.流速:0.2 mL/min,柱温:25℃,进样量:5 μL.

表1 梯度洗脱程序
1.4.2 质谱条件
离子源:电喷雾离子源(Electrospray Ionization,ESI).扫描模式:负离子模式扫描.毛细管电压:2.20 kV.脱溶剂温度:500℃,脱溶剂气流量:700 L/h.多反应监测参数如下:母离子m/z249,锥孔电压56 V,3 个子离子分别为m/z130.8、m/z160.9、m/z176.9,子离子对应的碰撞能量分别为38 V、22 V、20 V.
2 结果与讨论
2.1 提取浓缩条件优化
2.1.1 提取剂的影响
猕猴桃皮薄多汁,水分含量高,加入乙腈提取后,提取液中含有大量的水分,影响后续的操作和定量分析,因此,必须进行乙腈和水的分离.传统的QuEChERs方法中加氯化钠和无水硫酸镁分离乙腈和水.本试验称取10.0 g猕猴桃样品于50 mL具塞离心管中,加入3 mL水和10 mL乙腈,涡旋2 min提取猕猴桃中CIT,然后加入1 g 氯化钠和4 g 无水硫酸镁,剧烈手摇后置于冰水中冷却,取上清液过0.22 μm 滤膜,进HPLC-MS/MS分析.通过添加回收试验评价无水硫酸镁的使用对提取效率的影响.试验结果表明,使用无水硫酸镁吸水后,CIT的添加回收率(fortified recoveries, FR)仅有67%,并不能满足真菌毒素分析的要求.分析原因,可能是无水硫酸镁吸水放热,造成热不稳定的CIT分解,因此,提取过程中无水硫酸镁不适合作为脱水剂,后续试验中只选用有助于乙腈和水分层的氯化钠.
2.1.2 浓缩操作的影响
浓缩是在不损失待测组分即CIT 的前提下,将大体积的溶液去除的过程.取0.1 mg/L 的CIT 标准溶液1 mL 于圆底烧瓶中,不加热旋蒸至近干,再用洗耳球吹干,用1 mL 色谱纯乙腈定容,定容液过0.22 μm 滤膜,进样分析.同时,将0.1 mg/L的未旋蒸处理的CIT标准溶液过膜进样.进样结果显示,未旋蒸处理的标液峰面积27 184,旋蒸处理的标液平均峰面积7 125,旋蒸操作导致CIT有将近70%的损失.CIT是热敏性化合物,基于减少待测组分损失考虑,猕猴桃中CIT的提取净化过程中不进行浓缩.
2.2 净化条件的优化
QuEChERS方法中的传统净化剂主要有C18、PSA和石墨化碳黑(graphitized carbon blacks,GCB)[9].C18对非极性物质有较强的保留[10].PSA起极性吸附作用,可与金属离子螯合,用于除去有机酸、色素、糖类、金属离子和酚类物质.GCB能有效吸附色素.MWCNTs是1种比表面积非常大的新型纳米材料,可从样品中吸附不同物质[11].考虑到猕猴桃水分、有机酸、色素、维生素含量多,样品中基质复杂,GCB的比表面积小,对各类物质的吸附能力较弱,因此,试验中选择C18、PSA和MWCNTs 作为净化剂.
在用C18、PSA、MWCNTs 净化猕猴桃的乙腈提取液时,需要考虑2 项指标:FR 和基质标准溶液峰面积(peak area of matrix solutions,PAMS),2项指标都是越高越好,而这3种净化剂的用量组合对这2个指标起着重要作用,根据前期探索性试验,决定对每种净化剂,即每种因素选取3个水平进行正交试验,以得到较好的净化条件,试验因素和各水平如表2所示.
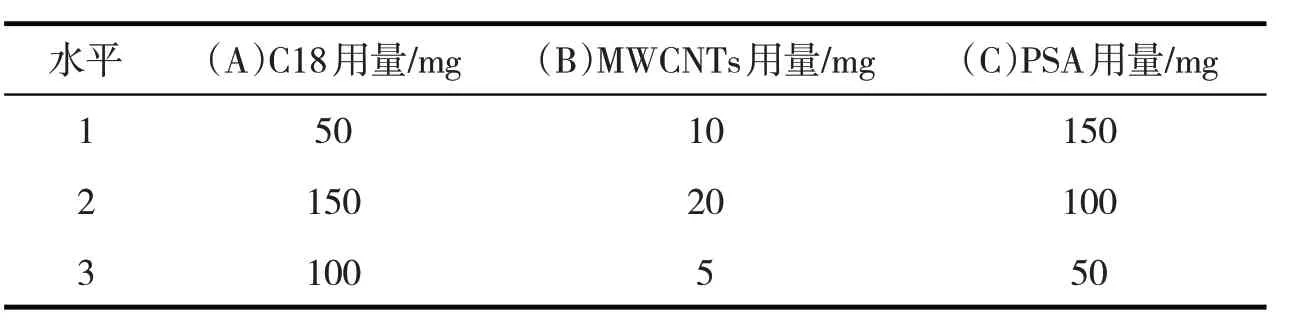
表2 因素水平表
依据QuEChERs 样品前处理方法,按正交表L9(34)对应试验号的净化剂用量进行净化,并进HPLC-MS/MS 分析,得到结果如表3 所示.对试验结果进行单指标直观分析,得到每个试验指标的因素主次顺序和优方案如表4所示.

表3 试验方案和试验结果
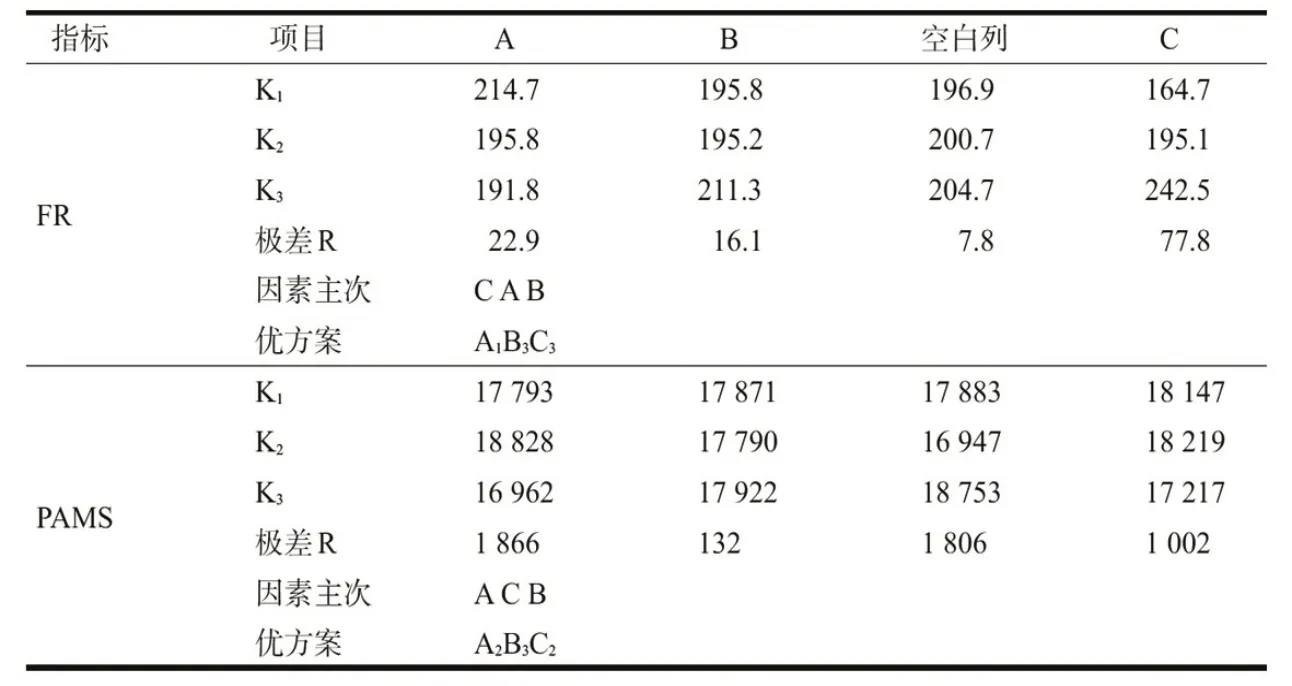
表4 试验结果分析
由表5以及趋势图2和图3可以看出,对于FR 和PAMS 这2 个指标而言,不同因素的影响程度是不一样的,且不同指标对应的优方案也是不同的,需通过综合平衡法找到最优方案,即最优净化剂用量,具体平衡过程如下.
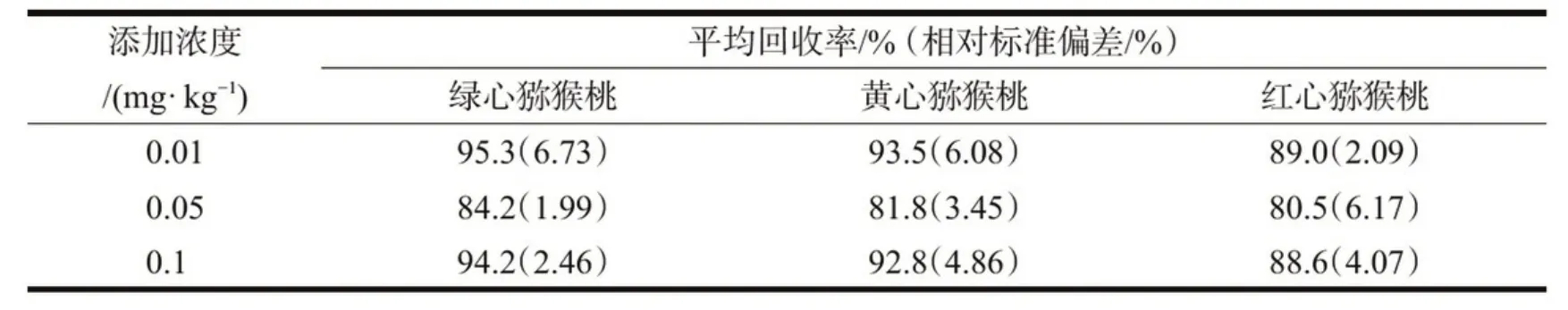
表5 猕猴桃中CIT的平均添加回收率和相对标准偏差(n=5)

图2 不同净化剂用量下添加回收率趋势图

图3 不同净化剂用量PAMS趋势图
因素A:对于PAMS,A 因素是最主要影响因素,且K2>K1>K3,在确定优水平时应该重点考虑,PAMS越大越好,则K值越大越好,故优先选取A2,即150 mgC18;对于FR,A 因素是较次要因素,由趋势图可看出,50 mgC18 和150 mgC18 之间的FR相差约7%,在可接受的范围内,综合考虑最终选择150 mgC18.
因素B:对于FR 和PAMS,B 因素都是处于末位的次要因素,B 取哪一个水平对2 个指标的影响都比较小,而且对于2 个指标而言,K3>K1>K2,故选取B3,即5 mg MWCNTs.
因素C:对于FR,C因素是最主要影响因素,由趋势图可看出,PSA用量对回收率影响极大,几乎呈负相关关系,确定优水平时应重点考虑.由于FR越大越好,则K值越大越好,经计算得K3>K2>K1,故优先选择C3,即50 mgPSA.对于PAMS 而言,C因素是较次要因素,优先选择的50 mgPSA,对PAMS 影响较小,出于成本考虑,最终选择50 mg PSA.
经正交试验优化净化剂用量后,确定净化剂为150 mgC18、50 mgPSA、5 mgMWCNTs.由于该净化剂组合未出现在正交试验方案中,需再进行一次验证实验.以新鲜绿心猕猴桃为样品,经乙腈提取,用所得最优方案净化进行添加回收实验,基质标准溶液峰面积与溶剂标准溶液峰面积相差400,在可接受范围内,平均回收率94.2%,而且在实验过程中,能明显观察到色素的去除效果良好,证明所得最优方案净化效果良好.
2.3 方法学验证
2.3.1 标准曲线、线性范围、相关系数
基于已优化的提取净化条件,制备空白猕猴桃(绿心、黄心、红心猕猴桃)的提取液,并配制CIT 浓度为0.001、0.002、0.005、0.01、0.02、0.05、0.1、0.2 mg/L 的猕猴桃基质标准溶液,经HPLC-MS/MS 测定,以CIT 猕猴桃基质标准浓度为横坐标,峰面积为纵坐标做标准曲线.试验结果表明,CIT在0.001~0.2 mg/L范围内线性良好,相关系数R2均大于0.999.
2.3.2 基质效应
基质效应(Matrix Effect,ME)是指基质成分和目标化合物在进行离子化时相互竞争而导致目标化合物信号强度有不同程度的增强或减弱的现象[12],通常以基质标准曲线斜率与溶剂标准曲线斜率的比值来进行评价[13].当ME<0.9时,表现为明显减弱的基质效应;当ME>1.1时,表现为明显增强的基质效应;当0.9≤ME≤1.1 时,表现为无显著基质效应[14].经过计算,绿心猕猴桃、黄心猕猴桃和红心猕猴桃的ME 值为1.01、1.04 和0.77.绿心和黄心猕猴桃无显著的基质效应,红心猕猴桃存在明显减弱的基质效应,为了能更准确地测定目标化合物,并且保证试验对的平行性,本试验采用基质标准曲线对3 个品种的猕猴桃进行定量分析.
2.3.3 添加回收实验、精密度
在真菌毒素残留分析中,常采用FR表示方法的准确度.采用相对标准偏差(relative standard deviations,RSDs)表示方法的精密度.本实验采用新鲜绿心、黄心、红心猕猴桃作为样品,往空白猕猴桃基质中添加CIT标准溶液,设低、中、高3个添加浓度(0.01、0.05、0.1 mg/kg),每个浓度进行5次重复试验,按上述方法进行提取、净化并测定,所得FR为80.5%~95.3%,RSDs为1.99%~6.73%,FR与RSDs均符合NY/T788-2018标准[15].
2.3.4 最低检测限、定量限
在空白猕猴桃样品中添加CIT,进HPLC-MS/MS 分析,测定出信噪比为3时浓度为最低检测限,信噪比为10时浓度为定量限[16].经添加回收试验验证,本方法最低检测限为0.005 mg/L,定量限为0.01 mg/L.
3 结论
本试验采用新型碳纳米材料MWCNTs 作为分散固相净化剂,基于改进的QuEChERS 方法,通过优化提取浓缩条件、净化剂用量,建立了HPLC-MS/MS法测定绿心、黄心、红心猕猴桃中CIT残留量的方法,该分析方法在CIT浓度为0.001~0.02 mg/L范围内线性关系良好,在添加浓度为0.01、0.05、0.1 mg/kg 时,FR为80.5%~95.3%,RSDs为1.99%~6.73%.方法的最低检测限为0.005 mg/L,定量限为0.01 mg/kg,可用于猕猴桃中痕量CIT的分析检测.
