经肛门内镜微创手术治疗T1或T2期直肠癌疗效的系统评价
2022-04-02郑冠鹏刘天佑
郑冠鹏 刘天佑
哈尔滨医科大学附属第一医院群力院区普外一科,黑龙江 哈尔滨 150001
结直肠癌的发病率在全球排在第三位[1],全直肠系膜切除术(total mesorectal excision,TME)是治疗直肠癌的金标准,但手术创伤较大,存在术后永久性造瘘以及围手术期并发症发生率、死亡率高等问题,会显著降低术后的生活质量,对于低位的直肠癌选择局部切除能够降低围手术期病死率和并发症发生率[2-4],但局部切除不能对淋巴结进行清扫,对于T3 和T4 期的患者,淋巴结转移风险较高,局部切除往往是不可行的。T1 和T2 期肿瘤淋巴结转移风险较低,可进行局部切除,但术前对淋巴结情况的评估准确性有限,局部切除T1、T2期直肠肿瘤仍然存在一定的局限性。对于早期直肠癌局部切除的方式有经肛门内镜微创手术、内镜黏膜下剥离术、内镜黏膜切除术以及传统的经肛门局部切除术等[5-7]。与其他局部切除术相比,TEM 能够全层的切除病变部位,切缘更加完整,术后复发率较低,为局部切除首选的方法。由于TEM 治疗早期直肠癌的疗效存在争议,我们对TEM 和RS 治疗T1 和T2 期直肠癌疗效进行了Meta分析。
1 资料与方法
1.1 资料检索
通过计算机检索Pubmed、Cochrane Library、Embase、Web of science、知网、万方等数据库,搜索的时间限定为从建库到2021 年8 月。英文检索词为total mesorectal excision、anterior resection、total mesorectal、anterior resection、redical surgery、redical resection、transanal endoscopic microsurgery、reactal cancer 等。中文检索词主要为直肠癌、全结肠系膜切除术、经肛门内镜微创手术。
1.2 纳入和排除标准
纳入标准:(1)经病理学和内镜证实为T1和T2期直肠癌;(2)涉及TEM与RS之间的比较;(3)文章中至少存在手术时间、出血量、围手术期死亡率、术后并发症、肿瘤的复发率和生存率等感兴趣数据中的一种。排除标准:(1)来自同一中心重复的实验数据;(2)缺乏感兴趣的数据或无法提取感兴趣的数据;(3)文献为动物模型。
1.3 文献的筛选与数据的提取
两位研究者独立的进行文献的筛选与数据的提取,在意见不统一时协商解决。收集的数据主要包括:(1)纳入文献的人口统计学资料(第一作者、出版年份、研究设计类型、患者数量、肿瘤的T 分期);(2)手术安全性资料(手术时间、输血量、围手术期死亡数、术后并发症发生率);(3)肿瘤学资料(切缘阳性率、肿瘤局部复发率、总体复发率、生存率)。
1.4 文献的质量评价
由两名研究者独立进行文献质量的评价,分别采用Nwecastle-Ottawa(NOS)量表和Jadad 量表对非随机对照试验和随机对照试验进行质量评价。NOS评分≥6 分或Jadad ≥3 分的研究认为是高质量的文献。
1.5 统计学分析
使用Cochrane Collaboration 提供的软件Revman 5.2 进行Meta 分析,连续性变量采用加权均数差(WMD)、二分类变量采用相对危险度(RR)作为效应量,均以95%置信区间(95%CI)给出。对于有的文献手术安全性资料只报告了中位数和极差,我们估算了均值和标准差[8-9]。使用卡方(χ2)检验来分析纳入文献的异质性。若异质性<50%表明异质性低,采用随机效应模型。异质性≥50%表明存在明显异质性,采用固定效应模型,必要时使用敏感性分析来检测结果的稳定性。
2 结果
2.1 文献筛选的结果
计算机检索数据库得到347篇文献,阅读题目和摘要后,去除重复文献、文献综述、不相关文献后获得196篇文献,阅读全文后,最终纳入14篇文献(图1)。

图1 文献筛选的流程
2.2 纳入文献的基本特征及质量评价
共纳入文献14 篇,全部为英文文献,研究的样本量共3 680 例,TEM 组621 例,RS 组3 059 例。纳入文献的基本特征和质量评价见表1。
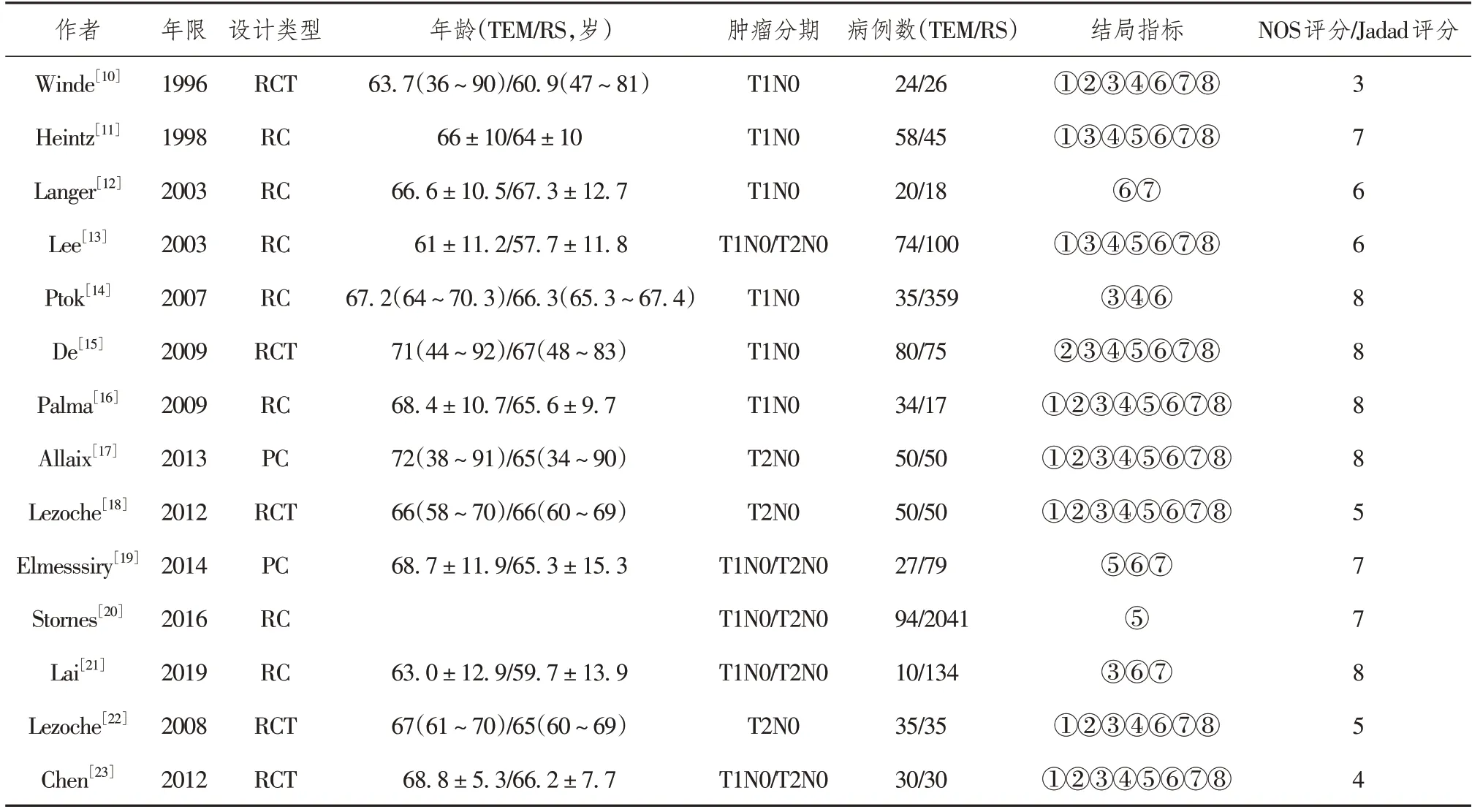
表1 纳入文献的基本特征和质量评价
2.3 Meta分析结果
2.3.1 手术时间 6 篇文献[15-18,22-23]报道了手术时间,异质性较大(I2=93%),采用随机效应模型。Meta 分析结果显示两组差异有统计学意义[WMD=-96.94,95%CI(-115.79~ -78.1),P<0.001],TEM组手术时间短于RS组,分别对纳入文献进行敏感性分析,异质性变化不明显(图2)。

图2 TEM组与RS组手术时间的Meta分析
2.3.2 出血 量 7 篇文献[10,15-18,22-23]报道了出血量,异质性较大(I2=99%),采用随机效应模型。Meta 分析结果显示两组差异有统计学意义[WMD=-304.64,95%CI(-446.85~ -162.42),P<0.001],TEM 组出血量小于RS 组,分别对纳入文献进行敏感性分析,异质性变化不明显(图3)。
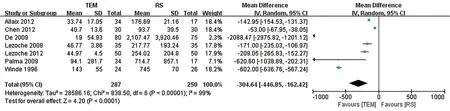
图3 TEM组与RS组出血量的Meta分析
2.3.3 围手术期病死率 11 篇文献[10-11,13-18,21-23]报道了围手术期病死率,异质性好(I2=10%),采用固定效应模型。Meta 分析结果显示两组差异无统计学意义[RR=0.25,95%CI(0.06~ 0.99),P=0.05],TEM 组与RS 组围手术期死亡率差异无统计学意义(图4)。

图4 TEM组与RS组围手术期病死率的Meta分析
2.3.4 术后 并发症10篇文献[10-11,13-18,22-23]报道了术后并发症,异质性较大(I2=70%),采用随机效应模型。Meta 分析结果显示两组差异有统计学意义[RR=0.22,95%CI(0.16~ 0.30),P<0.001],TEM 组与RS 组相比术后并发症更低。分别对纳入文献进行敏感性分析,异质性变化不明显(图5)。

图5 TEM组与RS组术后并发症的Meta分析
2.3.5 切缘阳性率 10篇文献[11,13-20,23]报道了切缘阳性率,异质性好(I2=0%),采用固定效应模型。Meta 分析结果显示两组差异有统计学意义[RR=7.39,95%CI(3.75~14.57),P<0.001],TEM 组与RS组相比切缘阳性率更高(图6)。

图6 TEM组与RS组切缘阳性率的Meta分析
2.3.6 局部复发率 12 篇文献[10-13,15-19,21-23]报道了局部复发率,异质性好(I2=0%),采用固定效应模型。Meta 分析结果显示两组差异有统计学意义[RR=2.54,95%CI(1.60~4.02),P<0.001],TEM组与RS组相比局部复发率更高(图7)。

图7 TEM组与RS组局部复发率的Meta分析
2.3.7 总体复发率 12 篇文献[10-13,15-19,21-23]报道了总体复发率,异质性好(I2=0%),采用固定效应模型。Meta 分析结果显示两组差异有统计学意义[RR=1.62,95%CI(1.11~ 2.35),P=0.01],TEM组与RS组相比总体复发率更高(图8)。
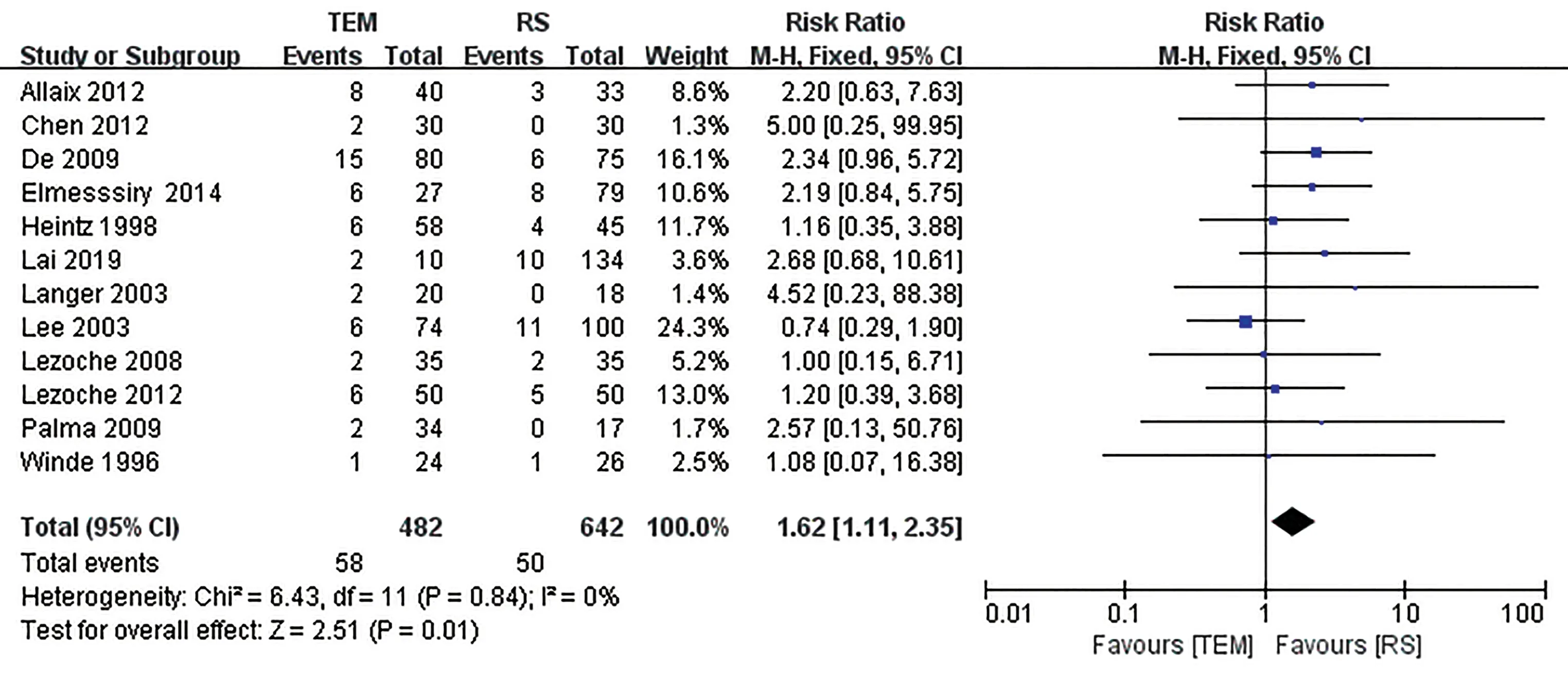
图8 TEM与RS组总体复发率的Meta分析
2.3.8 生存率 8 篇文献[10-11,13,15-16,18,22-23]报道了总体复发率,异质性好(I2=0%),采用固定效应模型。Meta 分析结果显示两组差异有统计学意义[RR=1.00,95%CI(0.95~1.05),P=0.92],TEM组与RS组相比生存率相差不大(图9)。

图9 TEM与RS组生存率的Meta分析
2.4 发表偏倚
以总体复发率作为结局指标绘制漏斗图,结果提示存在一定的发表偏倚(图10)。

图10 发表偏倚漏斗图
3 讨论
根据Meta分析结果显示,在治疗早期直肠癌手术安全性方面,TEM手术时间,术中出血量,术后并发症发生率低于RS;在肿瘤学方面,TEM 切缘阳性率、局部复发率和总体复发率高于RS。围手术期病死率、生存率TEM与RS相差不大。
随着内镜技术的发展和对结肠镜接受程度的提高,早期直肠癌的检出率逐年上升,低危组的T1期直肠癌可选择局部进行切除,高危组的T1直肠癌和T2 期直肠癌接受全直肠系膜切除术仍是其金标准[24]。术前通过结肠镜、盆腔核磁、直肠内超声对低风险T1期、高风险的T1期、T2期直肠癌进行临床区分准确性较低[25-26],局部切除可作为一种诊断以及治疗的方式,术后病理回报为高风险的T1 期和T2 期直肠癌进行后续的根治性手术或者接受新辅助治疗[27-28]。
直肠癌局部复发和远处转移时会显著降低生存率。肿瘤局部复发的危险因素包括吻合口瘘、肿瘤切缘不完整、术中肿瘤穿孔、术后病理回报恶性度高以及缺乏后续的辅助治疗。直肠癌局部复发时会出现相应的症状,如直肠出血、腹部疼痛、排便习惯的改变、肠梗阻等[29-30]。文献显示未经治疗的复发性直肠癌的中位数生存时间为8 个月,复发后接受化疗增加生存年限的作用有限,5 年的生存率仍不足5%,进行根治性切除更适合局部复发的直肠癌患者[31-32]。
TEM 是局部切除常用的术式之一,与其他术式相比疗效显著。TEM 集腹腔镜技术、内镜技术、微创技术于一体,特殊的直肠镜镜头能够三维立体的显示直肠病变部位,对于直肠中上段和狭窄的直肠部位优势明显,但仍不能对淋巴结进行清扫,准确的评估术前淋巴结转移情况和明确肿瘤的T 分期对TEM 是否成功起着至关重要的作用。Sun 等[28]进行了一项包括152 例患者回顾性分析,根据手术方式的不同分为局部切除组(n=28)和根治性手术组(n=124),根治性手术组中术前诊断T2 及T2 以下无淋巴结转移的病例数为93 例,结果显示超过一半的病人T 分期过高,43 例(46.2%)进行了没有必要的根治性切除,并且根治性手术组和局部切除组的三年生存率没有差异。
本研究纳入的12 篇文献[10-13,15-19,21-23]涉及局部复发率,局部复发率在1%~20%之间。Meta 分析结果显示,与RS 组相比TEM 组术后复发率增加,但没有对长期的生存率造成影响。TEM 术后复发率与RS 相比虽高,但及时行挽救性根治性手术的长期生存率与初次根治术手术的长期生存率相当[33],因此TEM 术后应严格的进行随访,出现影像学和肿瘤学复发的迹象且无重大的心脑肺疾病的情况下,应积极的进行根治性手术治疗。TEM 是否会增加后续进行TME 手术的难度尚存在争议。部分学者观点如下:(1)TEM 切除的病变部位与周围的组织形成粘连;(2)TEM 缝合缺损的直肠肠壁后导致直肠的强度降低。以上两点会使直肠肠壁和直肠周围脂肪受到纤维化瘢痕的影响,在分离直肠与系膜时造成直肠的撕裂[34]。Ortenzi 等[35]认为丰富的手术经验和先进的腹腔镜设备能够解决上述的问题,TEM 手术后行TME 是安全可行的。早期直肠癌术前行新辅助治疗,可缩小肿瘤体积、降低术后淋巴结转移的几率,从而降低术后的局部复发率,新辅助治疗之后获得临床缓解的病例,可选择观察和等待的策略,但文献显示临床缓解并不等于病理学上的缓解,因此也存在肿瘤治疗不充分的问题[36-37]。根据当前指南,对于cT1N0M0的直肠癌TEM 手术是安全的,cT2N0M0 直肠癌TME 手术仍是金标准,对于拒绝行根治性手术和具有严重并发症的患者新辅助治疗后行TEM 也是一种选择,但其安全性仍需要大量的前瞻性研究来证实。
本Meta 分析存在的局限性如下:(1)纳入文献多为回顾性研究,随机对照试验较少,存在一定的发表偏倚;(2)纳入研究的文献包括低危T1、高危T1、T2 期直肠癌患者,不同分期的资料对总体存活率与局部复发率会产生潜在的影响;(3)纳入文献术前诊断的方式不同;(4)部分文献术前进行了新辅助治疗,将使用新辅助治疗与不使用新辅助治疗的进行综合分析存在一定的异质性;(5)由于部分纳入文献未对T1与T2期数据分层进行统计,因此,未进行亚组分析。
综上所述,TEM 在治疗早期直肠癌手术安全性方面强于根治性手术,但局部复发率、总体复发率高于根治性手术,两种手术的生存率相当。当前的证据并不能证明TEM 在治疗早期直肠癌的疗效强于根治性手术,T1、T2 期直肠癌新辅助治疗后进行TEM 是未来局部切除发展的方向,也是外科微创手术中器官保留治疗理念的体现。
利益冲突所有作者均声明不存在利益冲突
