粪菌移植对不同溃疡性结肠炎小鼠的疗效及其中药性味研究
2022-04-02马晓飞胡家丽崔曼曼葛巍杨苏琴丁成华张磊昌
马晓飞,胡家丽,崔曼曼,葛巍,杨苏琴,丁成华,张磊昌*
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性免疫性疾病,隶属于炎症性肠病(inflammatory bowel disease,IBD)的范畴,是消化系统的常见病及疑难病[1-2],主要以腹痛、腹泻、黏液脓血便、里急后重等临床表现为主[3],反复发作是该疾病特点,多见于直肠和乙状结肠,青壮年为好发人群。UC的发病目前在全世界呈逐年上升的趋势,但UC的病因、发病机制尚不明确。现代医学认为与遗传、环境、心理等因素相关,进而导致肠黏膜屏障受损,神经内分泌功能失调和免疫失衡,从而引起肠黏膜局部溃疡而发病[4]。
UC目前还没有治愈的方法,基本治疗原则以控制症状为主,治疗药物包括氨基水杨酸制剂、糖皮质激素类、免疫抑制剂及生物制剂等[5-6]。常规药物不良反应较强,且病情容易反复,生物制剂价格昂贵,经济成本太高。近年来,粪菌移植(fecal microbiota transplantation,FMT)成为研究热门话题,其原理为将健康人粪便中的功能菌群,移植入患者胃肠道内,重建具有正常功能的肠道菌群,治疗肠道及肠道外某些疾病。该方法由来已久,2013年美国食品药品监督管理局将治疗难辨梭状芽孢杆菌感染写入指南,是对其安全性及有效性的认证,适应证得到进一步扩展[7-8]。多数学者虽已经证实FMT治疗UC疗效的可靠性,但仍有部分学者对FMT治疗UC的疗效提出质疑,说其总体有效率偏低。
针对FMT治疗UC疗效参差不齐的原因,笔者基于中医理论,发现金汁与FMT有异曲同工之效[9]。本研究基于此,以阳性药物5-氨基水杨酸(5-ASA)为实验对照,通过FMT治疗普通型溃疡性结肠炎模型(CUCM)与湿热型溃疡性结肠炎模型(DUCM),验证其疗效,通过治疗前后疾病活动指数、肠组织HE染色、肠组织透射电镜、血常规及菌群多样性分析等探究FMT(新金汁)的中药性味。
1 材料与方法
1.1 实验动物 雄性SPF级C57BL/6小鼠(4周龄):湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)2019-0004,平均体质量(18.0±1.2)g。本研究经江西中医药大学医学伦理审查委员会审批通过。
1.2 实验试剂与仪器 葡聚糖硫酸钠(DSS)(9011-18-1,上海源叶生物科技有限公司);5-ASA(货号:89-57-6,上海源叶生物科技有限公司);高脂高糖饲料(配方:糖15%、猪油10%、胆固醇4%、胆盐0.3%、蛋黄粉10%、基础饲料60.7%,南京盛民科研动物养殖场);便隐血(OB)试剂(B200101,珠海贝索生物);水合氯醛(119957,上海展云化工有限公司);异氟烷(S10010533,上海玉研科学仪器有限公司);干扰素 γ(IFN-γ)PE(505808,Biolegend);CD4 APCCY7(100460,Biolegend);白介素(IL)-4 PE(504104,Biolegend);小鼠IL-2试剂盒(MM-0701M1);小鼠IL-4试剂盒(MM-0165M1);苏木素染液(ZLI-9610,北京中杉金桥生物技术有限公司);伊红染色液(G1100,Solarbio);超净高级封片胶(YZB,BASO);Scott蓝化液(G1865,Solarbio);人工气候箱(PRX-80A,江苏天翎仪器有限公司);动物呼吸麻醉机(ABM-100,上海玉研科学仪器有限公司);透射电镜(JEM-1230,JEOL);多功能酶标仪(S/N502000011,TECAN);显微镜(CX41 OLYMPUS);切片机(BQ-318D,伯纳);动物血液细胞分析仪(XFA6030 普朗医疗)[10]。
1.3 模型建立
1.3.1 CUCM 将小鼠适应性饲养7 d后,置于鼠笼饲养IVC系统(设置参数如下:温度20 ℃、湿度45%,每日持续12 h)中饲养,给予普通饲料喂养并给予小鼠自由饮含2% DSS蒸馏水,连续饲养10 d即可。
1.3.2 DUCM 将小鼠适应性饲养7 d后,置于鼠笼饲养IVC系统(设置参数如下:温度36 ℃、湿度80%,每日持续12 h)中饲养,给予高脂高糖饲料(配方:糖15.0%、猪油10.0%、胆固醇4.0%、胆盐0.3%、蛋黄粉10.0%、基础饲料60.7%),并给予小鼠自由饮含2%DSS蒸馏水,连续饲养10 d即可。
造模后,CUCM与DUCM分别取2只小鼠进行观察,取样进行模型验证,通过小鼠疾病活动指数评分(体质量下降分数、大便性状分数、便血分数)和小鼠的一般情况变化(体质量、便血、腹泻、背毛无光泽、拱背、懒动及肛温升高等)来判断造模是否成功。
1.3.3 粪菌制备 取正常对照小鼠的5 g新鲜晨便标本溶于10 ml无菌PBS中充分混匀,分别用2.0、1.0、0.5、0.25 mm的不锈钢筛过滤,6 000×g离心15 min,取菌体,用无菌PBS清洗3次,重悬于25 ml PBS中4 ℃冰箱保存。
1.4 实验分组 于2019年12月9—28日,根据造模需求进行针对性造模,再分为7组,每组各5只小鼠。
1.4.1 正常对照组(Control组) Control组不做任何干预处理,给予小鼠自由饮用正常水,普通饲料喂养,常温、常态下饲养(温度、湿度设置同CUCM组),不做其他特殊处理。
1.4.2 CUCM组 CUCM造模成功后,常温、常态下采用普通饲料、正常饮水饲养,采用磷酸盐缓冲液(PBS)0.2 ml/次对小鼠进行灌肠,1次/2 d,持续10 d,共计5次。
1.4.3 CUCM+FMT组 CUCM造模成功后,常温、常态下采用普通饲料、正常饮水饲养,给予制备的粪菌液0.2 ml对小鼠进行灌肠,1次/2 d,持续10 d,共计5次。
1.4.4 CUCM+5-ASA组 CUCM造模成功后,常温、常态下采用普通饲料、正常饮水饲养,按0.195 g/kg的剂量,药物浓度为0.019 5 g/ml,即20 g小鼠灌肠0.2 ml,1次/2 d,持续10 d,共计5次。
1.4.5 DUCM组 DUCM造模成功后,常温、常态下采用普通饲料、正常饮水饲养,采用PBS 0.2 ml/次对小鼠进行灌肠,1次/2 d,持续10 d,共计5次。
1.4.6 DUCM+FMT组 DUCM造模成功后,常温、常态下采用普通饲料、正常饮水饲养,给予制备的粪菌液0.2 ml对小鼠进行灌肠,1次/2 d,持续10 d,共计5次。
1.4.7 DUCM+5-ASA组 DUCM造模成功后,常温、常态下采用普通饲料、正常饮水饲养,按0.195 g/kg的剂量,药物浓度为0.019 5 g/ml,即20 g小鼠灌肠0.2 ml,1次/2 d,持续10 d,共计5次。
1.5 动物取样 给药结束后,将各组大鼠用10%水合氯醛按400 mg/kg腹腔注射麻醉,打开动物的腹腔及胸腔;将结肠和盲肠取出,表面血迹冲洗干净,用无菌棉签挤出肠道内容物,采用16S rRNA高通量测序技术测定菌群多样性。内容物取出后切去盲肠,将剩余的结肠和直肠分为3份,分别用于HE染色、透射电镜检测、流式细胞检测。
1.6 HE染色 取出各组组织样品流水冲洗数小时,经70%、80%、90%各级乙醇溶液脱水,纯乙醇、二甲苯等量混合液15 min,二甲苯Ⅰ 15 min、Ⅱ 15 min(至透明为止)。放入二甲苯和石蜡各半的混合液15 min,再放入石蜡Ⅰ、石蜡Ⅱ透蜡各50~60 min。石蜡包埋,切片。将石蜡切片进行烤片,然后脱蜡,水化。将已入蒸馏水的切片放入苏木素水溶液中染色3 min,盐酸乙醇分化液分化15 s,稍水洗,返蓝液返蓝15 s,流水冲洗,伊红染色3 min,流水冲洗,脱水,透明,封片,镜检。
1.7 透射电镜观察 各组组织样品2.5%戊二醛固定2 h以上,用0.1 mmol/L PBS漂洗,1%锇酸固定液固定2 h,0.1 mmol/L磷酸漂洗梯度乙醇(50%~90%)溶液脱水,再丙酮脱水,包埋固化,切片切成厚度为70 nm薄片。3%醋酸铀-枸橼酸铅双染,透射电镜观察。
1.8 流式细胞检测 辅助性T细胞(Th)1细胞检测:各组取100 μl血液至于12孔板中,加入150 μl 1640完全培养基,加入1 μl PMA/Ionomycin mixture佛波酯/离子霉素混合物,放入培养箱中孵育30 min后加入1 μl BFA/Monensin Mixture,放入培养箱中孵育24 h。结束后,将血液转至EP管中离心,弃150 μl上清,将细胞吹匀加入CD4 APC-CY7各5 μl,避光孵育15 min,1 ml PBS,400×g离心5 min洗2次,弃上清。加入500 μl Fixation and Permeabilization Solution避 光 固 定破膜40 min,400×g离心5 min后,加入1 ml 1×BD Perm/WashTMbuffer,清洗2次,再100 μl 1×BD Perm/WashTMbuffer重悬细胞,加入5 μl IFN-γ PE,避光孵育15 min。1 ml 1×BD Perm/WashTMbuffer,清洗2次,再500 μl 1×BD Perm/WashTMbuffer重悬细胞,上流式仪检测。Th2细胞检测步骤同上,CD4 APC-CY7孵育重悬后,Th2检测加入IL-4 PE孵育。
1.9 血常规检测 取各组血液充分抗凝后,室温条件下,采用动物血液细胞分析仪4 h内完成血常规上机检测,主要检测白细胞计数(WBC)、红细胞计数(RBC)、血小板计数(PLT)和血红蛋白(HGB)。
1.10 疗效指数评估 比较各组UC小鼠FMT干预前后疾病活动指数的变化,疾病活动指数从体质量变化(体质量不变:0分,体质量下降1%~5%:1分,体质量下降6%~10%:2分,体质量下降11%~15%:3分,体质量下降>15%:4分)、大便性状(大便正常:0分,大便松散:2分,腹泻:4分)、便血(无便血:0分,隐血阳性:2分,显性出血:4分)3方面进行综合评价。疾病活动指数=(体质量下降分数+大便性状分数+便血分数)/3。计算CUCM及DUCM的疗效指数,依据尼莫地平法:疗效指数=(治疗后疾病活动指数-治疗前疾病活动指数)/治疗前疾病活动指数×100%,比较FMT干预CUCM及DUCM的疗效指数差别。
1.11 16 S rRNA高通量测序技术测定菌群多样性 各组小鼠肠道内容物过滤后,分为3个测量组,分别为1、2、3,提取总DNA分光光度计进行定量。通常以微生物核糖体RNA等能够反映菌群组成和多样性的目标序列为靶点,根据序列中的保守区域设计相应引物,进行PCR扩增。PCR扩增产物通过2%琼脂糖凝胶电泳进行检测,并对目标片段进行切胶回收,将PCR扩增回收产物进行荧光定量,之后进行高通量测序。使用QIIME软件,调用UCLUST这一序列比对工具,高通量测序所得的序列按97%的序列相似度进行归并和OTU划分,并选取每个OTU中丰度最高的序列作为该OTU的代表序列,然后比对RDP(Ribosomal Database Project)数据库得到分类鉴定结果。
无菌环境下,采集患病鸡的少量新鲜粪便,放置在载玻片上,滴加1滴生理盐水,混合均匀后盖上盖玻片,在低倍显微镜下观察,可观察到呈现卵圆形的球虫卵囊。采集上述病死鸡典型病变肠道组织,轻轻刮取病变较为明显的肠道黏膜表层物放置在载玻片上,加同等量的甘油和生理盐水混合物,盖上盖玻片后,在低倍显微镜下观察,发现存在圆形的裂殖体和裂殖子[2]。无菌环境下采集患病鸡排出的新鲜粪便10 g,用10倍饱和食盐水稀释,充分混合后,静置30 min,用玻璃棒蘸取表面液膜,抖落在载玻片上,在低倍显微镜下观察,可以发现有卵圆形的球虫卵囊存在。
1.12 统计学方法 采用SPSS 19.0软件进行统计学分析,计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
各组小鼠均造模成功。
2.1 HE染色分析 各组小鼠肠组织HE染色显示:Control组大鼠结肠黏膜完整,腺体排列整齐,无炎性细胞浸润,层次紧密,结构清晰;CUCM组与DUCM组肠黏膜表面出现不同程度的缺损或脱落坏死,部分形成溃疡,隐窝消失,固有层大量炎性细胞浸润,黏膜肌层增厚水肿,黏膜下层血管扩张,较多红细胞、嗜酸粒细胞浸润;CUCM+FMT组、CUCM+5-ASA组、DUCM+FMT组、DUCM+5-ASA组肠黏膜基本完整,极少数仍见残缺断裂,腺体增生,排列尚整齐,杯状细胞增多,出血点消失,可见少量炎性细胞浸润,并且DUCM+FMT组与CUCM+FMT组相比,前者腺体较后者排列整齐并紧密,残缺断裂也较后者少,见图1。
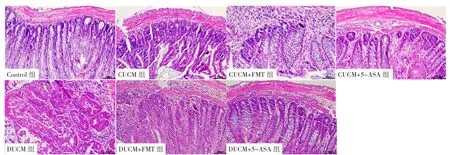
图1 各组小鼠肠组织HE染色(×200)Figure 1 Morphology of intestinal tissue of mice in each group stained with H&E
2.2 透射电镜分析 各组肠组织透射电镜超微结构显示:Control组微绒毛形态规则,排列整齐,较多杯状细胞,线粒体丰富,嵴结构清楚,粗面内质网未见改变;CUCM组与DUCM组上皮细胞表面微绒毛稀疏,长短不一,形态不规则,细胞连接间隙增宽,杯状细胞减少,胞浆内有空泡,线粒体肿胀,部分嵴消失,个别内质网扩张或呈空泡变化;CUCM+FMT组、CUCM+5-ASA组、DUCM+FMT组、DUCM+5-ASA组微绒毛较为致密,形态正常,杯状细胞数目较多,线粒体轻微肿胀,粗面内质网病变不明显,并且DUCM+FMT组与CUCM+FMT组相比,前者的微绒毛较后者紧密,杯状细胞也较后者多,见图2。

图2 各组小鼠肠组织透射电镜超微结构观察(×13 000)Figure 2 Ultrastructural observation of intestinal tissues of mice in each group by transmission electron microscope
2.3 流式细胞检测 各组小鼠Th1、Th2细胞含量比较,差异均有统计学意义(P<0.001),见表1。
表1 各组小鼠肠组织Th1、Th2细胞含量比较(±s,%)Table 1 Comparison of Th1 and Th2 cell contents in intestinal tissues of mice in each group

表1 各组小鼠肠组织Th1、Th2细胞含量比较(±s,%)Table 1 Comparison of Th1 and Th2 cell contents in intestinal tissues of mice in each group
注:Control=正常对照,CUCM=普通型溃疡性结肠炎模型,DUCM=湿热型溃疡性结肠炎模型,FMT=粪菌移植,5-ASA=5-氨基水杨酸,Th=辅助性T细胞;a表示与Control组相比P<0.05;b表示与CUCM组相比P<0.05;c表示与CUCM+FMT组相比P<0.05;d表示与CUCM+5-ASA组相比P<0.05;e表示与DUCM组相比P<0.05
组别 例数 Th1 Th2 Control组 5 10.88±2.02 4.95±2.10 CUCM 组 5 17.20±3.60 3.46±1.31 CUCM+FMT 组 5 17.23±3.77 3.33±1.35 CUCM+5-ASA 组 5 13.69±5.09 5.72±1.57 DUCM 组 5 24.53±6.39abcd 1.78±0.68d DUCM+FMT组 5 13.55±2.35e 2.17±0.98d DUCM+5-ASA 组 5 14.65±2.99e 2.33±1.33d F值 5.97 5.61 P值 <0.001 <0.001
2.4 血常规检测 各组小鼠WBC、RBC、PLT、HGB比较,差异均有统计学意义(P<0.001),见表2。
表2 各组小鼠血常规比较(±s)Table 2 Comparison of routine blood of mice in each group

表2 各组小鼠血常规比较(±s)Table 2 Comparison of routine blood of mice in each group
注:WBC=白细胞计数,RBC=红细胞计数,PLT=血小板计数,HGB=血红蛋白;a表示与Control组相比P<0.05;b表示与CUCM组相比P<0.05;c表示与CUCM+FMT组相比P<0.05;d表示与CUCM+5-ASA组相比P<0.05;e表示与DUCM组相比P<0.05
组别 例数 WBC(×109/L) RBC(×1012/L) PLT(×109/L) HGB(g/L)Control组 5 3.54±0.74 5.38±0.20 264.20±37.16 109.92±4.35 CUCM 组 5 9.64±1.32a 3.57±0.18a 333.00±29.34 90.50±5.65a CUCM+FMT 组 5 7.16±0.86ab 5.05±0.30b 322.00±25.40 108.00±7.84b CUCM+5-ASA 组 5 4.35±0.44bc 4.98±0.27b 310.00±30.70 103.80±6.26b DUCM 组 5 7.74±0.88abd 3.65±0.35acd 392.20±45.79abcd 91.38±7.86acd DUCM+FMT 组 5 4.42±0.56bce 5.55±0.15be 302.00±41.36e 110.00±5.61be DUCM+5-ASA 组 5 5.13±0.43bce 5.90±0.46bcde 300.60±34.30e 108.00±5.52be F值 38.47 49.34 6.13 9.30 P值 <0.001 <0.001 <0.001 <0.001
2.5 疗效指数分析 CUCM+FMT组疗效指数为(-31.03±4.71)%,CUCM+5-ASA组疗效指数为(-62.53±7.53)%,DUCM+FMT组疗效指数为(-56.58±13.29)%,DUCM+5-ASA组疗效指数为(-50.47±20.86)%,各组疗效指数比较,差异有统计学意义(F=5.41,P=0.009);其中CUCM+5-ASA组、DUCM+FMT组、DUCM+5-ASA组疗效指数高于CUCM+FMT组,差异均有统计学意义(P<0.05)。
2.6 菌群多样性分析 对各组小鼠肠内容物进行菌群多样性分析,其中Rank-abundance曲线表示物种的丰富程度(图3a),曲线越宽,表示物种的组成越丰富,曲线越平坦,表示物种组成的均匀程度越高;非度量多维尺度分析(图3b)、Beta多样性PCA成分分析(图3c)、PCoA主坐标分析(图3d)表示微生物群落相似度,样品彼此之间靠得越近,表示微生物群落相似度越高。结果显示,CUCM+FMT组、DUCM+FMT组经治疗后有逐步向Control组靠拢的趋势,表明肠道菌群正在改善。对各组样本属水平分类差异统计与相对丰度分析,结果显示,相较于Control组,CUCM组中丰度显著降低的属分别是 Ruminococcus、Unclassfied_Lachnospiraceae,显著升高的属分别是Akkermansia、Clostridium_XIVa、Unclassfied_Porphyromonadaceae; 相较于 Control组,DUCM组中丰度显著降低的属分别是Helicobacter、Saccharibacteria_genera_incertae_sedis、Ruminococcus,DUCM组中丰度显著升高的属分别是Akkermansia、Bacteroides、Parabacteroides、Klebsiella。经过FMT治疗后,CUCM+FMT组、DUCM+FMT组有逐步向Control组靠拢的趋势,表明肠道菌群正在改善,见图4。

图3 各组小鼠肠内容物菌群多样性分析Figure 3 Diversity analysis of intestinal microbiota in mice in each group

图4 小鼠肠内容物菌群属水平差异分析Figure 4 Comparative analysis of intestinal microbiota of mice in each group at the genus level
3 讨论
目前关于FMT治疗UC的机制认为可能与改善肠道菌群结构,酸化肠道抑制致病菌生长,提高肠道抗炎代谢物如短链脂肪酸水平,增加有益菌丰度,改善Th1/Th2细胞平衡,调节促炎因子与抗炎因子的平衡,诱导机体免疫系统对肠道菌群产生免疫耐受等多方面有关[11-12]。
根据本研究HE染色病理学、透射电镜超微结构结果分析,FMT对CUCM与DUCM两种UC模型小鼠均有显著的疗效,且对DUCM效果优于CUCM。流式细胞检测结果表明FMT可以使DUCM模型组中Th1细胞减少,Th2细胞增多。血常规表明FMT可以使UC模型中WBC、PLT下调,RBC、HGB上调,并且DUCM组的各项指标改善均优于CUCM组。疗效指数分析表明DUCM组的疗效指数高于CUCM组。同时菌群多样性结果也显示FMT可以使UC模型中的菌群趋于正常。
T淋巴细胞在机体的免疫应答和免疫调节作用中占据着中心地位,Th细胞为初始CD4+T细胞活化后分化而成的效应细胞,其通过释放细胞因子、辅助B细胞活化产生抗体,以及和细胞间直接接触的方式发挥免疫效应[13]。在受到不同性质抗原和局部微环境中细胞因子调控后,Th细胞主要可分化为Th1、Th2等两个亚型。Th1细胞以分泌IL-2、IFN-γ等为主,参与细胞免疫应答、炎性反应和急性排斥反应过程;Th2细胞以分泌IL-4、IL-5为主,参与体液免疫应答[14-15]。根据研究UC模型中Th1细胞及Th2细胞,经FMT治疗后,DUCM模型组Th1/Th2平衡更趋于Control组。
肠道菌群紊乱与多种疾病的发生有密切联系,如哮喘、肥胖、糖尿病等,尤其是胃肠类疾病[16]。有研究表明,大肠湿热证UC患者与健康人肠道菌群的差异明显:其中,大肠湿热证UC患者的Bacteroidetes和Firmicutes的细菌均低于健康人,但是Proteobacteria和Verrucomicrobia的比例高于健康人且大肠湿热证UC患者的多样性均高于健康人肠道样本[17]。根据本研究的菌群差异结果显示,属水平差异显著的是Ruminococcus与Akkermansia,推测可能与疾病的发生及治疗有关。
综上可知,FMT治疗UC模型小鼠效果明显,并且针对DUCM优于CUCM。反之,苦味具有清泻、燥湿作用,一般清热、泻火、燥湿、通便药物均具有苦味,苦味药物主治热证、火证及湿证。根据中医八纲辨证施治理论“寒者热之,热者寒之”,即热证、火证均可以使用具有寒凉属性的药物治之。根据本研究证实FMT对DUCM疗效优于CUCM,进而根据中医药理论推导,新金汁属于中药中的苦寒之物。本研究为FMT治疗UC提供了理论依据,也为FMT(新金汁)的中药性味苦寒提供了理论依据,但还需深入研究。
作者贡献:张磊昌提出论文思路、实验设计方案,对文章整体负责,监督管理;丁成华进行动物造模及取样处理、实验指标检测;胡家丽、崔曼曼进行数据收集及数据整理;葛巍进行统计学处理;杨苏琴进行结果解读;马晓飞撰写论文初稿、绘制图表;马晓飞、张磊昌进行论文的修订;丁成华、张磊昌负责文章的质量控制及审校。
本文无利益冲突。
