非洲猪瘟研究新进展
2022-04-02刘金林李兆龙罗锦义
刘金林 李兆龙 罗锦义
(1.龙岩市农业学校 福建龙岩 36400;2. 福建省农业科学院畜牧兽医研究所 福建福州 350013)
由非洲猪瘟病毒引发的非洲猪瘟是猪的一种急性传染病,它的发病特点是病程短、病死率高。 我国将其列为一类动物疫病, 世界动物卫生组织(OIE)将其列为法定报告动物疫病。
该病最早可以追溯到1900 年的英属东非农场,随后扩散至欧洲, 后来又进入南美洲和加勒比。2007 年,该疫病扩散到高加索地区,随后在全球多个国家发生、扩散、流行。 2018 年8 月传入我国,并迅速在全国扩散。因为没有有效的疫苗,目前非洲猪瘟的防控主要通过扑杀控制传染源, 清洗消毒切断传播途径。但对于易感的动物(猪),并没有其它有效的防护措施,这给防控带来巨大的困难和挑战。为了防止疫情的进一步恶化,也为了切实做好疫情防控,本文从非洲猪瘟的病原学、 临床症状等方面进行综合阐述。
1 病原学
1.1 病毒的分类及形态结构 ASFV 属于非洲猪瘟病毒科、 非洲猪瘟病毒属的唯一成员。 它是双链DNA 病毒, 有囊膜和衣壳, 病毒颗粒呈20 面体结构[1-2]。 衣壳由 1892~2172 个壳粒构成,中心有孔,呈六棱镜状,壳粒间间距为7.4~8.1 nm。 直径达175~215 nm,基因组全长 170~193 kb,编码 150~167 个蛋白[3]。 根据病毒p72 基因的末端序列,可分为23 个基因型,其中基因I 型最早发现在东非、西非、中非和欧洲,基因II 型则是近年来格鲁吉亚、俄罗斯周边、欧洲以及当前我国主要流行株,而基因XXIII 型发生东非埃塞尔比亚[4]。
1.2 病毒编码蛋白 根据非洲猪瘟编码蛋白的功能(见图 1)可将其分为以下 7 类。 (1)病毒结构和 形 态 的 组 成 蛋 白 :p72、P150、p37、p34、p14、p5、p35、p15、p8、ps273r、p17、pe183l、p49、pe120r、p10 和pa104r[5-6];(2)病毒转录和 RNA 修饰蛋白:pb962l、pd1133l、pnp1450l、Pep1242l、pg1340l、pq706l、pnp86 8r、pc475l、ph359l、pd205r、pd339l、Pep424r 和 pc147l;(3)维护基因组完整性蛋白:po174l、pnp419l、pe296r和 pe165r; (4) 主 导 病 毒 入 侵 蛋 白 :p12、pe248r和 pe199l[7-8];(5)逃避宿主防御的蛋白:Pep402r 和pa224r;(6) 其它已知蛋白质:pr298l、pb119l、p22、p32、p11.5、Pep152r 和 ph339r; (7) 未 知 的 蛋 白 :pM1249L、pCP123L、pC129R、pC717R、pI177L、pK14 5R、pK421R、pE146L、pF317L、pH240R、pCP312R、p E423R、pE184L、pC257L、pH171R、pB117L、pB169L、pEP84R、pI73R、pC122R、pQP383R、pM448R 和 pH 124R[9]。
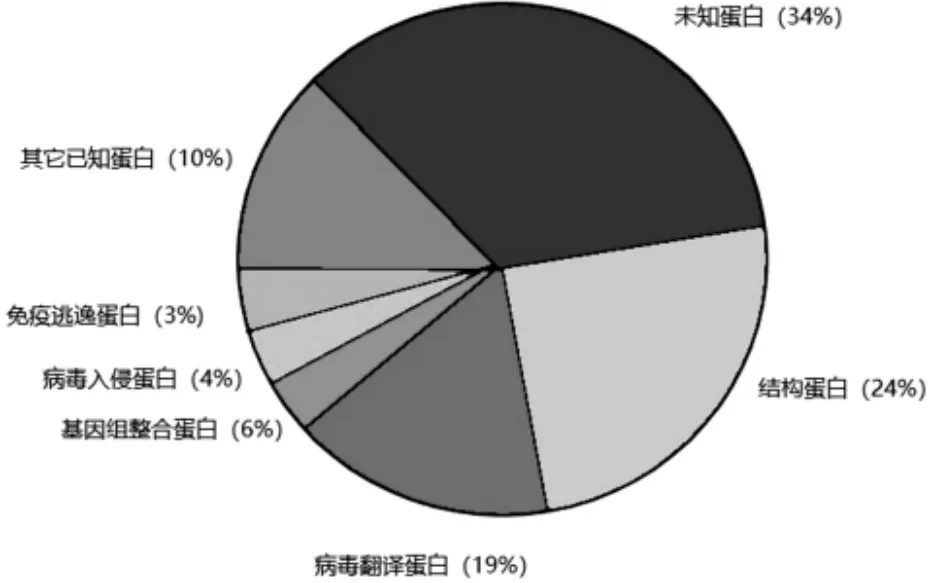
图1 病毒蛋白功能分类
1.3 非洲猪瘟病毒结构的蛋白分布 根据病毒图谱的数据,图2 展示了40 种病毒蛋白在5 个病毒结构域的分布位置。 (1) 包外囊膜, 包括 p12、p24 和CD2v[10];(2)病毒衣壳,由 p14、p49 和 p72 构成[11];(3) 内囊膜由已知 7 个膜蛋白组成,p12[pO61R]、p17[pD117L]、p22、p54[pE183L]、pE248R、pH108R 和pE199L[12];(4)核壳,主要由蛋白质降解产物 pp220(ORF CP2475L)和 pp62(CP530R)组成,分别占病毒质量和病毒蛋白酶的三分之一[13]。(5)蛋白二十面体衣壳,由主要的衣壳成分P72 和副衣壳蛋白P49 组成,它们都参与了该结构域的组装,以及介导细胞内病毒运输的蛋白 pE120R[14]。 (6)类核,包括 RNA 聚合酶亚基 (RP1、RP2、RP3、RP4、RP5、RP6 和 RP7),转录因子(pD1133L、pQ706L、pG1340L 和 pB962L),RNA 修饰酶(PolyA Capping 酶、甲基转移酶),结合DNA 的主要结构蛋白(p10、pA104R),碱基切除修复蛋白(DNA pol X、DNA 连接酶、AP 内切酶)等[15]。
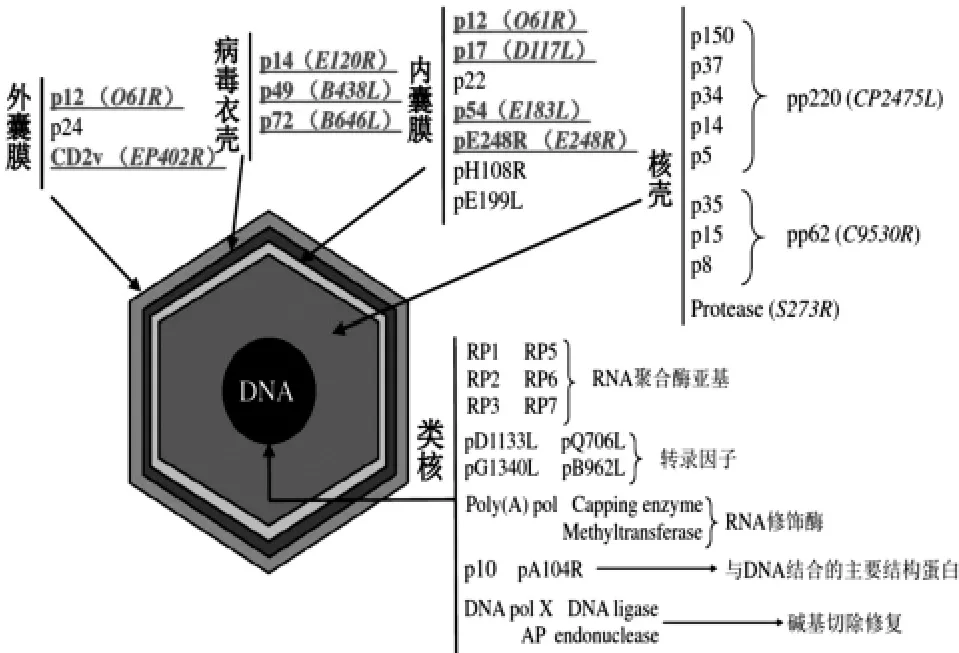
图2 非洲猪瘟病毒结构的蛋白分布
1.4 病毒的理化特性 非洲猪瘟病毒属于热敏性病毒,56 ℃持续 30 min 就可灭活, 但在 5 ℃以下的低温环境则可存活数年,甚至更长时间。 此外,病毒对碱性不敏感,在pH 4~10 溶液中可稳定存活较长时间[16]。 此外,病毒的颗粒较大,梯度密度在1.19~1.24 g/cm3[17]。
1.5 病毒的体外培养特性 非洲猪瘟病毒体外培养的细胞主要为原代单核-巨噬细胞, 接种48 h 后出现明显的圆缩肿胀、脱落和溶解等细胞病变;它也可在脾脏、淋巴结、肺、肾脏的网状细胞上增殖。部分报道该病毒可以在鸡胚卵黄囊和骨髓细胞中增殖。少数的适应毒株可在猪肾细胞系(PK)、非洲绿猴肾细胞(Vero)、仓鼠肾细胞(BHK-21)以及猪睾丸细胞(ST)等增殖并引起细胞病变[18]。
1.6 非洲猪瘟病毒的适应力 非洲猪瘟病毒在体内外环境中稳定存在,病毒在污染的环境、粪便、肉制食品、冰冻肉、半熟肉、泔水、腌制火腿以及未经烧煮或高温烟熏的火腿和香肠都能存活[19],具体存活时间见表1。
2 非洲猪瘟的临床特征及病理变化
2.1 非洲猪瘟的临床特征 根据非洲猪瘟的临床病程特性,可将非洲猪瘟分为超急性、急性、亚急性或隐性感染。其中超急性型多发生在非洲地区,临床表现为突发性死亡,死亡率高;急性型表现为持续高烧,昏睡、厌食、皮肤出血以及循环系统、呼吸系统、消化系统出现问题并伴有神经失调, 该症状多见于我国, 这些急性-亚急性的ASF 临床症状与古典猪瘟(CSF)、猪丹毒、沙门氏菌病、放线杆菌病、其它败血症、猪皮炎肾病综合征(PDNS)等的临床症状非常类似,有时候容易混淆,应注意鉴别(见表2)[20]。

表2 急性非洲猪瘟临床症状及鉴别诊断
2.2 病理变化 感染不同毒性的非洲猪瘟病毒后,产生病变是不同。 急性和亚急性非洲猪瘟病毒感染后常表现出特征性的广泛出血和淋巴组织坏死。 急性非洲猪瘟鉴别诊断通常以脾脏肿大的症状为主,其次为淋巴系统病变。之前病理检测研究报道,感染非洲猪瘟的野猪, 出现脾脏肿大的病例占比达到100%,同时还出现淋巴结肿大(94.12%)、出血性淋巴腺炎(88.23%)、胸膜积水(88.23%)、扁桃体出血(88.23%)、扁桃体化脓(52.94%)、肝肿大(88.23%)、休克肺(70.95%)、细支气管间质性肺炎(64.7%)、心包积水 (70.59%)、 心脏出血 (47%)、 肠道出血(76.47%)、派尔集合淋巴结坏死(35.29%)、肾脏出血(41.17%)等症状(见图 3)[21]。 而慢性和亚急性非洲猪瘟病毒感染, 病变则很轻微或肉眼几乎看不见病变。

图3 非洲猪瘟的病理变化
3 病毒的入侵机制
非洲猪瘟病毒颗粒较大,直径约200 nm,主要感染猪的巨噬细胞。因此,多数研究认为病毒利用受体介导的内吞作用进入宿主细胞。 内吞途径包括巨胞饮、网格蛋白依赖型内吞、小窝蛋白依赖型内吞、小窝蛋白非依赖型内吞和其它途径(见图4)。 其中网格蛋白依赖的内吞 (Clathrin dependent endocytosis)和巨胞饮(Macropinocytosis)是病毒入侵的主要方式[22]。
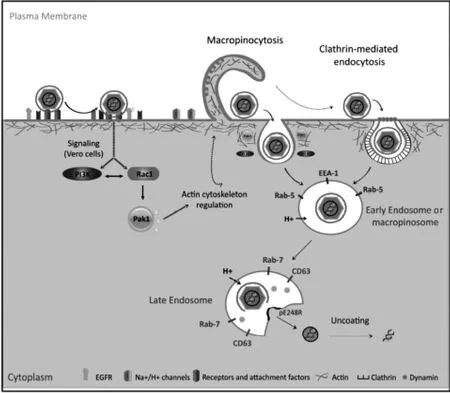
图4 非洲猪瘟入侵模式
非洲猪瘟病毒巨胞饮入侵是一种非特异的内吞形式,被认为是病毒入侵的主要方式之一。 它是不依赖于配体,病毒首先结合于细胞膜上,然后在肌动蛋白驱使形成大且不规则的原始内吞小泡 (巨胞饮体),然后巨胞饮体向细胞中心移动,由脱水而变小、酸化[23]。
网格蛋白在非洲猪瘟病毒的入侵中起着关键的作用。 研究认为, 大部分病毒通过pE248R 蛋白和p12 蛋白共同作用结合在细胞表面的受体, 形成配体-受体复合物激活一些蛋白激酶, 磷酸化膜受体分子上特定入胞基序(Motif)。 磷酸化后入胞基序,改变膜受体分子构象, 显露出受体与适配子蛋白结合的信号序列,使环状结构收缩,实现囊泡与胞膜的脱离[23]。
非洲猪瘟病毒入侵宿主细胞后, 进入胞质,在p37 蛋白作协助下将病毒的核衣壳转移至宿主细胞核周围,接着,病毒开始复制相关DNA 聚合酶的转录。 病毒早期基因表达转向晚期基因表达, 病毒DNA 进入并聚集于细胞核,进行DNA 复制,复制后的病毒DNA 与蛋白p37 一起转运到细胞质,聚集于细胞质进行病毒的包装。多聚蛋白pp220 和pp62 的蛋白酶解加工促进了病毒的装配成熟。 经过装配以后,成熟的ASFV 颗粒离开病毒工厂,依赖于微管和驱动蛋白,在宿主的细胞质中进行病毒装配,然后装配好的病毒粒子转移到细胞膜, 经细胞膜释放到胞外,进行下一轮的感染。然后经血液或淋巴转移至病毒二次复制的场所---淋巴结、骨髓、脾、肺、肝和肾。病毒血症通常在感染后4~8 d 出现,由于缺乏中和抗体,将持续数周或数月。 ASFV 易与血液红细胞膜和血小板相互作用, 能够引起感染猪的血细胞吸附现象。 急性病例中的出血机理是由于在疾病后期内皮细胞中复制的病毒使内皮细胞的吞噬活性增强引起的。 亚急性病例中的出血机理主要是因为血管壁的通透性升高而引起[23]。
4 非洲猪瘟的实验室诊断方法
非洲猪瘟的实验室诊断方法较多, 目前应用较多的是 ELISA、PCR 以及荧光定量 PCR 等常用方法。
4.1 病毒分离、动物接种及红细胞吸附 病毒分离及动物接种是疫病诊断的关键技术, 通常将疑似非洲猪瘟的样品接种易感细胞或动物而进行的检测。然后通过是否产生细胞病变(CPE)来判断。 红细胞吸附检测法,是因为非洲猪瘟病毒感染白细胞,周围会吸附猪红细胞形成“玫瑰花环”,该现象称为红细胞吸附反应(HAD),因此,红细胞吸附试验是检测该病毒的特有技术[24]。
4.2 酶联免疫吸附试验(ELISA) 使用ELISA 检测病毒抗原,短时间内可对样品进行大规模筛查,而且其成本比 PCR 更为低廉, 因此,OIE 将 ELISA 作为诊断非洲猪瘟的首选血清学方法。 目前国内外常以VP73、VP72、P54、P32、P30 作为抗原检测的蛋白[25]。
4.3 胶体金免疫层析(GICA)试纸条 使用胶体金免疫层析试纸条,方便快速,成本低,不需要特殊的仪器设备,便于基层和现场使用。 因此,它的应用范围广,可适应多种检测条件,可进行多项检测,可以节省样品,降低成本;此外,胶体金标记物稳定,标记样品在4 ℃贮存两年以上,无信号衰减现象等优势。当前, 主要有针对P54 蛋白制备用于检测ASFV 的胶体金免疫层析试纸条[26]。
4.4 PCR 检测方法 目前,PCR 是最常用的ASFV实验室检测方法,因为该方法简单快速、灵敏度高和特异性强。 但是PCR 的缺点是容易发生交叉污染,应该采取适当的预防措施来减少和控制污染风险的发生。目前主要根据 ASFV 的 VP72、VP73 和 P54 基因建立了能够诊断ASFV 的特异性PCR 方法,有单重和多重PCR 检测方法已成功应用于猪样品 (血液、器官等)和蜱中ASFV 基因组的检测[27]。
4.5 荧光定量PCR 方法 实时荧光定量PCR 有敏感性高和特异性好的优点, 可同时快速进行大批量的样品检测。 根据 ASFV 的 VP72、VP73、P54 基因各自设计引物和探针,建立了Taq Man 实时荧光定量PCR 方法。郭少平等[28]、王建华等[29]建立了实时荧光定量PCR 方法检测ASFV。 于恒智等[30]则建立了一种可同时鉴别检测5 种病的多重荧光定量RTPCR 方法。
4.6 其它方法 根据ASFV VP72 基因保守序列设计并合成引物, 分别建立了线性指数聚合酶链式反应(LATE-PCR)技术、环介导恒温扩增(LAMP)技术、重组酶聚合酶扩增(RPA)和探针杂交技术[31]。
5 疫苗研究进展
5.1 灭活疫苗 非洲猪瘟发现之后,陆续有研究开展灭活疫苗的研制。 研究表明,ASFV 灭活抗原免疫动物后能够诱导产生ASF 特异性抗体,但未能提高疫苗的免疫保护效果。此外,研究人员也证实在细胞传代过程中, 低代次和高代次的ASFV 毒株对中和抗体的敏感性存在差异。 随后很多的灭活苗被证实作用微弱, 这些研究结果证实由于灭活疫苗自身固有的缺陷, 很难刺激免疫系统诱导产生高效抗体,即使部分能刺激猪产生抗体, 也无法抵御ASFV 的攻击。
5.2 弱毒苗 部分弱毒疫苗虽然能抵御强毒的攻击,但1/4 的免疫猪却出现了ASF 临床症状,并且有部分猪出现死亡现象。 接种经细胞传代致弱获得的KK262 免疫小猪,不能抵御野生型K49 株的攻击[32]。而接种自然传代缺失了约10 kb 基因序列致弱的OURT88/3 株,可促进I 型干扰素的产生及增强机体的免疫反应[33]。O′Donnell V 等[34]将多基因家族(MGF家族)的多个基因删除后获得ASFV-G ΔMGF 株免疫小猪, 结果发现其具有良好抵御强毒株ASFV-G攻击的能力。其它弱毒株有Benin ΔDP148R、ASFVG-Δ9GL/ΔUK、Ba71 ΔCD2v、Pret4 Δ9GL、OURT88/3 ΔDP2 及 NHV/P68 等[35-36],它们的保护能力各不相同,除了所缺失基因不同外,还与基因型相关(见表3)。 Borca M V 等[37]通过CRISPR/Cas9 基因编辑技术构建了 ASFV 弱毒株(ASFV-G/Δ8-DR)。 近期,西班牙科学家针对拉脱维亚2017 年感染ASFV 发病野猪的突变基因而开发的疫苗(Lv17/WB/RIE1)免疫猪后产生较高的抗体水平, 但尚需进一步试验验证[38]。 已有报道的非洲猪瘟弱毒疫苗见表3。
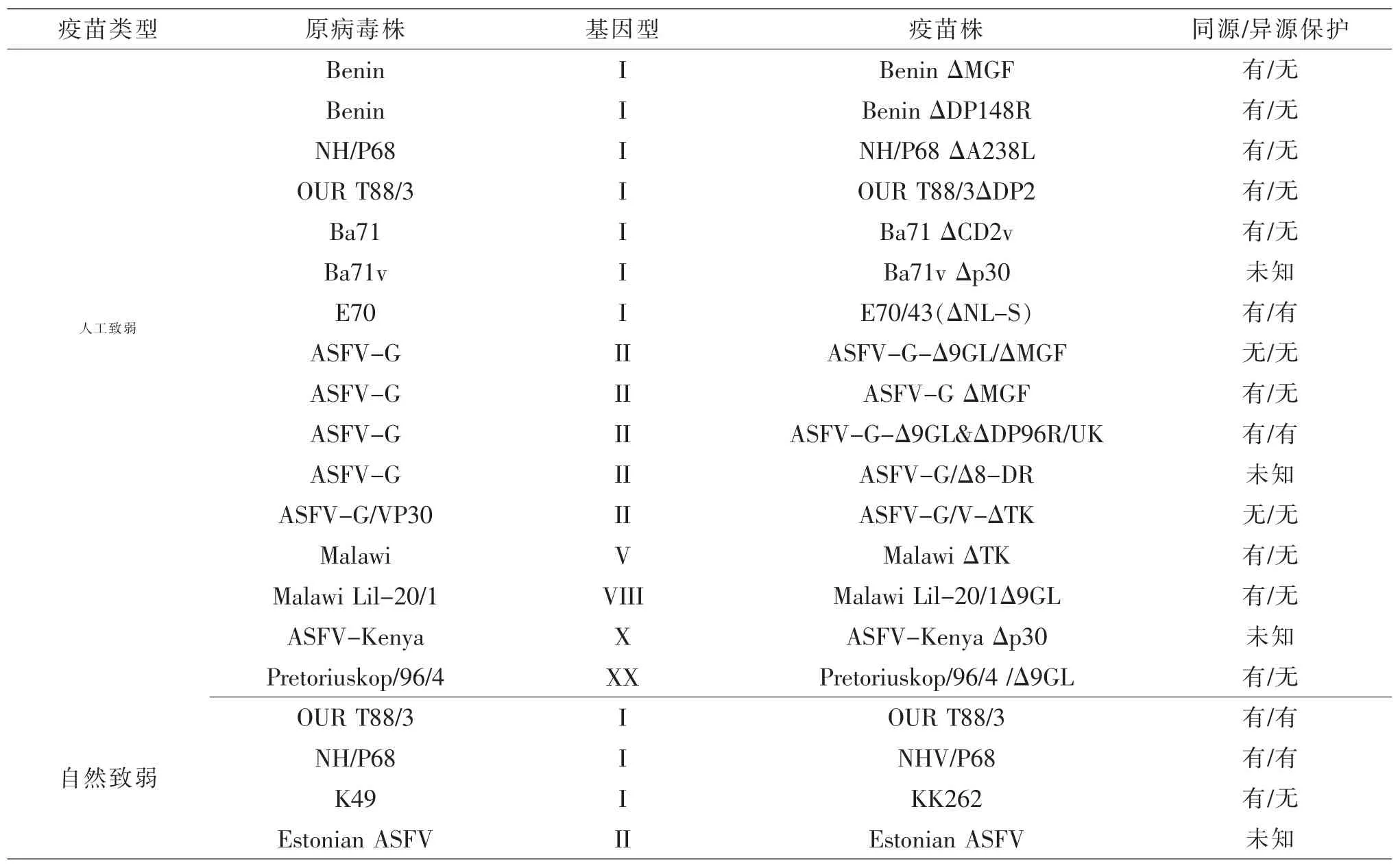
表3 已有报道的非洲猪瘟弱毒疫苗
5.3 亚单位疫苗及核酸疫苗 亚单位疫苗主要是通过原核或真核细胞表达具有中和表位的非洲猪瘟病毒保护性抗原, 通过MHI 递呈给抗原递呈细胞,以诱导抗非洲猪瘟病毒的中和抗体的产生。 研究发现 p72、CD2V、p12、p30 和 p54 等病毒结构蛋白可诱发机体产生免疫应答[39-45]。 Lacasta A 等[46]构建的核酸疫苗, 结果发现它的保护能力只能达到60%。接着针对 p12、p30、p54、p72、CD2V 单个或多个蛋白的亚单位疫苗研究, 结果发现很难提供较为全面的保护(见表 4)。

表4 非洲猪瘟核酸疫苗及亚单位疫苗
p30、p32、p54 及 p72 等 基 因 也 是 病 毒 载体疫苗研究的对象[47],其它病毒载体疫苗见表5。而 Lokhandwala S 等[48]和 Loperamadrid J 等[49]构建的载体疫苗,其保护能力还有待验证。

表5 其它病毒载体疫苗
总之,疫苗的研究虽然取得一些进展,但离实际应用还有一段路要走,还需要各国共同努力。
