黄瓜纤维素合成酶CESA家族基因鉴定及非生物胁迫响应分析
2022-04-02赵雪芳李亚栋田哲娟吴志明
康 忱 赵雪芳 王 鹏 李亚栋 田哲娟 吴志明
(河北省农林科学院经济作物研究所,河北石家庄 050051)
纤维素是植物细胞壁的主要组成成分,具有生成分子内与分子间氧键的能力。在植物体内,纤维素构成纤维素糖苷网,是承受机械压力的支撑结构,能够调控植物形态学上的某些特性与特征(Joshi &Mansfield,2007)。细胞壁在植物生长发育和响应环境胁迫中发挥重要作用,因此纤维素合成机制的相关研究在多个学科中占有重要地位(Pauly &Keegstra,2010;Youngs &Somerville,2012)。纤维素由纤维素合成酶复合体合成,其单体主要由纤维素合成酶(cellulose synthase,CESA)基因家族成员编码,纤维素合成酶负责植物纤维素的生物合成(Somerville,2006)。目前已从多种植物中克隆多个基因的相关序列,如拟南芥()、烟草()、水稻()、毛果杨()、四倍体海岛棉()和亚麻()等(Richmond &Somerville,2000;Wang et al.,2010;袁红梅 等,2016;Yuan et al.,2016;徐宗昌和孔英珍,2017)。在拟南芥中,初生壁纤维素合成需要纤维素合成酶AtCESA1、AtCESA3 和AtCESA6 的参与,三者组成纤维素合成酶复合体,次生壁纤维素合成需要AtCESA4、AtCESA7 和AtCESA8 的参与(Desprez et al.,2007;Atanassov et al.,2009;Hill et al.,2015)。纤维素合成酶的互作蛋白(cellulose synthase interactive protein 1,CSI1)和伴侣蛋白(companion of cellulose synthase,CC)是微管和纤维素合成酶复合体的相互作用中的主要成员,其中CC 蛋白具有在盐胁迫条件下维持纤维素合成的作用(Gu et al.,2010;Endler et al.,2015)。拟南芥AtCESA5 的磷酸化则是光敏色素调控纤维素合成和下胚轴细胞伸长生长的重要机制(Chen et al.,2010,2016;Bischoff et al.,2011)。磷酸化蛋白组学方面的研究显示,磷酸化修饰CESAs 能响应植物生长发育及环境信号,调控由微管介导的纤维素合成的关键机制(Facette et al.,2013;Roitinger et al.,2015;Chen et al.,2016)。
黄瓜(L.)为葫芦科一年生蔓生或攀援草本植物,是我国重要的蔬菜作物之一,在世界范围内广泛种植。2020 年我国黄瓜年种植面积达到100 万hm,年产量达到5 600 万t,占世界总产量的70%以上(FAO,http://www.fao.org/)。在生产过程中,黄瓜经常遭受各种非生物胁迫,例如低温、高温和盐胁迫。低温胁迫导致叶片发黄和生长减慢,降低黄瓜的产量,特别是在冬季和早春(Dong et al.,2019)。高温导致叶片晒伤和果实畸形,从而影响夏季黄瓜的产量和果实品质(于拴仓和王永健,2003)。盐胁迫降低了叶绿素含量和矿物质吸收,从而影响了黄瓜的正常生长发育(Yildirim et al.,2008)。植物激素在调节外界环境应激反应中很重要。脱落酸(ABA)信号传导途径是植物中盐、干旱和低温胁迫信号传导的中心(Zhu,2016)。ABA 的生物合成和信号传导参与植物对低温的响应(Wang et al.,2019)。到目前为止,在黄瓜对非生物胁迫的响应中,已经对WRKY(Ling et al.,2011)、MADS(Hu &Liu,2012)、MLO(Zhou et al.,2013)、ARF(Liu &Hu,2013)、NAC(Liu et al.,2018)和GRAS(Li et al.,2020)等基因家族进行了深入研究,但是,CESAs 作为植物生长发育和非生物胁迫响应过程中的一个重要的基因家族,在黄瓜中还鲜见报道。目前纤维素合成酶基因家族的研究有较大进展,但大多局限于拟南芥、烟草等模式植物和棉花、杨树、亚麻、毛竹等木本植物中,黄瓜中绝大部分CESA家族成员未得到鉴定,随着黄瓜基因组序列的公布和完善,对纤维素合成酶家族基因进行全基因组挖掘和全面、系统的分析十分必要。本试验利用生物信息学方法对黄瓜CESA 基因家族成员进行鉴定,并对它们的染色体位置、基因结构、进化分化特征以及物种间的共线性进行了系统分析。通过施加外源植物激素(ABA 和MeJA)和非生物胁迫(NaCl)处理,分析CESA 家族基因的表达模式,为更好地了解CESA 基因家族成员及其在黄瓜非生物胁迫响应中的生物学功能提供依据,为进一步探索该家族在黄瓜响应非生物胁迫调节中的作用奠定基础。
1 材料与方法
1.1 材料和处理
供试材料为河北省农林科学院经济作物研究所保存的黄瓜品系9930。2021 年3 月上旬将供试黄瓜材料播种于本所育苗温室,选取两叶一心时期的黄瓜幼苗,在塑料花盆中培养,第1 组用200 mmol·LNaCl 水培处理,第2 组用100 μmol·L的脱落酸(ABA)喷洒叶面,第3 组用100 μmol·L的茉莉酸甲酯(MeJA)喷洒叶面,第2 组和第3 组利用灭菌的营养土和蛭石混合栽培。将所有处理放置于植物组织培养室中培养,温度为28 ℃,光照强度为2 000 lx,光照周期为光16 h/暗8 h。分别在处理后0、3、6、12 h 和24 h 对叶片取样,经液氮速冻后置于-80 ℃冰箱中保存用于RNA 提取。每个处理采用3 个生物学重复。
1.2 黄瓜纤维素合成酶基因家族成员的获得与 鉴定
黄瓜基因组序列于2009 年完成(Huang et al.,2009)。从黄瓜基因组数据库CuGenDB(Cucurbit Genomics Database,http://www.cucurbitgenomics.org/organism/2)下载“黄瓜基因组9930_V2 版本”(9930 作为参考基因组)基因组数据。从TAIR数据库(https://www.arabidopsis.org/)获得拟南芥CESA 基因家族的基因ID 和氨基酸序列信息。利用BioEdit 软件,以e为临界值选取候选CESA 基因,用本地Perl 语言提取候选基因蛋白序列,初步获得CESA 基因家族成员。结合下载于Pfam数据库(https://pfam.xfam.org/)的CESA 蛋白的保守结构域(PF03352,PF14569),使用Pfam 中的HMMScan 和PfamScan 对上一步获得的候选基因进行结构域分析,剔除不含CESA 蛋白典型结构域的序列,确定CESA 基因家族的最终成员。
1.3 黄瓜纤维素合成酶基因家族生物信息学分析和系统进化树构建
通过ExPASy网站(https://web.expasy.org/compute_pi/)对黄瓜纤维素合成酶家族蛋白的等电点(pI)和分子量(Mw)进行预测。利用在线网站MEME(https://meme-suite.org/meme/index.html)进行motif 预测,数量设置为10 个,其余参数选择默认。提取CESA 基因家族成员的gff文件信息,通过网站Gene Structure Display Server 2.0(GSDS 2.0,http://gsds.gao-lab.org/)进行基因结构分析。利用在线软件Softberry(http://linux1.softberry.com/berry.phtml)对家族蛋白进行亚细胞定位的预测。从黄瓜基因组序列注释文件中提取每个基因的染色体位置,利用在线网站MapGene2Chrom web v2(MG2C,http://mg2c.iask.in/mg2c_v2.0/)绘制基因在各条染色体上的位置图谱。利用TBtools 中的MCscanX 分析黄瓜、拟南芥和番茄CESA 家族基因之间以及黄瓜、西瓜和甜瓜CESA 家族基因之间的同源性,生成共线性分析图。
使用软件MEGA 7.0 分别对黄瓜、拟南芥、番茄和黄瓜、西瓜、甜瓜中CESA 的蛋白序列进行多重比较,通过邻接法(neighbor-joining,NJ)构建进化树,设BootStrap 抽样次数为1 000。使用在线网站ITOL(https://itol/embl.de/)优化进化树,并将CESA 家族进一步分为不同group。
1.4 黄瓜纤维素合成酶家族基因启动子区顺式作用元件分析
为了分析黄瓜CESA 基因启动子区域包含的顺式作用元件,用软件TBtools 提取每个基因起始密码子‘ATG’上游2 000 bp 的序列,利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对顺式作用元件进行预测和分析,然后使用TBtools 软件对分析结果进行可视化。
1.5 基于转录组测序数据的基因组织表达与胁迫响应分析
为了确定基因的组织特异性表达,从黄瓜基因组数据库CuGenDB 下载并分析了已发表的RNA-seq 数据,分别为10 个黄瓜组织〔根、茎、叶、受精子房(已膨大)、子房(未膨大)、雌花、未受精子房(已膨大)、雄花、卷须基部和卷须〕(PRJNA80169)、NaCl处理(PRJNA437579)和低温处理(PRJNA438923)的转录组数据。
1.6 黄瓜纤维素合成酶家族基因表达分析
使用植物总RNA 提取试剂盒〔天根生化科技(北京)有限公司〕从样品中提取总RNA,使用PrimeScript ™ RT reagent Kit 试剂盒〔宝日医生物技术(北京)有限公司〕完成第一链cDNA 的合成,使用的仪器为ABI PRISM 7500 实时荧光定量PCR仪(操作软件为7500 Fast Real-Time PCR Systems,v2.0.6,USA),荧光染料为TB Green。试剂盒为宝生物工程(大连)有限公司的TB Green® Premix Ex Taq ™(Tli RNaseH Plus)。使用Primer Premier 3 在线设计特异性引物,序列如表1 所示。qRT-PCR 反应体系10 μL:5 μL 的 TB Green Premix Ex(Tli RNaseH Plus)(2×),1 μL cDNA模板,primer-F/R 各0.2 μL(终浓度为0.2 μmol·L),0.2 μL ROX Reference Dye II(50×),3.4 μL ddHO。反应程序:95 ℃预变性30 s;95 ℃变性5 s,60 ℃延伸34 s,40 个循环;72 ℃ 20 s。以(Csa3G806800)为内参基因。使用2算法分析基因的相对表达水平(Rieu &Powers,2009)。

表1 qRT-PCR 引物序列
2 结果与分析
2.1 黄瓜纤维素合成酶基因家族的成员鉴定
利用已发表的拟南芥CESA 的蛋白序列作为源序列,通过BlastP 的方式采用BioEdit 软件对黄瓜基因组蛋白数据库进行比对,以E <10为筛选条件,结合CESA 蛋白的保守结构域(PF03352,PF14569)共鉴定得到35 个CESA 基因家族成员。根据在染色体上的位置信息,利用在线软件MG2C 进行基因定位并绘制其在染色体上的位置图谱(图1),35 个基因均分布在除5 号染色体外的7 条染色体上,1~7 号染色体上基因数目分别为1、10、3、11、0、3、7个。根据在染色体上的位置,将35 个基因命名为从到。其中,有3 对片段重复基因。CsCESA 蛋白的氨基酸残基数目在205~1 146 之间,分子量在23.2~128.4 kD 之间,蛋白等电点(PI)在5.18~8.95 之间。利用在线网站Softberry 对基因家族蛋白进行亚细胞定位的预测,大部分家族成员定位于质膜上,少部分成员定位于高尔基体上(表2)。

图1 黄瓜纤维素合成酶基因家族在染色体上的位置
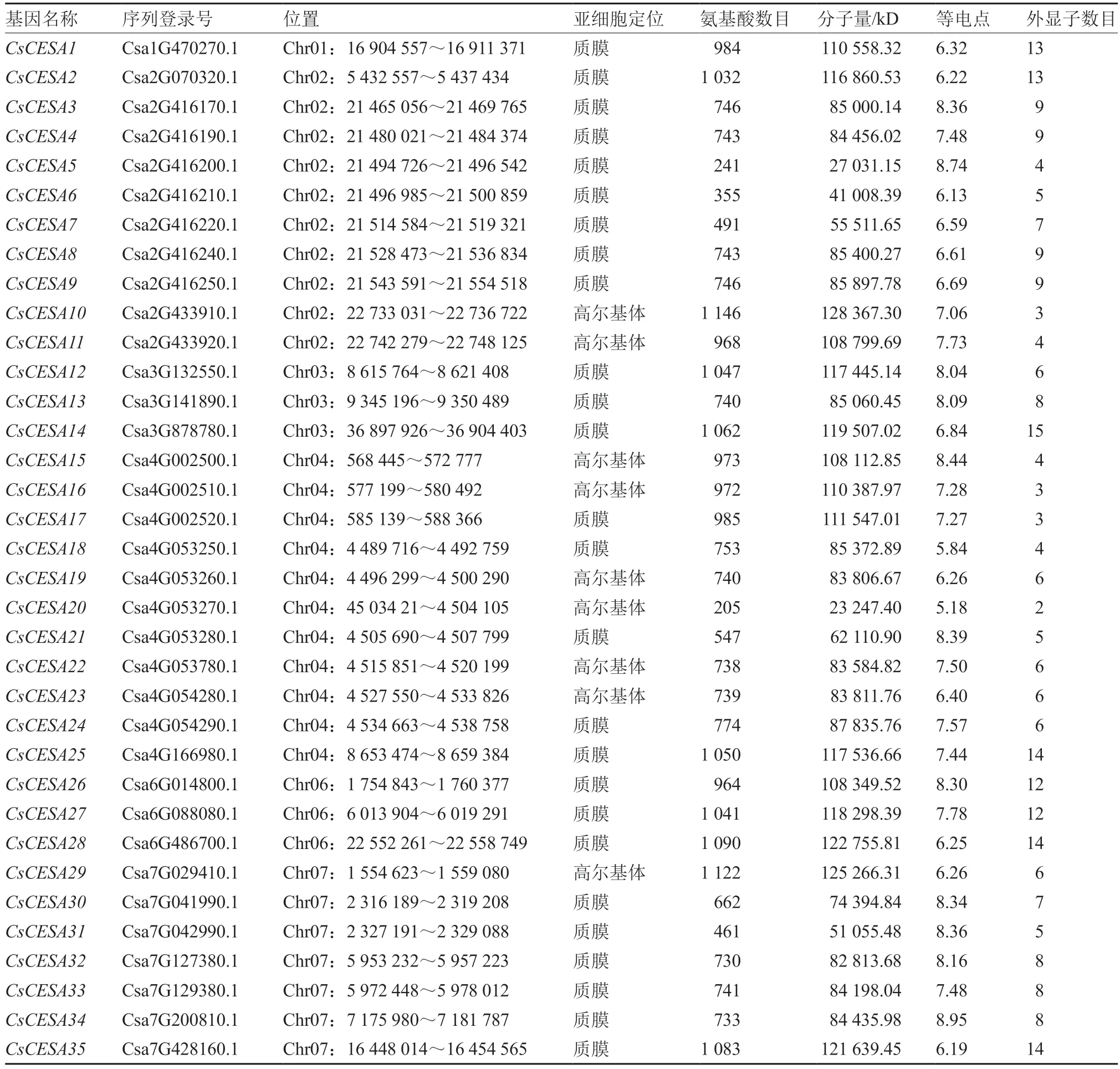
表2 黄瓜纤维素合成酶基因全基因组鉴定与分子特征分析
2.2 黄瓜纤维素合成酶家族基因结构和进化分析
通过网站GSDS 2.0 对黄瓜CESA 家族基因进行结构分析,如图2 所示:黄瓜CESA 基因家族外显子数目差异明显,外显子数目为2~15 个不等。其中含有2 个外显子,含有15 个外显子,分别有2 个成员含有7、12 个和13个外显子,分别有3 个成员含有3、5 个和14 个外显子,分别有4 个成员含有4、8 个和9 个外显子,分别有6 个成员含有6 个外显子。
利用在线网站MEME 对CESA 基因家族进行motif 预测,数量设置为10 个,其余参数选择默认。黄瓜的CESA 蛋白都含有该家族的保守结构域Cellulose-synt(PF03552),除了CsCESA5、CsCESA6、CsCESA20、CsCESA21 和CsCESA31分别含有3、4、3、6、5 个motif 外,其 余CsCESA 都含有7~10 个motif,这些motif 在基因家族中的分布表现出相似的模式,说明CESA 在进化过程中保守性较高(图2)。10 个motif 长度在27~50 个氨基酸之间,平均为36.2。

图2 黄瓜纤维素合成酶基因家族成员的系统进化和结构特征
为了分析黄瓜纤维素合成酶基因家族的进化关系,使用MEGA 7.0 软件和在线软件ITOL 对黄瓜(35)、拟南芥(10)、番茄(16)、西瓜(28)和甜瓜(33)中的CESA 基因家族蛋白序列进行系统进化树构建。如图3-A 所示,黄瓜、拟南芥和番茄CESA 基因家族成员被分为6 个group,其中group1、group2、group4 和group5 包含3 个物种的CESA 基因,group3 仅有黄瓜CESA 基因,group6包含黄瓜和番茄CESA 基因;如图3-B 所示,黄瓜、西瓜和甜瓜CESA 基因家族成员均匀地分布在6 个分支上(group1~group6)。

图3 不同作物纤维素合成酶基因家族的系统发育树
为了进一步了解黄瓜CESA 基因家族的进化关系,通过软件MCscanX 对黄瓜、拟南芥、番茄、西瓜和甜瓜中CESA 家族基因进行了物种间共线性分析。与、家族基因之间的同源性分析结果如图4-A 所示,和家族基因之间有15 个同源基因对;和家族基因之间有12 个同源基因对;就单条染色体上的共线性基因分布而言,黄瓜5 号染色体上无共线性基因;2、3、4、6 号和7 号染色体上共线性基因数量较多,为4~6 条;1 号染色体上共线性基因较少,为1 条。与、家族基因之间的同源性分析结果如图4-B 所示,和家族基因之间有19 个同源基因对;和家族基因之间有20 个同源基因对。就单条染色体上的共线性基因分布而言,黄瓜5 号染色体上无共线性基因;7 号染色体上共线性基因最多,为10 条;2、3、4 号和6 号染色体上共线性基因数量较多,为6~8 条;1 号染色体上共线性基因较少,为1 条。
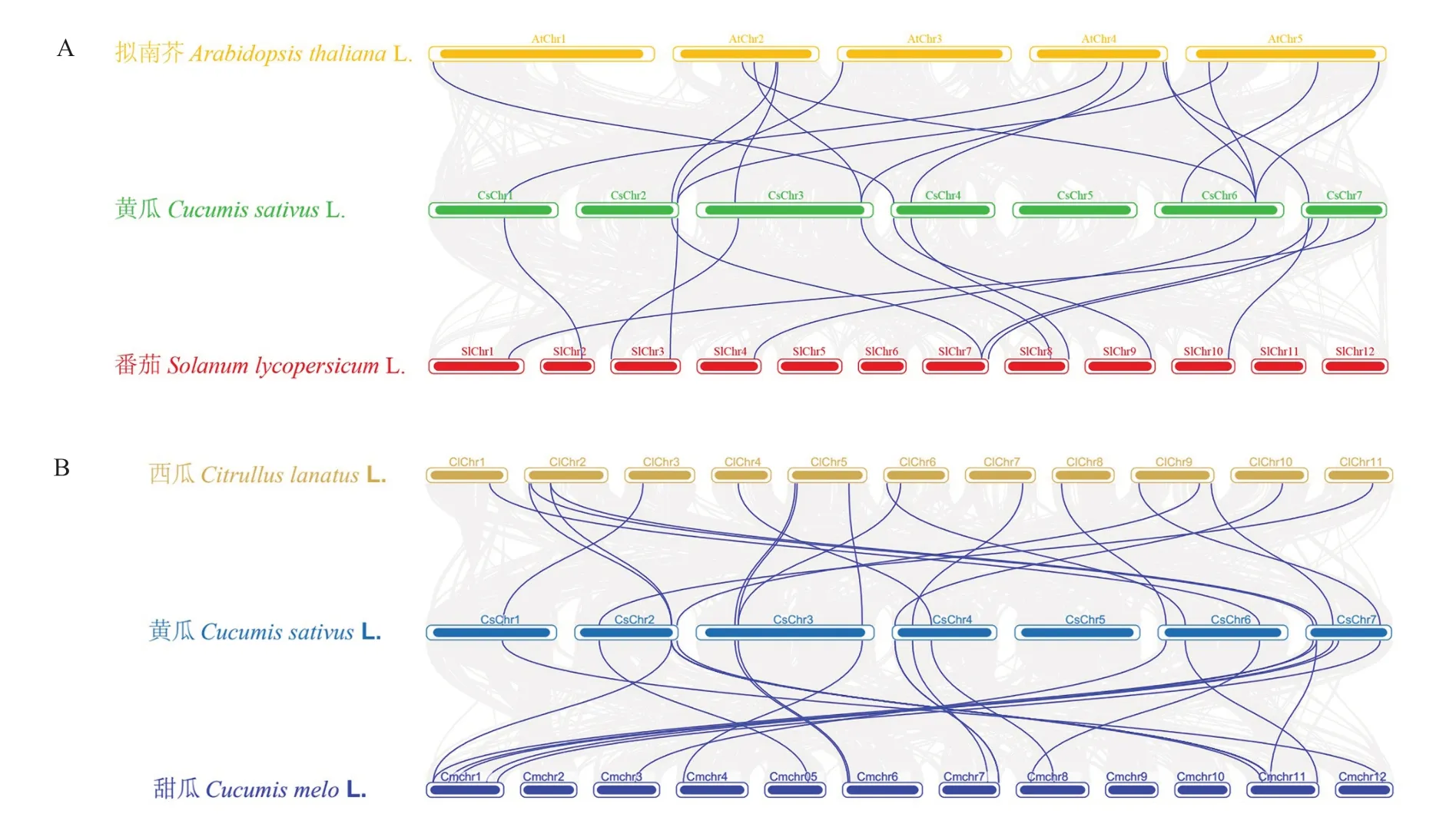
图4 不同作物纤维素合成酶基因家族的共线性分析
2.3 黄瓜纤维素合成酶家族基因启动子中顺式作用元件分析
为了更好地了解CESA 家族基因的调控机制,提取了CESA 家族中各基因的启动子区域(ATG 起始位点上游2 000 bp 的碱基序列),利用在线网站 PlantCARE 对启动子区域的顺式作用元件进行预测和分析,然后使用TBtools 软件对结果进行可视化(图5)。这些顺式作用元件包括光响应元件、防御和胁迫响应元件(干旱、低温)、植物激素响应元件(茉莉酸甲酯、脱落酸、赤霉素、生长素和水杨酸)、空间基因表达元件(分生组织、胚乳、种子细胞)和生物过程中涉及到的相关的响应元件(代谢、昼夜节律和细胞周期等),推测CESA 基因家族成员可能通过调控上游转录因子参与整合多种反应。
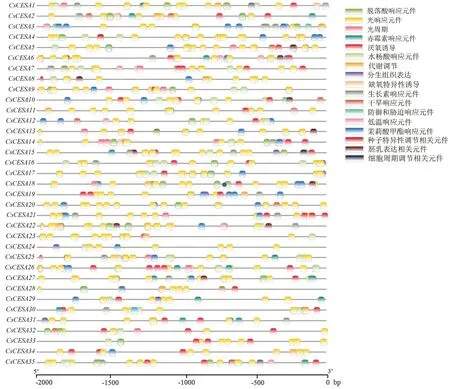
图5 黄瓜纤维素合成酶基因家族成员启动子序列顺式作用元件分析
2.4 黄瓜纤维素合成酶家族基因的组织表达分析
利用从黄瓜基因组数据库CuGenDB下载的10个黄瓜组织(根、茎、叶、受精子房、子房、雌花、未受精子房、雄花、卷须基部和卷须)的RNA-seq 数据,研究CESA 家族基因的组织表达情况,并将这些数据生成热图(图6-A)。、和在各组织中均有较高的表达水平;、、、、、、、、、、和在各组织中均有一定的表达水平;在除去根、在除去雄花、和在除去根和雄花、在除去根、卷须和卷须基部之外的各组织中均有一定的表达;、、、、、、和在各组织中的表达量比较低。以上结果表明了其成员功能的分化和组织表达的特异性。
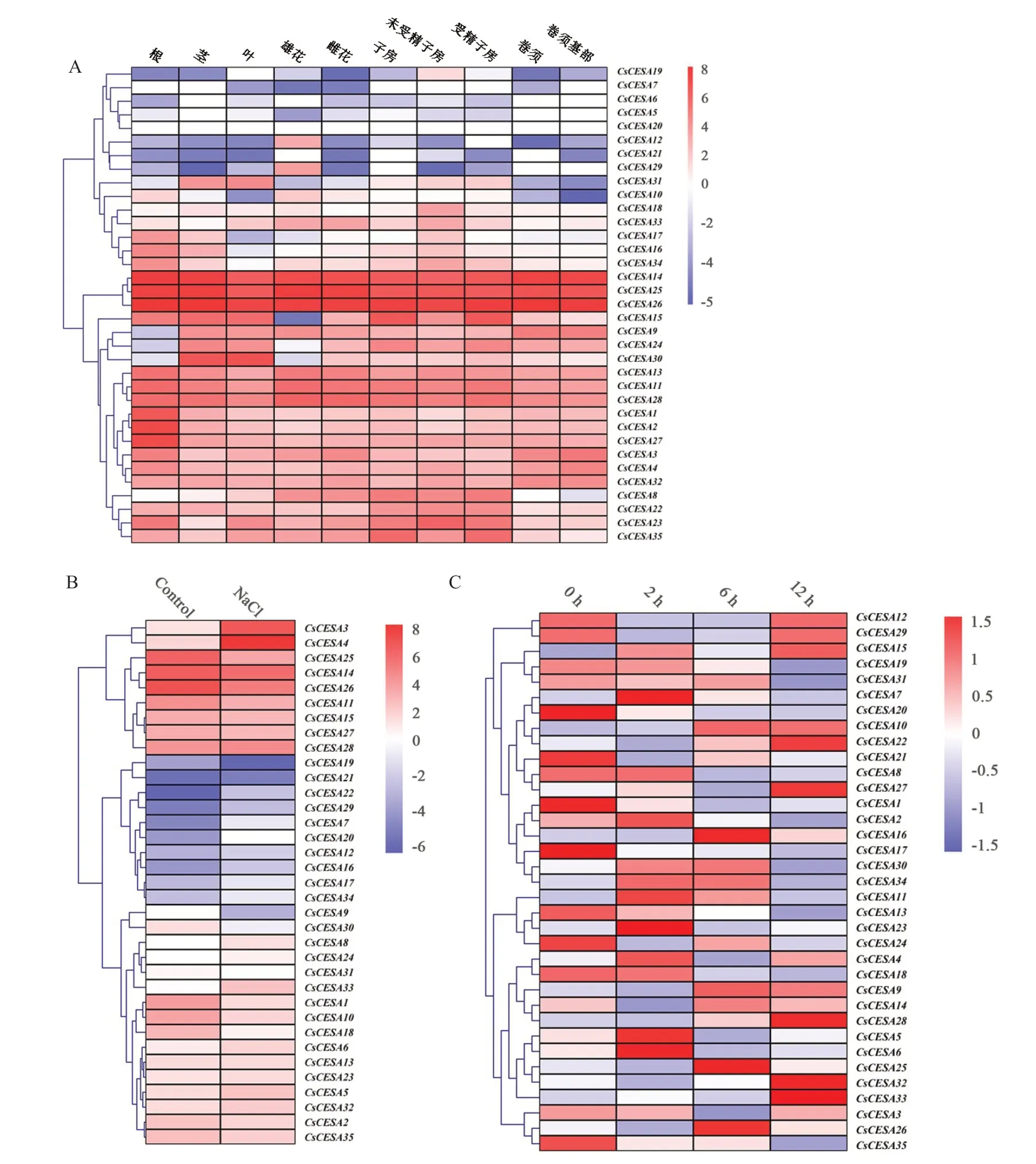
图6 黄瓜纤维素合成酶家族基因的表达模式
2.5 黄瓜纤维素合成酶家族基因在非生物胁迫和激素处理下的表达分析
利用黄瓜基因组数据库下载来自黄瓜幼苗在NaCl处理(PRJNA437579)以及低温胁迫(PRJNA438923)下的RNA-seq数据。如图6-B和6-C所示,大部分成员受NaCl和低温的诱导表达,在NaCl处理下,、、、、、、、、和下调表达;、、、和表达量没有明显变化;其余基因均上调表达。低温处理下,、、、、和上调表达;、、和在2h时上调表达;、和在2h和6h时上调表达;和在2h和12h时上调表达;、、、、和在6 h 和12 h 时上调表达;其余均下调表达或无明显表达差异。对不同非生物胁迫处理有不同程度的响应,表明其可能在黄瓜植株响应非生物胁迫的过程中发挥作用。
选取黄瓜CESA 基因家族中的、、、、、、和进行非生物胁迫和植物生长调节剂处理下的表达分析,利用qRT-PCR检测黄瓜品系9930在NaCl、ABA和MeJA不同时间梯度(0、3、6、12h和24h)处理下的表达谱,结果显示:以上基因不同程度地受到盐胁迫和植物激素ABA、MeJA的诱导。如图7所示,在NaCl处理下,除和表达量下降以外,其余基因均受NaCl的诱导上调表达。外施激素ABA处理下,从0~24h,和上调表达;和下调表达;和表达量先升高后下降;表达量先下降后升高;表达量先下降后升高再降低。MeJA处理下,从0~24h,、、和上调表达;在3h上调表达,之后表达量下调;在6h上调表达,24h表达量下调;在12h表达量上调;在12h和24h表达量下调。8个基因均能响应非生物胁迫(包括低温和盐胁迫)和植物激素(ABA、MeJA)的诱导(图6、7),其中、和表达量的峰值更高,表明这3个基因在黄瓜植株响应非生物胁迫的过程中更具有研究价值。

图7 黄瓜纤维素合成酶基因在非生物胁迫(NaCl、ABA 和MeJA)诱导下的 qRT-PCR 表达分析
3 讨论与结论
纤维素是植物细胞壁的主要成分,主要由36根β-1,4 糖苷链结晶而成的小微纤丝组成。纤维素合成酶(CESA)是一种与膜结合的糖基转移酶,可以催化UDP-葡萄糖形成β-1,4 糖苷链合成纤维素(Festucci-buselli et al.,2007)。纤维素合成酶被称之为“复合物的复合物”,其家族由多个成员组成(Somerville,2006)。近年来,人们对纤维素合成酶基因家族的研究集中于拟南芥、烟草等模式植物和棉花、杨树、亚麻、毛竹等木本植物,黄瓜中纤维素合成酶基因家族的系统鉴定和分析还未见报道。从前人的研究中可以发现不同物种的CESA基因家族成员的数量存在很大差异,拟南芥、烟草、水稻、毛果杨及四倍体海岛棉中分别鉴定出10、21、14、18个和37 个CESA(Richmond & Somerville,2000;Wang et al.,2010;袁红梅 等,2016;Yuan et al.,2016;徐宗昌和孔英珍,2017)。
本试验对黄瓜CESA 基因家族进行全基因组生物信息学分析,共鉴定出35 个CESA 基因家族成员,分布在除5 号染色体外的6 条染色体上,2、4、7 号染色体上分布较多,1、3、6 号染色体上分布较少,基因的不均匀分布可能与遗传变异和物种进化相关。CESA 家族成员含有的motif 数量差异不大,其分布表现出相似的模式,说明CESA 基因家族成员在进化过程中具有较高的保守性。CESA家族成员含有的内含子、外显子数量存在一定的差异,且所含有的氨基酸位点数量以及理化特征明显不同,表明CsCESA 蛋白可能在其自身的微环境中发挥不同的作用。在系统发育分析中,黄瓜、拟南芥和番茄CESA 家族成员被分为6 个group,其中group1、group2、group4 和group5 包含3 个物种的CESA 基因,group3 仅有黄瓜CESA 基因,group6包含黄瓜和番茄CESA 基因,说明该家族的主要特征极有可能在双子叶/单子叶分裂之前就已经产生并出现了分化;黄瓜、西瓜和甜瓜CESA 基因家族成员均匀地分布在6 个分支上,说明CESA 家族成员在葫芦科植物之间具有较高的结构和功能相似性。前人研究表明,基因复制的两种模式串联基因复制和片段基因复制被认为是进化过程中基因家族扩张的主要推动力。发生拷贝数变异的基因可能存在表达和功能上的分化,并在获得环境适应优势的过程中起着重要作用(Cannon et al.,2004)。本试验揭示了片段重复是负责CsCESA 基因家族进化的主要原因,经过物种内的共线性分析发现有3 对片段重复基因对,无串联重复基因对(图1)。
植物细胞壁除了人们常规认为的机械支持和物质运输的功能外,还可以对各种逆境胁迫做出响应。植物细胞壁响应逆境胁迫是个复杂的生理生化过程,细胞壁的多种成分均参与响应的机制,表现为:细胞壁组分的含量和结构的变化,包括细胞壁多糖、细胞壁蛋白和酶以及质外体小分子物质,以上这些变化都是通过一系列相关酶的有序调节而实现的(Endler et al.,2015)。在植物中,CESA 基因家族成员具有较高的系统发育相似性,但是在不同物种中的时空表达模式不同,表达水平和表达种类具有明显的组织特异性,对植物生长发育的调控也存在功能分化的现象(Hill et al.,2015;李秀云 等,2017;徐宗昌和孔英珍,2017)。前人研究结果表明,植物中纤维素含量的变化会引起植物对非生物和生物胁迫的响应,在拟南芥中,纤维素合成酶基因的突变导致纤维素含量减少,进而影响乙烯和茉莉酸甲酯信号途径、病原微生物侵染、损伤诱导和干旱胁迫相关基因的表达(Ellis et al.,2002)。拟南芥的基因耐旱突变体可以通过调节脯氨酸、可溶性糖、ABA 含量和纤维素的转化比例来调节植物的渗透能力,从而增强植物对干旱和渗透胁迫的耐受性(Chen et al.,2005)。本试验中,低温和盐胁迫对基因有不同的调控作用,基因可能通过相同或者不同的调节机制来响应这些非生物胁迫。例如在低温胁迫下上调表达,在盐胁迫下下调表达,在低温胁迫下下调表达,在盐胁迫下上调表达,这些数据表明,和通过不同的机制对相同的胁迫做出反应。和在低温和盐胁迫下均下调表达,表明它们可能享有相同的调节机制或途径。盐胁迫处理下,、和未检测到表达变化。说明CESA 基因能够广泛参与多种逆境胁迫的适应过程。
植物激素信号传导网络对于植物逆境响应至关重要。ABA 在植物对低温和盐胁迫的响应中起着至关重要的作用(Suzuki et al.,2016)。茉莉酸(JA)及其甲酯(MeJA)是内源性信号分子,在调节胁迫响应和植物发育中起着关键作用(Fung et al.,2004)。本试验中,大多数基因受到ABA和MeJA 的诱导表达,尤其是,表达量上调的倍数最高。以上结果表明,基因家族可能在各种植物激素之间的串扰中起关键作用。本试验中、和能够响应非生物胁迫(包括低温和盐胁迫),此外,它们能够受到ABA(一种整合各种胁迫信号并控制下游应答的激素)和MeJA(一种参与非生物胁迫的信号分子)的诱导表达,且这3 个基因的表达量相对较高。与和同源性最高的和的基因功能还未明确;与同源性最高的在种子粘液中的纤维素生成中起着重要的作用(Sullivan et al.,2011),并且在根组织中能受到干旱胁迫的诱导从而使表达量上调(Heidari et al.,2019)。因此,黄瓜中、和响应非生物胁迫的分子机制尚需进一步深入研究。
本试验从9930_V2 版本基因组中鉴定到35 个CESA 基因,并对其进行了生物信息学分析和表达模式分析。在植物生长和发育过程中,基因具有明显的组织表达差异性,协同调控了黄瓜的生长发育。基因的表达对非生物胁迫和植物激素处理的反应不同,其中、和均能响应非生物胁迫(包括低温和盐胁迫)和植物激素(ABA 和MeJA)的诱导,说明它们是应激反应中潜在的关键调控因子。本试验结果有助于了解基因在黄瓜响应非生物胁迫过程中的作用,推动CESA 基因家族的研究与发展,接下来的试验应进一步研究、和响应非生物胁迫的分子机制,减少非生物胁迫对黄瓜以及园艺植物生产的影响。
