“探秘加碘盐”复习课的项目式教学实践
2022-04-02葛海祥
葛海祥




摘要:基于项目开展氧化还原反应的复习,以“探秘加碘盐”为项目,以补碘剂的选择、补碘剂的性质预测、补碘剂的实验探究为学习任务,呈现项目式学习的教学设计思路和实践过程,并总结基于项目式学习开展复习课的课堂特色。
关键词:氧化还原反应;项目式学习;加碘盐
文章编号:1008-0546(2022)04x-0067-04
中图分类号:G632.41
文献标识码:B
doi:10.3969/j.issn.1008-0546.2022.04x.019
一、项目主题分析
项目式学习,是以建构主义理论为指导,以小组合作方式进行规划和解决项目任务的学习方式。已有对项目式学习案例和效果的影响研究表明,项目式学习在学生学业成绩、问题解决能力、学生参与度、学习兴趣及合作和解决冲突技能等方面都有很大地促进作用[1]。氧化还原反应是高中化学课程的重要内容,并作为核心概念贯穿高中化学学习的始终。《普通高中课程标准(2017年版(2020年修订)》中提到“能利用典型代表物质的性质和反应,设计常见物质的制备、分离、提纯、检验等简单任务的方案,能从物质类别和元素价态变化的视角说明物质的转化途径”[2]。笔者认为在氧化还原反应新课教学后安排一节基于项目式教学的复习课,既能帮助学生形成氧化还原反应的整体观,建构氧化还原反应的认识视角,又能落实课标要求。“探秘加碘盐”项目贴近生活,接近学生,可操作性强,涉及的物质化合价丰富,是开展氧化还原反应项目式学习的很好载体。在教学中,通过将项目拆解成“补碘剂的选择”“补碘剂的性质预测”“补碘剂的实验探究”三个任务展开,将生活中的实际问题转化为化学问题,在问题解决过程中应用氧化还原反应的认识模型、性质比较方法模型,根据类别和价态预测物质性质,并会选择试剂来检验,能与同学合作设计实验方案,展开实验研究,逐步形成物质性质研究的一般思路,发展科学探究与创新意识核心素养,学会将复杂的实际问题转化为化学问题,感悟化学学科魅力。
二、项目教学目标
结合课程标准的内容要求、学业要求和学情,教学目标如下:
1掌握氧化还原反应的发生原理,厘清几组概念(培养模型认知素养);
2能根据核心元素的价态来预测新物质的性质,认识物质之间的相互转化(培养证据推理素养);
3能从氧化还原反应视角分析物质,并尝试运用氧化还原的认识模型和方法模型解决问题(培养模型认知素养);
4在探秘加碘盐过程中,逐步形成“提出问题—猜想假设—实验分析—得出结论”的科学探究思路
(培养科学探究、创新意识素养)。
三、项目教学流程
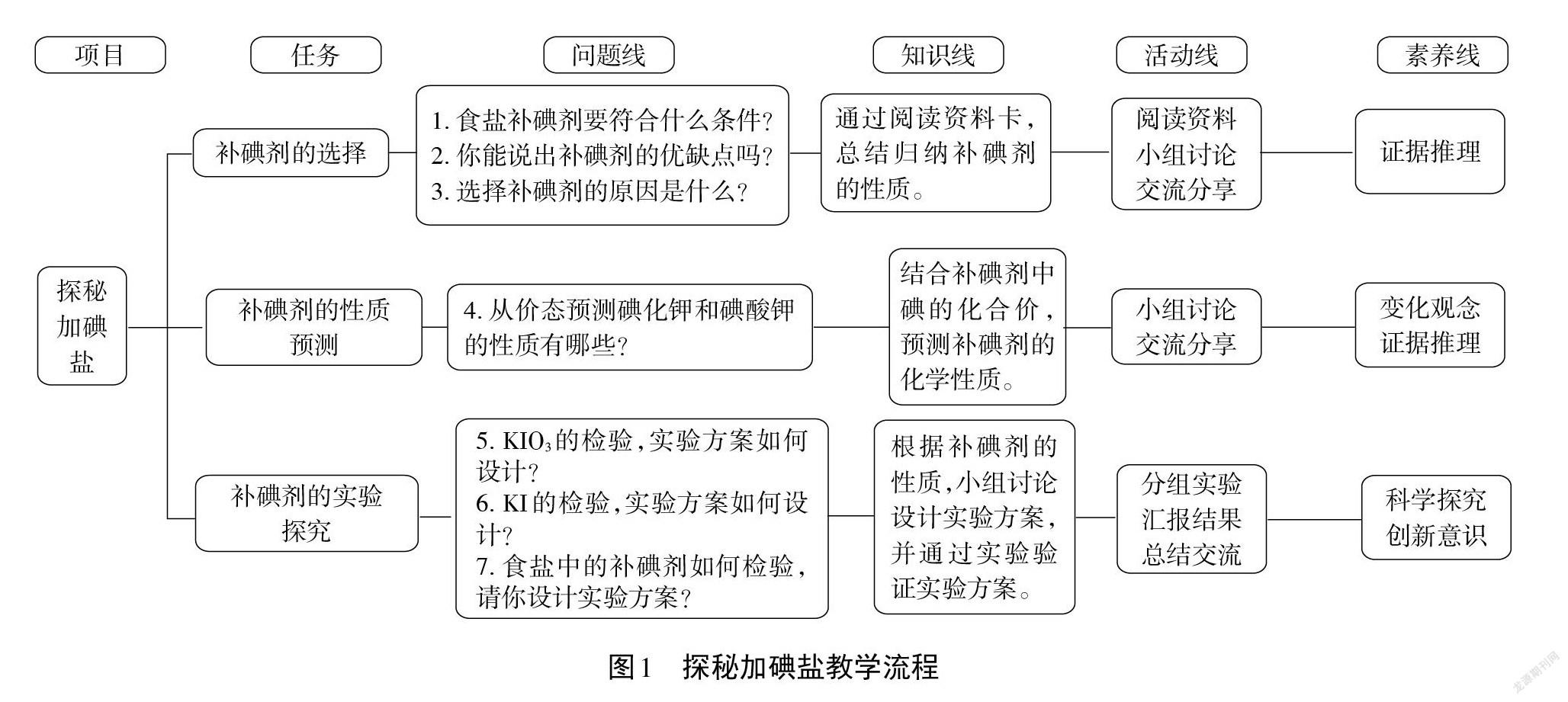
依据项目式教学活动设计特点和教学目标,以探秘加碘盐为活动载体,设计三个任务:补碘剂的选择、补碘剂的性质预测、补碘剂的实验探究。在任务探索的过程中体会氧化还原的认识模型和方法模型在认识陌生物质性质及其应用中的重要价值。具体教学流程(见图1)。
四、项目学习过程
[问题引入]你知道食盐中为什么加碘吗?[学生观点]补碘、防止大脖子病......
[任务1]补碘剂的选择。
[问题深入]阅读资料(见表1),世界各国对加碘盐进行多项规定,我们观察发现加碘盐中主要涉及的碘的化合物有两种:KI、KIO3。你认为食盐补碘剂要符合什么条件?
[学生观点]是否可食用、稳定性、价格、味道、对人體的影响等。
[驱动问题]补碘剂的选用一般考虑碘酸钾或碘化钾,结合资料卡1,你觉得二者的优缺点分别在什么地方?
[资料卡1]碘化钾(KI)是白色立方结晶或粉末。无毒,在潮湿空气中微有吸湿性,久置析出游离碘而变成黄色,并能形成微量碘酸盐。在水中溶解度:20°C时140g。其水溶液也会氧化而渐变为黄色,可加少量碱防止氧化。碘酸钾(KIO3)是无色或白色结晶粉末,无臭,无毒。能溶于水和碘化钾水溶液、稀硫酸,不溶于乙醇和液氨。在水中溶解度:0°C时4.74g,100°C时32.3g。常温下较稳定。
[学生观点]二者都无毒,KI的水溶性好,KIO3的水溶性不好,KI稳定性比KIO3差。选用KI作为补碘剂一般要考虑加入一些稳定剂(碱性物质)。
[反思评价]学生结合信息能够分析出KI、KIO3的差异。
[驱动问题]补碘剂的选择还需要考虑盐的组成,结合资料卡2,你觉得他们选择补碘剂的原因是什么?
[资料卡2]关于补碘剂的选择一般还需要考虑盐的成分,若原盐中含有还原性杂质,如Fe2+等成分较多时,则不宜选用KIO3作为加碘剂,选用Kl作为加碘剂更好;若原盐中含有氧化性杂质较多时,如Fe3+等,则不宜选用Kl作为加碘剂,选用KIO3作为加碘剂更好。
[学生观点]如果原盐中含有Fe2+会和KIO3发生反应,则此时应该选择Kl,而原盐中含有Fe3+会和KI发生反应,则此时应该选择KIO3。少部分学生发现,还原性物质会与KIO3发生反应,证明KIO3具有氧化性;氧化性物质会与KI发生反应,证明KI具有还原性。
[反思评价]结合资料,学生可以发现选用补碘剂的两种具体情况,但是在深挖碘化钾具有氧化性和碘酸钾具有还原性的过程中,需要教师引导。
[任务2]补碘剂的性质预测。
[驱动问题]从价态预测碘化钾和碘酸钾的性质有哪些?
[学生观点]碘化钾中碘-1价,具有还原性,可尝试使用氧化剂检验,如:O2、H2O2、KMnO4、Fe3+;从化合价角度,碘酸钾中碘+5价,既具有氧化性又具有还原性,针对氧化性可尝试使用还原剂检验,如:CO、H2、金属单质(Fe、Cu),针对还原性与碘化钾类似。
[反思评价]学生探究两种陌生的物质碘化钾与碘酸钾,引导学生从核心元素价态的视角分析二者的区别,+5、-1,并尝试运用氧化还原的方法检验出这两种物质。
[任务3]补碘剂的实验探究。
[驱动问题]KI的检验,实验方案如何设计?[学生设计]学生设计实验方案(表2)。
[反思评价]学生们检验KI思路基本一致,将KI氧化为I2,再通过淀粉溶液检验碘单质的存在,运用氧化还原反应的知识分析出KI具有还原性,设计加入氧化剂检验。
[驱动问题]KIO3的检验,实验方案如何设计?
[学生设计]学生设计实验方案(表3)。
[学生汇报]无明显现象,碘酸钾和碘化钾没有发生反应。再滴加2-3滴稀硫酸溶液,出现蓝色。说明有碘单质生成。
[教师追问]我们加入硫酸就能看到蓝色,那么硫酸在这里有什么作用呢?
[学生观点]硫酸氧化了KI,产生I2,所以产生蓝色;硫酸作为一种催化剂,催化反应;硫酸提供了一种酸性环境。
[反思评价]实验中加入硫酸使得反应更容易发生,说明氧化性和还原性会受到环境的影响(酸碱性、温度等)。
[驱动问题]食盐中补碘剂如何检验,请你设计实验方案?
[学生设计]学生设计实验方案(表4)。
[评价反馈]学生在分析了KI、KIO3的基础上很快设计出实验方案,在小组讨论中,学生觉得KI的加入也有可能被溶液中氧气氧化而产生碘单质使淀粉变蓝。所以第二小组的学生提出增加空白实验对照组,实验方案更加科学严谨。
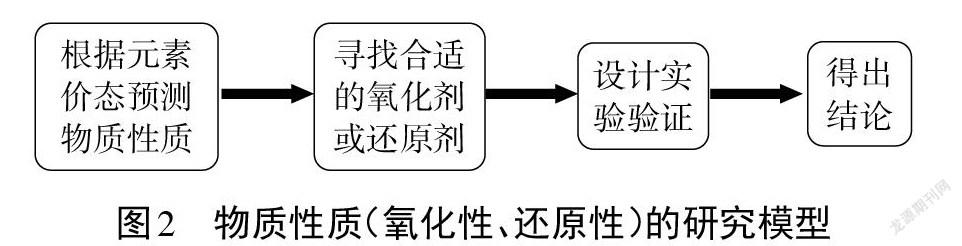
[归纳总结]对于陌生物质的研究,我们可以站在化合价的角度预测物质可能存在的性质,并通过理论分析寻找合适的氧化剂或还原剂,设计实验验证,最终得出结论。物质性质(氧化性、还原性)的研究模型(见图2)。
[评价反馈]学生通过前面問题地解决,知道碘酸钾和碘化钾的检验方法,知道从化合价角度分析其氧化性和还原性。在小组合作实验的过程中,培养学生的动手操作能力和团队合作精神,在项目探究的最后,教师帮助学生得出物质性质(氧化性、还原性)的研究模型,将知识内容升华,将知识能力内化,促进学生形成一定的探究模型,达到科学探究的学科素养。
[课堂收获]畅所欲言,谈一谈本节课你有哪些收获?
[学生收获1]熟悉了碘的存在形式,碘的相关化合物的检验方法。
[学生收获2]研究陌生物质的性质可以从物质类别和价态两个角度去分析。
[学生收获3]学会了用实验探究的方法验证假设是否正确,并且需要注重实验方案的严谨。
五、项目学习特色
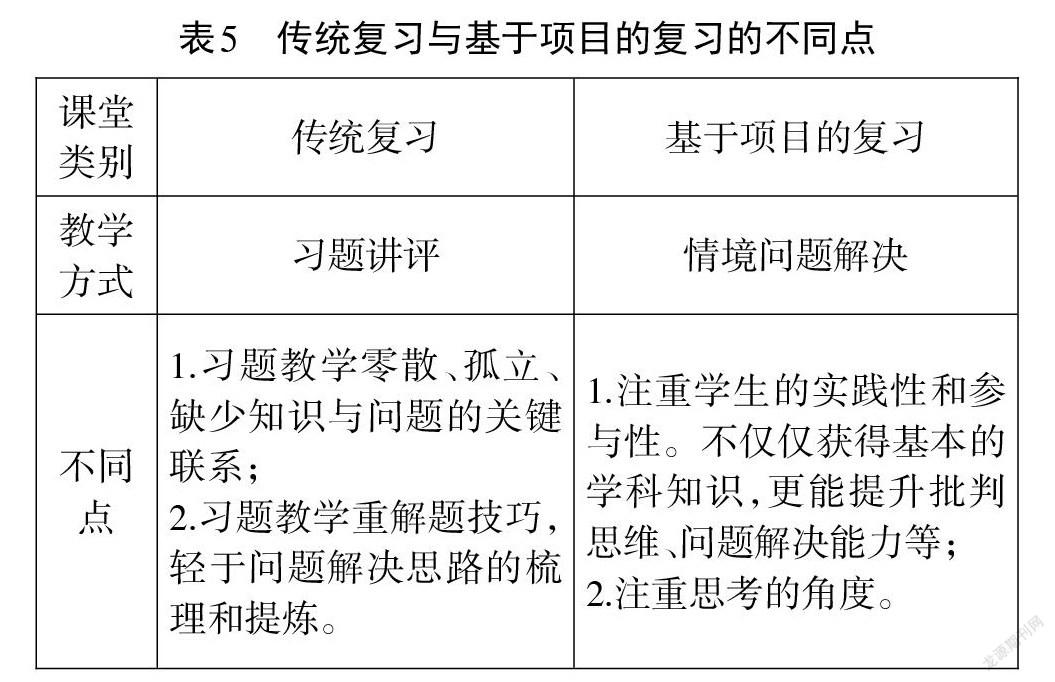
氧化还原反应的复习,在学生学完氧化还原的基本概念和规律后,是一次运用项目式学习进行复习教学的尝试。传统氧化还原复习主要进行习题讲评,对比两种复习课的呈现方式,我们可以发现许多不同点(见表5)。
以“探秘加碘盐”为项目的复习课堂,将该项目拆解为补碘剂的选择、补碘剂的性质预测、补碘剂的实验探究三个课堂任务,在任务解决的过程中设置驱动性问题引发学生的思考与思维的碰撞,在思考问题的同时提取氧化还原的基本概念和规律并尝试解决问题。比如:在性质预测时,学生需要结合元素化合价提出其可能的性质;在设计实验方案时学生需要分析氧化还原的反应规律;在进行实验论证时学生需要结合实验现象归纳整理实验结论。因此在项目式学习过程中知识得到了整合运用,学生对知识内容的认识更加系统化。
氧化还原反应项目学习以学生为主体,通过“探秘加碘盐”的项目研究,让学生在真实的问题情境中去实践,注重学生的实践性和参与性,不仅可以获得基本的学科知识,而且在探究和解决问题的过程中获得基本知识和技能,关键能力和必备品格,有利于学生学科核心素养的发展。
此外,教师是学生在项目学习中的合作者,引导学生选择合适的解决问题的思路和方法。教师需要不断地和项目学习小组成员沟通,请他们汇报合作学习结果、分析答题思路或对其他同学的思路方法进行点评等。教师通过追问、评价和示范等行为有效促进学生用化学知识解决问题,使得课堂中师生互动触及高阶思维。课堂中师生互动更加有效,将化学知识融入生活,让化学学科知识有了人情味。
参考文献
[1]侯肖,胡久华.在常规课堂教学中实施项目式学习——以化学教学为例[N].教育学报,2016-8-12(4).
[2]中华人民共和国教育部.普通高中化学课程标准(2017年版2020年修订)[S].北京:人民教育出版社,2020:2.
