即食干发酵香肠生产过程中干预措施对沙门氏菌的影响及其应激机制研究进展
2022-04-01向显玉刘爱平刘书亮敖晓琳
向显玉,黄 静,刘爱平,周 康,刘书亮,敖晓琳,*
(1.四川农业大学食品学院,四川 雅安 625014;2.千禾味业食品股份有限公司,四川 眉山 620010)
干发酵香肠一般可作为即食发酵肉制品,在世界范围内深受消费者喜爱。传统干发酵香肠主要以自然发酵为主,存在一定的食品安全隐患[1],同时由于干发酵香肠的营养丰富,且其传统生产过程没有灭菌处理,所以容易存在沙门氏菌污染,成为食源性疾病的食品来源之一。本文对即食干发酵香肠生产过程中沙门氏菌的污染现状、生产过程中对沙门氏菌的减菌措施及减菌效果以及沙门氏菌对减菌措施的应激机制进行综述,以期为即食干发酵香肠生产过程中沙门氏菌减菌措施的选择,以及开发新型的沙门氏菌减菌措施提供一定的参考。
1 干发酵香肠特点及沙门氏菌污染现状简介
1.1 干发酵香肠及其特点
干发酵香肠一般可作为即食发酵肉制品,在世界范围内深受消费者喜爱。干发酵香肠的传统生产方式通常是将瘦肉(一般是猪肉或牛肉)与脂肪(一般是猪肉脂肪)按质量比2∶1切碎后与香料、盐、糖、发酵剂混合,然后将混合物装入不同直径的肠衣中,经发酵、干燥、烟熏或不烟熏制成[2]。发酵剂通常是单一种类的乳酸菌(lactic acid bacteria,LAB)或与其他微生物(葡萄球菌、霉菌和酵母等)混合的LAB。发酵过程中,LAB生长可以将糖转化为乳酸,引起pH值降低[3]。发酵的温度通常为15~26 ℃,相对湿度为90%左右;干燥成熟过程一般采用自然风干或梯度降温降湿等方式,温度一般在12~15 ℃,相对湿度比香肠内相对湿度低5%~10%,发酵和干燥结束后通常会使干发酵香肠的水分质量分数降至35%左右,且水分活度(water activity,aw)不高于0.90[4-6]。但是不同地区的干发酵香肠具有不同特点,其主要类型及特点如表1所示。
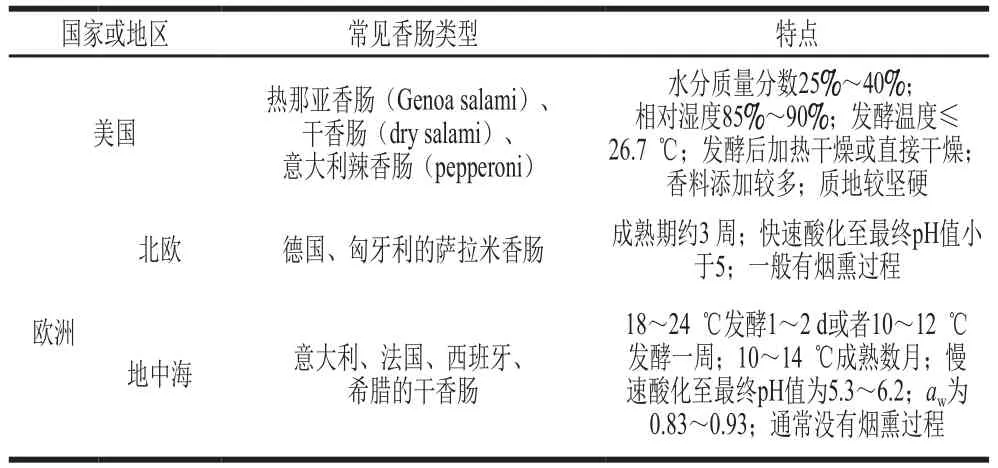
表1 干发酵香肠的主要类型及其特点[4,7-8]Table 1 Major types and characteristics of dry fermented sausages[4,7-8]
1.2 干发酵香肠传统生产过程中沙门氏菌的污染现状
沙门氏菌是一种人畜共患病原体,通常在食用受污染的食物时传播给人类,也可以通过与动物或其环境接触传播,沙门氏菌是引起欧盟和欧洲经济区食源性疾病的重要原因[9]。人类感染的最常见感染源是动物源性食品,猪肉是最主要的来源之一[10]。被沙门氏菌污染的即食发酵肉制品也会引起食源性疾病,早在1990年,美国食品安全检验局就开始对即食食品进行沙门氏菌检测[11]。最近几年,欧盟的沙门氏菌流行率呈现上升趋势,2015年沙门氏菌占食源性疾病暴发原因的10%左右,2016年以及2017年均超过20%,2018年突破30%。其中沙门氏菌主要出现在新鲜猪肉、牛肉、鸡肉样品及其相关肉制品中[12-14]。在美国,2015—2017年由沙门氏菌引起的食源性疾病均超过总病例的30%,其中由猪肉引起的病例占10%~20%[15-17]。
在干发酵香肠的传统生产过程中,沙门氏菌的潜在来源可能包括受污染的生肉、添加成分、加工设备、后处理过程和加工人员等。近年来,干发酵香肠中的沙门氏菌仍有较高的检出率,如表2所示,这可能是猪肉发酵香肠成为沙门氏菌病主要来源的一个重要原因[3]。

表2 干发酵香肠中沙门氏菌的检出率Table 2 Detection rates of Salmonella in dry fermented sausages
有研究表明,pH值、aw和微生物种类以及发酵和干燥条件的组合阻止了干腌火腿生产过程中沙门氏菌的生长并可以在4 ℃下35 d的保质期内控制食源性病原体[21]。这表明干发酵香肠的传统生产过程也可能对沙门氏菌的生存造成一定的威胁,例如在发酵过程中,发酵剂引起的pH值降低,干燥成熟过程中水分质量分数和aw的降低、渗透压升高等。干发酵香肠传统生产过程中沙门氏菌数量的减少量如表3所示。

表3 干发酵香肠传统生产过程中沙门氏菌数量的减少量Table 3 Reduction of Salmonella in traditional production of dry fermented sausages
由表3可知,传统发酵过程可以一定程度上减少沙门氏菌,但其减少量均低于美国农业部规定的即食肉制品发酵过程中沙门氏菌减少7.0(lg(CFU/g))的目标[26],并且沙门氏菌能够耐受干腌生产过程中的严苛条件,存活于最终的产品中。这种现象可能缘于沙门氏菌对食品加工的苛刻条件所产生的耐受机制,并且干肉制品中食源性病原体的持久存在可能会促进高传染性食源性病原体向人类传播,增加食源性疾病的暴发次数[27]。因此,对干发酵香肠传统生产过程进行改进或者施加额外的沙门氏菌减菌处理对保证干发酵香肠的最终品质十分必要。
2 干发酵香肠生产过程中对沙门氏菌的干预措施
除了干发酵香肠的传统生产过程本身对沙门氏菌的减少,额外进行的对沙门氏菌的干预措施主要可分为物理干预、化学干预、生物干预以及联合处理。不同干预措施的减菌效果及其特点如表4所示。
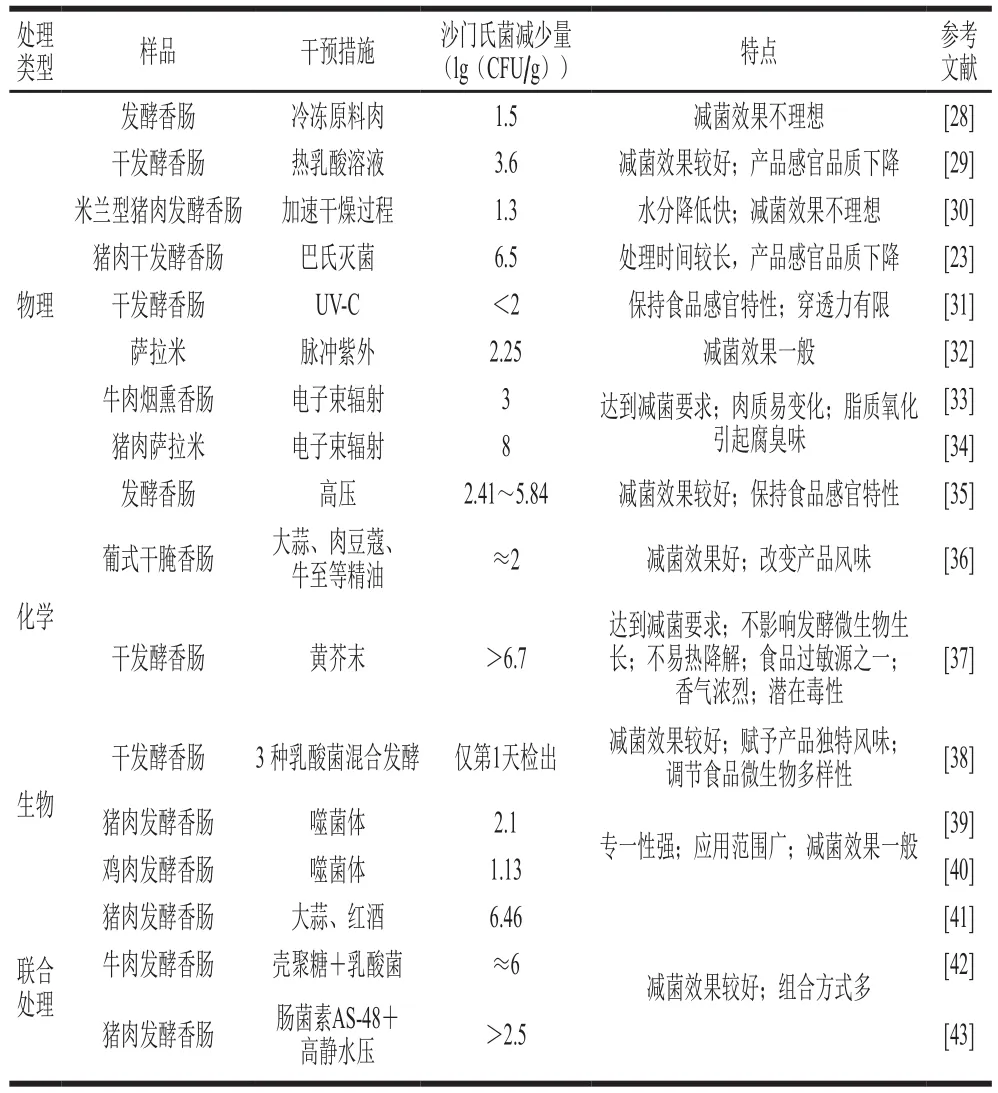
表4 不同干预措施对发酵香肠中沙门氏菌的减菌效果及特点Table 4 Efficiencies and characteristics of different intervention measures for reducing Salmonella in fermented sausages
由表4可知,物理干预中电子束辐射效果最好,可以达到即食食品中沙门氏菌减少7.0(lg(CFU/g))的目标,高压处理的减菌效果次之。对原料肉进行冷冻处理并不能有效减少沙门氏菌的数量。此外,热乳酸处理原料肉虽能一定程度上减少沙门氏菌,但在Blagojevic等[29]的研究中,热乳酸处理的温度较高(90、85、80 ℃),发酵香肠的感官品质下降较明显。加速干燥过程是对传统生产过程进行改进,使香肠中的水分快速降低,但其对沙门氏菌的减菌效果并不理想。巴氏杀菌在美国已经被商业化地应用于即食食品的减菌处理[26],但对干发酵香肠进行巴氏杀菌的研究较少,其减菌效果能达到美国农业部的要求,但长时间的处理会使沙门氏菌处于亚致死状态,诱导其热应激反应并且会对产品品质造成不良影响。此外,紫外线辐射(紫外-可见光和脉冲紫外)的处理效果一般,这可能与其有限的穿透力有关。巴氏杀菌、紫外-可见光、电子束辐射、高压处理、脉冲紫外处理主要是对成熟后的香肠进行处理,在包装之前对产品进行减菌处理,可以有效降低交叉污染的风险。
据报道,植物精油对干腌肉中沙门氏菌的抑菌效果较好[37],但会导致食品的风味变化,并且使用时需要考虑消费者对其接受程度。黄芥末在发酵香肠中的抑菌应用较少,Zuo Huizi等[37]的研究表明,添加黄芥末不会对发酵微生物的生长产生影响,但由于其不易热降解,是食品过敏源之一,同时具有浓烈的香气以及潜在的毒性,所以对于其在食品加工方面的应用应该采取谨慎的态度。
生物减菌方式主要有两种,包括改善发酵剂组成以及在原料中添加噬菌体。据报道,利用多种乳酸菌复配发酵可以有效降低意大利干发酵香肠中沙门氏菌和单增李斯特菌的数量[44]。噬菌体在食品中的减菌应用已经非常广泛,包括牛奶、猪肉、牛肉、发酵香肠[40,45-46]等,但据Huang Chenxi[39]以及Galarce[40]等的研究结果显示,噬菌体对发酵香肠中沙门氏菌的减菌效果并不明显,其减菌效果受样品储存温度以及噬菌体效价和细菌计数的比值的影响较大。
联合减菌措施的组合方式较多且减菌效果较好,例如Patarata等[41]的研究表明,单独红酒处理和红酒与大蒜混合处理对沙门氏菌的减菌效果几乎一样,但后者的降低速度更快,所以对于一些生产周期较短的干发酵香肠来说,红酒和大蒜混合处理的减菌方式具有一定的应用前景。总的来说,联合处理的减菌效果较好,且组合方式多样,有望开发出减菌效果更好且对干发酵香肠特性影响更小的组合方式。
3 沙门氏菌对不同干预措施的应激机制
研究沙门氏菌在食品加工过程中的应激机制,这对选择合适的灭菌方法以及开发新型的灭菌方式有重要的指导意义。沙门氏菌在干发酵香肠生产过程的主要环节所面临的环境胁迫因子如图1所示。沙门氏菌能够适应各种环境压力,并得以存活和/或生长[47]。沙门氏菌经某种不利条件的长时间胁迫后,对该不利条件的适应性增强,称之为沙门氏菌的同源性保护作用;经某种不利条件的长时间胁迫后,对其他不利环境条件的适应性增强,称为沙门氏菌的交叉性保护作用。沙门氏菌一般可以通过这两种保护作用适应不利的环境条件[48]。

图1 沙门氏菌在干发酵香肠主要生产环节所面临的环境胁迫因子Fig. 1 Environmental stress factors for Salmonella in the main production stages of dry fermented sausages
3.1 沙门氏菌对酸的应激机制
低pH值环境可以引起细胞膜电位变化,损伤细胞膜功能以及抑制细胞内某些重要酶的活性,阻断酶促反应和影响营养传递系统[49]。沙门氏菌的酸应激机制与菌株差异、菌株生长阶段、胁迫时间、温度以及酸的种类等相关[49]。其在低pH值环境中主要通过以下3 个方面维持自身稳定:一是维持细胞内的pH值稳态;二是合成酸性休克蛋白(acid shock proteins,ASPs)以保护和修复自身DNA和蛋白质;三是改变细胞膜组成,以抵抗酸性环境[50-51]。
沙门氏菌主要通过赖氨酸脱羧酶和精氨酸脱羧酶系统维持细胞内pH值稳态,赖氨酸脱羧酶系统由赖氨酸脱羧酶(CadA)和赖氨酸/尸胺反向转运蛋白(CadB)以及转录调节因子(CadC)组成;精氨酸脱羧酶系统由精氨酸脱羧酶(AdiA)、精氨酸/胍丁胺逆向转运蛋白(AdiC)和转录激活因子(AdiY)组成。低pH值条件下,CadC可以充当信号传感器并激活赖氨酸脱羧酶系统,CadA消耗H+将细胞内赖氨酸转化为尸胺,从而升高细胞内pH值,CadB排出尸胺以换取胞外的赖氨酸,使整个过程得以持续进行。而精氨酸脱羧酶系统是由转录因子AdiY激活,AdiA消耗H+将精氨酸转化为细胞质中的胍丁胺,升高细胞内pH值,之后由AdiC排出胍丁胺以换取外部精氨酸[50,52]。同时,酸信号也可以诱导三羧酸循环相关基因prpBC以及ribH(核黄素合酶编码基因)的表达上调,促进乙酰辅酶A的消耗,防止细胞内pH值进一步下降[53]。
沙门氏菌对数期的耐酸机制主要与ASPs的合成有关,可分为σS依赖的ASPs和非σS依赖的ASPs,由rpoS基因编码的σS本身就是一种ASPs,但同时也调控着对数期酸诱导的至少10 种ASPs,包括sodCII和功能未知的OsmY、YciE、YajQ等,同时σS的积累可能受MviA的间接调控,而由ClpXP蛋白酶直接降解σS[27,50]。非σS依赖的ASPs主要由Fur、PhoP控制。Fur与细菌同化或吸收外源铁的调节相关,其直接或间接地正调控几种ASPs,赋予菌体对有机酸胁迫的保护作用[49,52];PhoP是PhoQ/PhoP双组分调节系统中的组件,也是一种ASPs,其主要响应无机酸胁迫[53]。此外,OmpR是OmpR/EnvZ双组分调节系统中的反应调控因子,磷酸化的OmpR是稳定期酸耐受的一种ASP,其诱导不需要σS,OmpR可以通过一种依赖于DNA拓扑结构改变的机制来控制沙门氏菌特异性基因的表达[54]。
酸处理后,沙门氏菌细胞膜组成的变化主要包括不饱和脂肪酸(unsaturated fatty acid,UFA)与饱和脂肪酸(saturated fatty acid,SFA)含量比值的改变以及大部分UFA转化为其环状衍生物环丙烷脂肪酸(cyclopropane fatty acids,CFA),其形成与cfa基因编码的环丙烷脂肪酸合酶有关[55]。Kim等[56]的研究表明,UFA和CFA是鼠伤寒沙门氏菌酸耐受性所必需的,并且CFA的合成是σS依赖的。沙门氏菌在低pH值环境中的主要应激机制如图2所示。
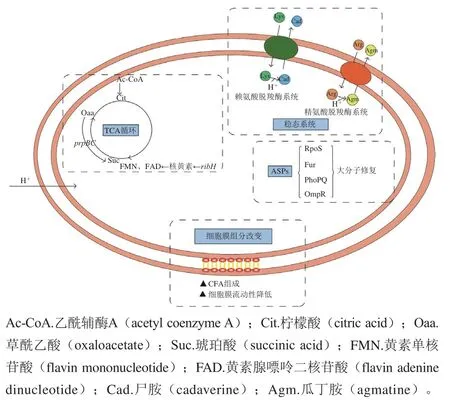
图2 沙门氏菌主要的酸应激机制[57-59]Fig. 2 Major mechanism for acid stress in Salmonella[57-59]
3.2 沙门氏菌对高渗透压的应激机制
渗透压升高会引起水分子跨内膜运动,引起细胞质中水分流失,导致细胞失水死亡[47]。沙门氏菌可通过增加细胞内K+浓度以及通过自身合成或胞外转运增加胞质和周质中可溶性物质(包括脯氨酸、甜菜碱、四氢嘧啶、海藻糖)的浓度,维持合适的细胞膨压[60],如图3所示。沙门氏菌在高渗条件下涉及的渗透保护剂转运系统主要有4 种:ProP系统和ProU系统,主要转运甜菜碱、脯氨酸甜菜碱、脯氨酸;OsmU系统,主要转运海藻糖;当胞外没有可利用的可溶性物质,或者这些物质不足以平衡渗透压力时,沙门氏菌会自身合成海藻糖以平衡渗透压,合成海藻糖的酶由otsBA操纵子转录,但otsBA操纵子由σS调控;YehZYXW系统主要负责转运甘氨酸甜菜碱,YehZ是一种假定的与底物结合的蛋白,可以抑制海藻糖的产生[60-62]。在沙门氏菌进入高渗透压的初始阶段,rpoS、proV、proP基因表达上调,稍后引起kdp表达上调,最后诱导otsB和ompC表达上调。rpoS的上调可能与高渗透压导致的生长速率变慢有关;proU和proP膜转运系统有利于将可溶性物质转运至膜内;kdpABC操纵子的转录可以迅速积累细胞内K+浓度;otsBA操纵子由RpoSRNA聚合酶全酶转录,因此rpoS的表达上调会引起otsB的表达上调;ompC编码OmpR/EnvZ双组分调控系统的外膜蛋白OmpC,能为可溶性物质进入周质提供通道[47,63]。Zhang Xia等[64]研究表明,σS能在高渗透压环境下影响另一个替代σ因子σE的表达,σE对sipC(编码一种重要的转运蛋白)的正向调控,表明σE可能通过sipC影响膜流动性[65]。除此之外,高渗条件也会诱导沙门氏菌中编码吖啶外排泵的acrA基因的表达,推测沙门氏菌可能利用AcrAB-TolC外排泵(acrA基因参与编码)感应细胞外信号,通过运输盐和可溶性溶质来适应环境条件[61]。

图3 沙门氏菌对高渗透压环境的应激反应[57]Fig. 3 Responses of Salmonella to high osmotic pressure environment[57]
3.3 沙门氏菌对干燥条件的应激机制
干燥环境下细胞酶反应被抑制,代谢减弱;同时会影响DNA的共价修饰,造成双键断裂,引起DNA损伤,导致细胞死亡[66]。沙门氏菌在干燥条件下的应激机制包括平衡细胞内渗透压以及利用胞外纤维素和卷曲菌毛抵抗干燥环境[67]。目前,对于沙门氏菌在干燥条件下的应激机制尚不完全清楚[68]。可以知道的是,沙门氏菌对干燥的应激网络与其他环境胁迫的应激网络存在明显重叠。如Mandal等[69]的研究显示,超过50%的抗干燥基因与饥饿生存基因(饥饿12 d)是相同的,超过30%与过氧化氢(1 mmol/L)胁迫所需的基因相同,这表明沙门氏菌在干燥过程中可能经历了饥饿和氧化应激。而在Gruzdev等[70]的研究中,对经过干燥处理后的鼠伤寒沙门氏菌进行乙醇(10%~30%,5 min)、干热(100 ℃、1 h)、紫外线照射(125 μW/cm2、25 min)处理,发现沙门氏菌对这些应激源具有更高的耐受性,说明干燥会诱导沙门氏菌对多种胁迫产生交叉耐受性。对干燥后的沙门氏菌进行转录组测序发现,参与干燥的主要基因aceA(编码异柠檬酸裂合酶)、ddg(编码脂质A生物合成棕榈油酰基-酰基转移酶)、nifU(编码模块化Fe-S簇骨架蛋白)、fnr(全局调节因子)、rpoE、proP、proU、osmU的表达上调,此外还观察到海藻糖和组氨酸合成增加、脂肪酸代谢增强[71-72]。Maserati等[66]的研究还表明,对鼠伤寒沙门氏菌进行aw=0.11处理后,参与细菌毒力形成的基因sopD和sseD表达上调,且sseD和sopD缺失引起细胞形态改变,这与mreC(属于mre操纵子,负责细胞形状和细胞骨架的正确形成)缺失引起的细胞形态改变类似,猜测鼠伤寒沙门氏菌的干燥应激机制可以由sopD/sseD依赖的mre操纵子诱导。
3.4 沙门氏菌对热的应激机制
沙门氏菌的热胁迫主要归因于对干发酵香肠成品进行的巴氏杀菌,过高的温度会对产品品质造成不可接受的影响[23],所以一般采用较温和的温度(低于53 ℃)对干发酵香肠进行处理。但由于沙门氏菌在5.5~45.0 ℃的温度范围内均能生长[73],所以较温和的热胁迫下(如42 ℃)仅会造成其细胞膜损伤和完整性破坏,导致沙门氏菌处于亚致死状态,只有延长胁迫的时间,细菌细胞才会失活[74]。对沙门氏菌的热应激机制还没有系统的研究,但有研究表明σ因子在热应激中发挥着重要作用,主要有σH(调控细胞质内的热应激)和σE(调控细胞膜和胞外的热应激),此外,σS作为全局调节因子也参与了对热的应激[47,75]。高于42 ℃的温度会诱导沙门氏菌中rpoH的转录和翻译,而σH又可以指导30多种热休克蛋白(heat shock proteins,HSPs)的转录,这些蛋白质具有分子伴侣和蛋白酶的功能,可以介导变性蛋白的重新折叠以及降解错误折叠的蛋白质;高于45 ℃处理时,蛋白质错误折叠会诱导DegS蛋白酶切割σE-RseA复合体,导致σE释放到细胞质中,σE与RNA聚合酶形成聚合物,指导σE依赖的相关基因的表达,包括rpoH、htrA等[47]。同时有研究表明,在45 ℃下处理3 min,沙门氏菌编码Hsp70的dnaK表达上调,Hsp70可作为分子伴侣参与蛋白质稳定结构的形成;此外,fadA基因的表达也发生变化,fadA编码3-酮脂酰基CoA硫解酶,可以分解长链脂肪酸,生成乙酰辅酶A,用于三羧酸循环中产生ATP,并且fadA可能与膜脂肪酸的分解有关[76]。Sirsat等[77]对热适应后的沙门氏菌进行转录组分析,结果表明,除了调控热应激的rpoS、rpoE、rpoH的表达上调外,热胁迫还会导致编码主要热激蛋白和一般抗逆蛋白的基因表达,如ibpA、uspA、uspB、htpG、dnaK和htrA,以修复受损和错误折叠的蛋白质;DNA代谢中涉及的各种基因,如dnaG、stpA、holC和uvrA会发生差异表达,与细胞过程有关的基因如osmC、pipA、pipB和slyA表达上调,与运动和附着相关的鞭毛基因如flgH、flgG、flgB、fliI、fliJ和fliM表达下调。沙门氏菌的耐热性受菌株差异性、加热条件、食品基质条件的影响较大[73],此外,干燥、低pH值条件等也会增加沙门氏菌的耐热性,具体的影响机制还有待进一步的研究。
3.5 沙门氏菌对低温的应激机制
在干发酵香肠的生产过程以及成品的运输、销售和储存环节,都可能会运用到4 ℃低温。低温条件下,沙门氏菌的核糖体突变会丧失功能,翻译受到抑制,导致蛋白质折叠不足,影响沙门氏菌生长;此外,温度降低引起细胞膜流动性降低,细胞膜功能遭到破坏,导致细菌死亡[75,78]。沙门氏菌对冷的应激机制主要有冷休克蛋白(cold shock proteins,CSPs)的产生、细胞膜修饰、DNA修复[78](图4)。鼠伤寒沙门氏菌的CSPs主要有6 种,包括CspA~E、CspH,其中CspA、CspB、CspH是冷诱导的,CSPs可以参与生物膜形成,在低温条件下对细菌形成一定的保护作用[79]。例如,Michaux等[80]的研究发现,鼠伤寒沙门氏菌SL1344生物膜的形成与CspA和CspE相关。而在Ray等[79]的研究中,CspE是鼠伤寒沙门氏菌14028s生物膜形成所必需的,CspE在介导生物膜形成的同时也可以增强细菌的群体运动能力,这或许可以促进细菌形成聚集体,从而更好地抵抗环境胁迫。细胞膜修饰方面,低温条件下,细菌细胞可以调整细胞膜UFA/SFA比例、脂肪酸链长度,改变顺式与反式脂肪酸比例以及膜蛋白数量等以恢复细胞膜流动性[81]。参与DNA修复和表达的蛋白质主要有RecA(recA编码的一种CSP,参与DNA的修复重组,LexA失活时引发SOS反应)、TF(tig基因编码、纠正蛋白质折叠、水解错误折叠的多肽)、RbfA(rbfA基因编码的一种CSP,翻译启动增强因子,促进高效翻译)、PNPase(pnp基因编码,参与RNA代谢,促进细胞存活和生长)、NusA(nusA基因编码,DNA转录早期与RNA聚合酶结合,影响转录的暂停/终止),DnaA(转录全局调节因子)[78]。

图4 沙门氏菌对低温环境的应激反应[78,81]Fig. 4 Response of Salmonella to low temperature[78,81]
3.6 沙门氏菌对高压的应激机制
400~600 MPa的高压处理可以延长肉类产品的货架期并减少沙门氏菌等病原体[47]。高压对微生物的影响主要有:1)破坏细胞膜结构,导致细胞物质泄漏,使细胞膜丧失屏障功能;2)破坏蛋白质和核酸结构,影响多种细胞过程,包括DNA复制和细胞代谢等[82]。高压处理的效果受食品基质、工艺参数、菌株差异的影响,以及受酸、热、干燥等环境因素的协同或拮抗影响[83]。Tamber等[82]对沙门氏菌中耐压菌株(600 MPa、3 min)的膜特性进行研究,发现部分菌株对碘化丙啶摄取水平降低,而CFA水平升高。这表明沙门氏菌可以通过改变膜脂肪酸组成响应高压应激,根据对其他应激源(热、饥饿、干燥、酸)的反应,因此他们提出细胞膜和σS在沙门氏菌抗压方面有潜在作用。关于细菌对高压应激机制的研究主要集中在大肠杆菌方面,由于营养体细胞对高压的敏感性存在显著的种属差异[84],所以要明确沙门氏菌对高压的应激机制,这还需要进一步的研究。
3.7 沙门氏菌对紫外线照射的应激机制
紫外线可以使细菌核酸变性,造成核酸或核蛋白的分解、变性或交联,引起DNA链断裂,阻碍其复制、转录和翻译等[85]。Amar等[86]的研究表明,低剂量的UVA可以诱导沙门氏菌中ppGpp(转录调节因子,抑制RNA和蛋白质生物合成相关基因的转录,进而抑制细菌生长,并诱导其他参与毒力和保护功能的基因表达)的合成,而ppGpp可以调控rpoE的表达。在对UVA的响应中,rpoE和rpoS双突变株比rpoS单突变株更敏感,表明rpoE可能通过依赖rpoS和独立于rpoS的功能参与对UVA的防御;rpoS参与紫外线应激可能与rpoS调控着维持包膜完整性或氧化应激反应相关基因的表达有关[87]。Kramer等[88]的研究表明,oxyR缺失的鼠伤寒沙门氏菌比野生型菌株对紫外线更为敏感,而oxyR是参与氧化防御机制的基因,这说明沙门氏菌对紫外线的应激引起了氧化应激反应。但Gayán等[89]的研究表明,在紫外线暴露中存活的鼠伤寒沙门氏菌STCC878的细胞膜没有发生氧化损伤,暴露初期沙门氏菌可以通过DNA修复维持自身存活,并且pH值(7.0~3.0)对沙门氏菌的紫外线抗性没有影响,此外他们认为,沙门氏菌的紫外线抗性存在菌株差异。对沙门氏菌暴露于紫外线下存活机制的研究还不够深入,沙门氏菌对紫外线的抵抗机制还需要进一步明确[75]。
3.8 沙门氏菌对电离辐射的应激机制
电子束辐射是电离辐射的一种,电离辐射通过高能带电的或电离的粒子直接作用于细菌的DNA、RNA或蛋白质,引起细胞死亡或者间接作用于水分子,产生自由基(-OH、-H等),自由基导致DNA断裂,引发细胞死亡[90]。低剂量的γ射线照射会诱导鼠伤寒沙门氏菌的SOS反应,对DNA进行修复[91]。Bhatia等[92]的研究表明,经2 kGy的电子束照射后,鼠伤寒沙门氏菌的β-丙氨酸、丙氨酸、天冬氨酸和谷氨酸的代谢途径均受到显著影响,可能是为了将能量消耗转向DNA修复和细胞膜修复。Calini等[93]的研究表明,经3.5 kGy的较高剂量γ射线照射会诱导鼠伤寒沙门氏菌中热休克蛋白Hsp70的过表达,大大减轻DNA损伤,提高细胞存活率。此外,Caillet等[94]的研究表明,γ射线会诱导鼠伤寒沙门氏菌中热休克蛋白GroEL、GroES的表达,这些蛋白可以作为分子伴侣参与电离辐射后的DNA修复[93]。沙门氏菌对电离辐射的响应主要与DNA修复有关,但其具体的应激机制还有待进一步研究。
3.9 沙门氏菌对植物精油的应激机制
精油是从植物中分离的挥发性次生代谢物的混合物[95],多具有抗菌活性,食品中使用的植物精油主要来自于中草药及香料,主要是酚类、烯萜类和醛类化合物。精油分子可改变细胞膜通透性以及与磷脂分子相互作用,改变脂肪酸在细胞膜中的比例和结构,从而破坏细胞膜结构,导致细胞质成分泄漏;也可以通过细胞膜直接作用于遗传物质,破坏DNA结构,抑制基因表达,导致细胞死亡;此外对细胞呼吸和能量代谢也会产生一定影响[96]。Barbosa等[97]通过蛋白质组学分析发现,精油处理后的沙门氏菌中超氧化物歧化酶和GrpE、ClpB、HtpG、Usp表达量增加,细胞发生了活性氧(reactive oxygen species,ROS)样的应激反应,说明对精油的应激中存在氧化应激机制,GrpE、ClpB、HtpG作为HSPs,可以参与多肽天然构象的形成以及胞质蛋白质修饰和修复,Usp蛋白可以与有害物质结合,防止DNA损伤。此外,沙门氏菌还可以通过快速打开和关闭OmpA和OmpC通道蛋白,调节细胞膜通透性,以应对不利条件、有毒物质和ROS[98]。关于精油与沙门氏菌的研究主要还集中在精油的抑菌作用方面,沙门氏菌的应激机制还需要更加深入的研究。
3.10 沙门氏菌对噬菌体的应激机制
在噬菌体对沙门氏菌的入侵方面,研究较多的是P22噬菌体,其尾突蛋白可以与沙门氏菌脂多糖(lipopolysaccharide,LPS)中的O抗原结构相互作用,导致LPS被破坏,从而使自身DNA注入细菌细胞,最终导致细菌死亡[99-100]。沙门氏菌的抗噬菌体机制主要可以根据噬菌体的入侵过程分为3 个部分:1)阻止噬菌体吸附,主要是通过改变LPS结构,减少LPS含量,阻断噬菌体受体,产生细胞外聚合物,以及产生竞争性抑制剂[101];2)靶向裂解噬菌体核酸,主要是通过Cas1基因编码的Cas1蛋白,通过成簇规律间隔短回文重复序列/关联蛋白系统(clustered regularly interspaced palindromic repeats/clustered regularly interspaced palindromic repeats-associated proteins system,CRISPR/Cas系统)切割噬菌体核酸[101-102];3)噬菌体的流产感染,但这会引起细菌死亡[103]。在Wang Changbao等[101]的研究中,噬菌体fmb-p1入侵后,鼠伤寒沙门氏菌的recA基因表达上调,RecA蛋白可以导致LexA蛋白失活,引起细胞的SOS反应,对DNA进行修复;此外,参与I型限制性修饰系统(restriction modification system,RM)的hsdR、hsdM、hsdS基因和参与III型RM的res和mod基因均发生表达上调,I型RM系统可以将细菌自身DNA甲基化,从而区分细菌自己的甲基化DNA和外源进入的非甲基化DNA,III型RM系统可以对DNA进行半甲基化以及在特定位点上使DNA裂解。Amar等[86]发现,P22噬菌体在抑制鼠伤寒沙门氏菌生长的同时会诱导RseA依赖的σE活性,并在rpoE缺失菌株的固体培养物上产生比野生型更多的噬菌斑,而rseA缺失菌株比野生型更能抵抗噬菌体的攻击,分析可能是由于其σE活性水平较高。目前关于沙门氏菌对噬菌体抵抗机制的研究还不够全面,要明确其抵抗机制,还需要更深入全面的研究。
3.11 沙门氏菌的交叉应激网络
沙门氏菌可以通过其交叉应激网络适应多种不利环境条件,这会对食品安全造成很大的威胁。Ye Beining等[104]的研究结果表明,沙门氏菌在酸适应后,其热应激相关基因rpoH、uspB、htrA,渗透压应激相关基因proP、proV、osmW以及冷应激相关基因cspA、cspC均上调,说明沙门氏菌的酸胁迫诱导了其对冷、热、渗透压的交叉保护机制。根据Gómez-Baltazar等[55]的研究结果,鼠伤寒沙门氏菌ST19和ST213基因型在4 ℃下应激2 h后,其rpoS基因的转录水平上调,同时,这种现象也出现在酸应激和高渗透压应激后,这说明rpoS参与了多个环境压力的应激反应。此外,低温条件下,鼠伤寒沙门氏菌质膜脂肪酸的组成会发生变化,UFA含量降低,SFA含量增加(主要是CFA),导致UFA/SFA的比值降低,膜流动性降低,同时也有研究表明,这种变化可以使鼠伤寒沙门氏菌对酸环境有更高的抵抗力[105]。从以上沙门氏菌对环境条件的应激反应来看,σS、脂肪酸组成、SOS反应可以响应多个条件,例如,σS可以通过控制ASPs响应酸胁迫;通过调控σE以及otsBA操纵子响应高渗透压;并且与高压、紫外线照射、低温条件的响应有关,但其具体的调控网络尚不清楚;同时,沙门氏菌通过改变细胞膜的脂肪酸组成响应酸和低温条件;此外,由recA诱导的SOS反应可以帮助沙门氏菌在低温、电离以及噬菌体侵蚀时进行DNA修复。总之,沙门氏菌的交叉应激网络十分复杂,还需要大量的研究,以探明其交叉应激网络。
4 结 语
总的来说,沙门氏菌病在食源性疾病中的占比有上升趋势,而沙门氏菌在干发酵香肠中的污染情况仍然十分严重,传统发酵过程不能有效减少沙门氏菌污染。在干发酵香肠生产过程中的沙门氏菌干预方面,电子束辐射的减菌效果最好,但是由于处理后的肉类颜色易发生变化以及脂质氧化会引起腐臭味,目前消费者对暴露于这类处理的肉类产品的接受程度不高[75]。此外,精油的减菌效果较好,但其在食品工业中的应用需要考虑其本身的气味对产品的影响以及其合理的安全添加量;高压处理、多菌种发酵以及联合处理对沙门氏菌的减菌效果良好,且对食品本身特性的改变较小,能够较好保持食品的感官特性,因此,高压、多菌种发酵以及联合减菌可能会成为今后对干发酵香肠中沙门氏菌减菌处理的主要方式。
从对沙门氏菌的减菌效果以及沙门氏菌的应激机制来说,两者是一种相互影响的关系。一方面,沙门氏菌会不断进化以适应更严峻的食品加工环境或新型减菌措施;另一方面,沙门氏菌的交叉应激网络也会使减菌处理的效果大大降低,这要求研究人员不断开发新型的减菌处理方式。在干发酵香肠的生产过程中,沙门氏菌不可避免地会经受酸、高渗透压和干燥的刺激,而酸刺激会诱导沙门氏菌对后处理(如低温、热、高压处理以及紫外线处理)产生交叉应激,这必然会影响后处理中这些干预措施的参数设置和减菌效果,所以,在干发酵香肠的原料处理阶段以合适的方式对沙门氏菌进行干预或许是一个不错的选择。此外,通过研究沙门氏菌的交叉应激机制开发合适的联合减菌措施也将成为干发酵香肠中减少沙门氏菌的一个必然趋势。
