激活PPARγ对结核分枝杆菌感染小鼠肺组织AP-1表达及炎症反应的影响
2022-04-01王海利韩晓群付南燕杨婧周智兴邓琴赵晓杰刘冬梅
王海利,韩晓群,付南燕,杨婧,周智兴,邓琴,赵晓杰,刘冬梅
1宜春学院化学与生物工程学院,江西宜春 336000;2宜春学院医学院医学免疫与微生物学教研室,江西宜春336000
结核病是全球性的公共卫生问题,结核分枝杆菌(Mycobacterium tuberculosis,MTB)是引起该病的主要病原体。MTB感染后,宿主免疫系统具有清除及杀灭MTB的能力,但MTB亦能通过一系列机制逃避宿主的免疫反应,成为重要的胞内感染细菌。MTB逃避宿主免疫防御的能力以及机体所表现的活动与潜伏交替的疾病状态,对抗结核药物的研发提出了挑战[1]。过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)是一种可由配体激活的核转录因子,在胞内感染的免疫反应中发挥重要作用,是MTB逃避宿主免疫防御、建立慢性感染的关键调节因子[2]。有研究报道,在MTB感染巨噬细胞过程中,PPARγ活化能抑制核因子-κB(nuclear factor-κB,NF-κB)信号通路及炎性因子肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)的表达[3]。本课题组前期研究证实,结核病患者外周血单核细胞中PPARγ的表达与TNF-α、IL-6呈正相关[4],提示PPARγ在结核病的发病过程中具有炎性调控作用,但PPARγ是否影响小鼠肺组织激活蛋白-1(activator protein-1,AP-1)的表达进而影响MTB感染后的炎症反应目前尚未见报道。转录因子AP-1是由Jun蛋白与Fos蛋白家族组成的异二聚体,如c-Jun/c-Fos,而c-Jun被公认为AP-1复合物的中心亚基,是炎症状态下最重要的转录激活因子。本研究探讨激活PPARγ对MTB感染小鼠肺组织c-Jun/AP-1表达及炎症反应的影响,以期为结核病的防治提供理论依据。
1 材料与方法
1.1 主要试剂 酶联免疫吸附测定(ELISA)试剂盒购自武汉伊莱瑞特生物科技股份有限公司,2×SYBR Green RT-qPCR Master Mix购自中国上海欣百诺公司,T R Izo l 试剂购自美国Sig ma 公司,099C A4224气溶胶感染装置购自美国Glas-Co l 公司,m R N A-c D N A 提取试剂盒购自美国Applied Biosystems公司。PPARγ激动剂罗格列酮(rosiglitazone,ROZ)及拮抗剂GW9662购自北京白奥莱博科技有限公司。
1.2 实验动物及菌株 6~8周龄SPF级健康雄性C57BL/6小鼠50只,体重18~20 g,购自三峡大学实验动物中心[许可证号:SCXK(鄂)2017-0012]。将小鼠饲养在恒温恒湿、12 h明暗交替的环境中,给予无菌食物及无菌水。MTB标准株H37Rv(菌号:93009)购自中国药品生物制品检定所。动物在感染前1周进入武汉大学动物实验中心(ABSL-Ⅲ实验室)。本实验获得武汉大学动物实验中心实验动物福利伦理委员会审查批准(批准号:2017077)。
1.3 方法
1.3.1 细菌培养 将H37Rv菌株接种于改良罗氏斜面培养基,置于37 ℃、5%CO2培养箱中培养。取对数生长期的优良菌落,用匀浆器研磨使其呈均匀细颗粒状,加入培养液,置于-80 ℃低温冰箱内备用。该实验在生物安全Ⅲ级实验室完成。
1.3.2 实验分组及干预 将50只小鼠采用随机数字表法分为5组,每组10只。(1)对照组:将小鼠放于雾化装置中,每天用5 ml含0.05% Tween 80的生理盐水雾化吸入90 min;(2)MTB组:每天用5 ml含有MTB量为1×106CFU的0.05% Tween 80生理盐水雾化吸入90 min[5];(3)MTB+罗格列酮组:实验前3d,每天给予4 mg/kg罗格列酮灌胃,以后每天按照MTB组的方法雾化吸入联合4 mg/kg罗格列酮灌胃;(4)MTB+GW9662组:雾化吸入MTB后1 h,给予腹腔内注射GW9662,剂量为4 mg/kg,以后每天按4 mg/kg剂量给予GW9662腹腔注射;(5)MTB+罗格列酮+GW9662组:按上述MTB+罗格列酮组的方法处理小鼠,每天给予腹腔内注射4 mg/kg GW9662。
各组小鼠饲养6周,禁食12 h后处死。沿前正中线剪开胸膜,收集小鼠肺组织,一部分匀浆处理后取上清液用于ELISA检测,一部分用于荷菌量检测及肺组织病理学观察,剩余部分迅速放入-80 ℃冰箱保存,备Western blotting检测。
1.3.3 肺组织荷菌量检测 严格执行无菌操作,取每只小鼠的0.04 g肺组织,充分漂洗后加入1 ml生理盐水,使用组织匀浆器研磨制备组织悬液。按照文献[6-7]中的方法检测肺组织荷菌量。
1.3.4 RT-qPCR检测PPARγ及AP-1基因表达水平
取新鲜冰冻肺组织,匀浆处理,用TRIzol试剂提取总RNA,反转录合成cDNA,按照说明书进行检测,引物序列见表1。以β-actin为内参照,采用2-ΔΔCt法计算PPARγ及AP-1的基因表达水平。

表1 RT-qPCR引物序列Tab.1 Primer sequences of real-time qPCR
1.3.5 Western blotting检测PPARγ及AP-1蛋白表达水平 取冻存的肺组织,匀浆处理,采用RIPA裂解缓冲液提取蛋白,BCA法蛋白定量。经SDS-PAGE电泳分离并转移至PVDF膜,5%脱脂奶粉室温封闭2 h。加入含一抗(1:100稀释)的孵育液,过夜后洗涤,再加入辣根过氧化物酶(HRP)标记的二抗(1:1000稀释),孵育后再次洗涤。蛋白条带在化学发光试剂(ECL)下显影,以β-actin为内参照,结果采用凝胶图像分析软件BandScan进行分析。
1.3.6 ELISA法检测肺组织炎性细胞因子含量 将肺组织匀浆处理后取上清液,使用IL-6、TNF-α及IL-10 ELISA检测试剂盒进行检测,在全自动酶标仪上于450 nm波长处测量其光密度(OD)值。根据OD值绘制标准曲线,计算TNF-α、IL-10及IL-6的含量。
1.3.7 肺组织病理学观察 将小鼠肺组织用甲醛固定后,石蜡包埋、切片、脱蜡、HE染色,置于光学显微镜下观察肺组织的病理变化。
1.4 统计学处理 采用SPSS 23.0软件进行统计分析。计量资料以表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组小鼠肺组织荷菌量比较 各组小鼠肺组织荷菌量差异有统计学意义(P<0.001)。与MTB组比较,MTB+罗格列酮组及MTB+罗格列酮+GW9662组荷菌量升高,MTB+GW9662组荷菌量降低,差异均有统计学意义(P<0.05);与MTB+罗格列酮组比较,MTB+罗格列酮+GW9662组荷菌量降低,差异有统计学意义(P<0.05,图1)。

图1 各组小鼠肺组织结核分枝杆菌荷菌量比较Fig.1 Comparison of MTB bacterial load in lung tissue of mice in each group
2.2 各组小鼠肺组织PPARγ表达水平比较 各组小鼠肺组织PPARγ表达差异有统计学意义(P<0.001)。MTB组、MTB+罗格列酮组、MTB+GW9662组及MTB+罗格列酮+GW9662组肺组织PPARγ表达水平均高于对照组,差异有统计学意义(P<0.05);MTB+罗格列酮组PPARγ表达水平高于MTB组,MTB+GW9662组则低于MTB组,差异均有统计学意义(P<0.05);MTB+罗格列酮+GW9662组PPARγ表达水平低于MTB+罗格列酮组,差异有统计学意义(P<0.05,图2)。

图2 各组小鼠肺组织PPARγ表达水平比较Fig.2 Comparison of PPARγ expression levels in lung tissue of mice in each group
2.3 各组小鼠肺组织A P-1 表达水平比较 各组小鼠肺组织AP-1表达水平差异有统计学意义(P<0.001)。与对照组比较,MTB组、MTB+罗格列酮组、MTB+GW9662组及MTB+罗格列酮+GW9662组肺组织AP-1表达水平均明显降低,差异有统计学意义(P<0.05);MTB+罗格列酮组AP-1 mRNA表达水平低于MTB组,MTB+GW9662组则高于MTB组,差异有统计学意义(P<0.05,图3)。
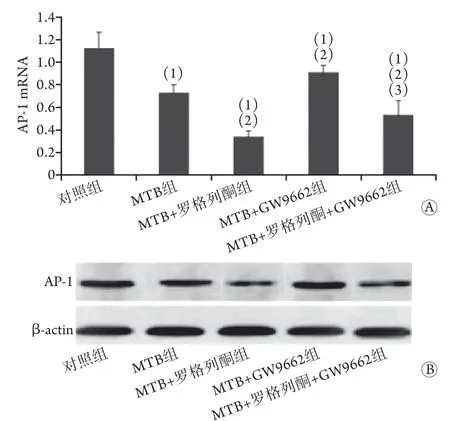
图3 各组小鼠肺组织AP-1表达水平比较Fig.3 Comparison of AP-1 expression levels in lung tissue of mice in each group
2.4 各组小鼠肺组织炎性细胞因子含量比较各组小鼠肺组织细胞因子含量差异有统计学意义(P<0.001)。与对照组比较,MTB组、MTB+罗格列酮组、MTB+GW9662组、MTB+罗格列酮组+GW9662组肺组织IL-6、IL-10、TNF-α水平均升高,差异有统计学意义(P<0.05);其中MTB+罗格列酮组IL-6、TNF-α含量分别为(160.71±20.36) pg/ml、(343.55±58.48) pg/ml,低于MTB组[分别为(232.59±21.73) pg/ml和(511.99±69.83) pg/ml],但M T B+罗格列酮组的I L-1 0 含量高于M T B 组[(105.97±10.38) pg/mlvs. (83.25±9.00) pg/ml],差异有统计学意义(P<0.05,图4)。
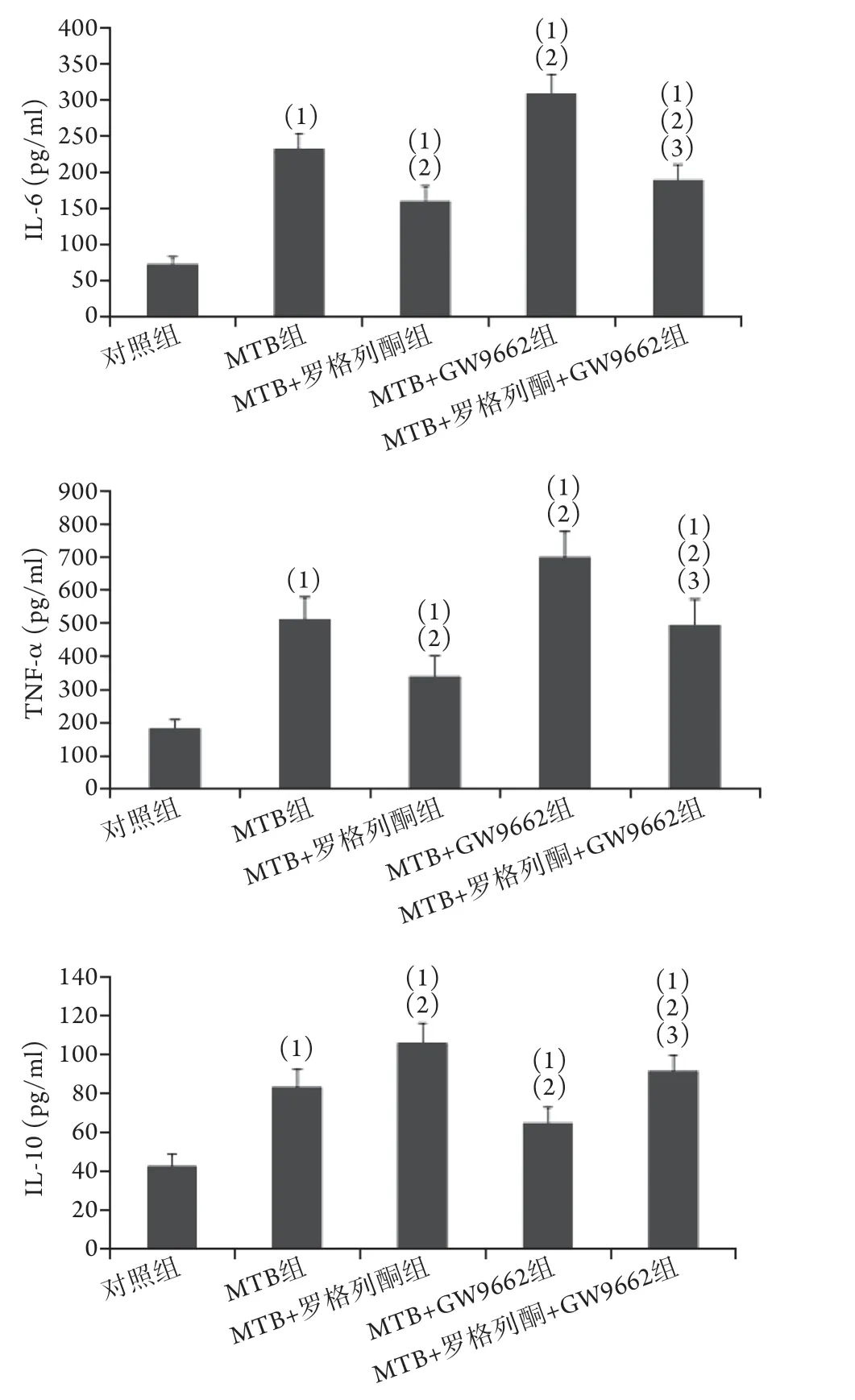
图4 各组小鼠肺组织炎性细胞因子含量比较Fig.4 Comparison the content of inflammatory cytokines in lung tissue of mice in each group
2.5 各组小鼠肺组织病理学变化 与对照组比较,MTB组小鼠肺组织镜下可见肺泡壁增厚、肺泡腔狭窄及炎性细胞浸润。与MTB组比较,MTB+罗格列酮组肺泡塌陷,且部分肺泡腔内出现粉红色渗出液,提示肺组织损伤更为严重。与MTB+罗格列酮组比较,MTB+GW9662组及MTB+罗格列酮+GW9662组肺组织病变明显减轻(图5)。
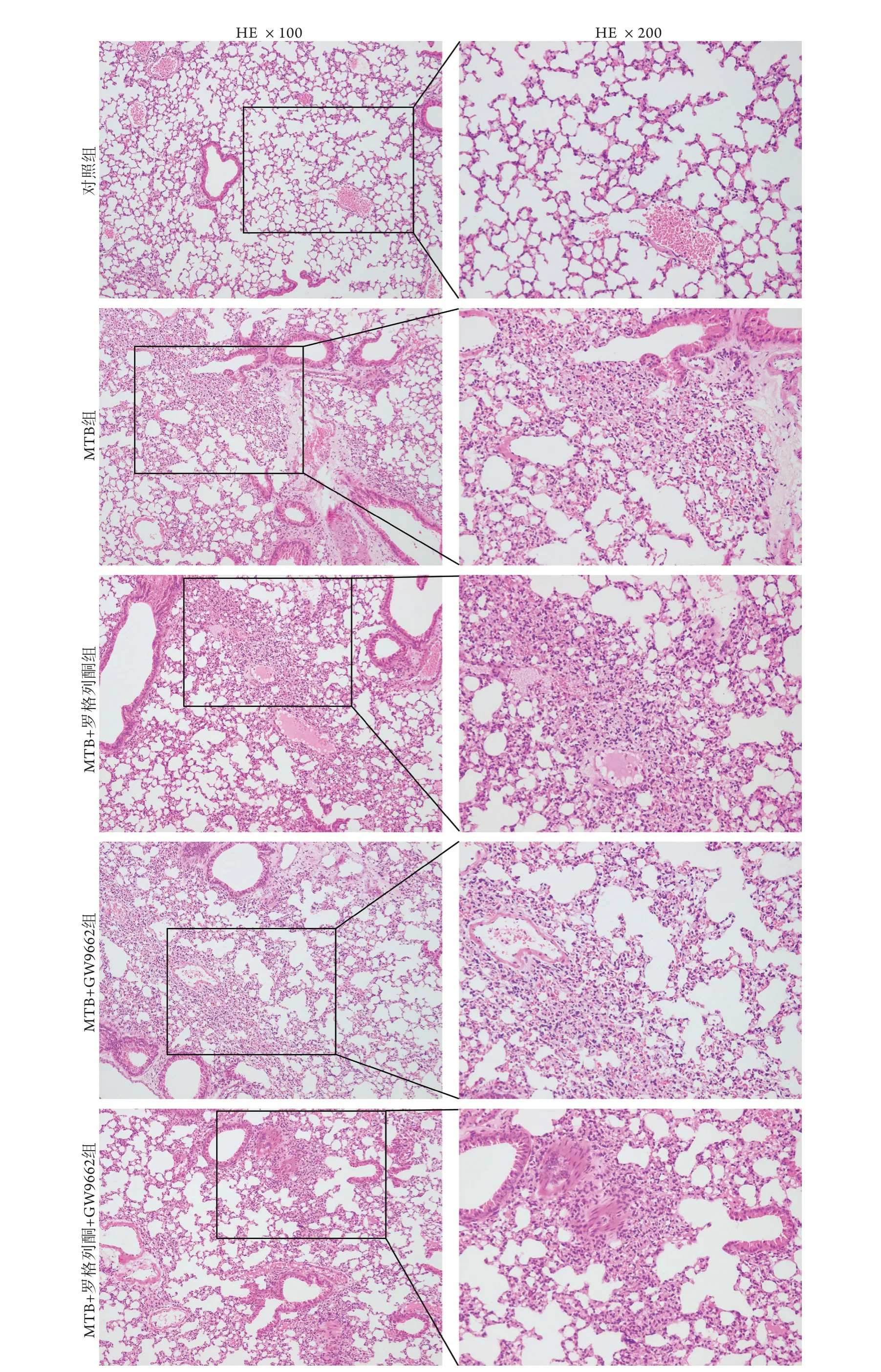
图5 各组小鼠肺组织病理学变化Fig.5 Pathological changes of lung tissue of mice in each group
3 讨 论
肺泡巨噬细胞是抵御MTB感染的第一道防线[8]。研究表明,MTB感染能够诱导巨噬细胞PPARγ表达,影响巨噬细胞对胞内感染MTB的杀伤活性[9-10]。本研究结果显示,MTB感染小鼠肺组织PPARγ表达增加,证实了PPARγ与MTB感染存在一定的关系。
PPARγ在肺部炎症、急性感染性疾病及感染后组织稳态恢复等过程中起重要作用,是肺部炎症反应的关键调节器[11]。PPARγ可通过调控多条信号传导通路影响下游效应分子及炎性细胞因子的表达,从而保护宿主细胞免受MTB感染[12-13]。有研究发现,与野生型小鼠相比,PPARγ缺失型小鼠感染MTB后,其肺泡巨噬细胞中TNF-α及IL-6分泌明显增加,而IL-10分泌减少[9]。PPARγ配体亦可抑制鼠单核细胞产生TNF-α及IL-6[14]。罗格列酮是人工合成的PPARγ高选择性强效激动剂,其与PPARγ特异性结合后,通过调节下游靶基因而在炎症反应中发挥作用[15]。GW9662作为一种高效且不可逆的选择性PPARγ拮抗剂,可抑制罗格列酮介导的PPARγ活性[16]。本研究结果显示,在MTB感染的同时给予PPARγ激动剂罗格列酮,小鼠肺组织IL-6、TNF-α含量较单纯MTB感染组明显下降,而IL-10含量明显增加。GW9662部分逆转了罗格列酮所致炎性细胞因子的变化,表明激活PPARγ能够抑制MTB感染小鼠肺组织的炎症反应,而拮抗PPARγ活性则作用相反,提示PPARγ可通过调控促炎/抗炎平衡而参与宿主的免疫调节。
转录因子AP-1是由Jun蛋白家族成员如c-Jun、JunB、JunD与Fos蛋白家族成员如c-Fos、FosB、Fos相关抗原1(Fra1)、Fra-2组成的二聚体。Zhang等[17]研究发现,抗结核药物异烟肼能通过激活PPARγ而抑制AP-1的转录活性,从而发挥其抗炎作用。c-Jun被公认为AP-1复合物的中心亚基,是炎症状态下最重要的转录激活因子[18]。
为探讨AP-1是否参与了MTB感染的炎症反应及PPARγ活化对AP-1表达的影响,本研究对MTB感染小鼠肺组织c-Jun/AP-1的表达进行了检测,结果显示,MTB感染明显降低了小鼠肺组织c-Jun/AP-1的表达,PPARγ激动剂罗格列酮增强了MTB感染所致AP-1表达的下降,而拮抗剂GW9662作用相反,表明MTB感染小鼠肺组织c-Jun/AP-1表达受PPARγ的负向调控。已有研究证实,c-Jun蛋白可通过促进巨噬细胞中促炎基因的转录从而增加促炎细胞因子的表达[19-20]。可见在MTB的感染过程中,PPARγ活化可通过下调c-Jun/AP-1的表达而影响肺组织的炎症反应,但并不排除PPARγ介导的炎症反应还与NF-κB、信号传导及转录激活蛋白-1等途径有关。
有研究报道,促炎细胞因子TNF-α、IL-6在巨噬细胞活化及胞内病原体清除等方面发挥重要作用,是宿主对MTB感染发生免疫应答的重要调节因子[21-22],而抗炎细胞因子IL-10则通过抑制吞噬体成熟及减少活性氧的产生而降低宿主对MTB的控制[23]。一项对灵长类动物的研究表明,在MTB急性感染期间,机体炎症水平下降可导致细菌负荷增加[24]。本研究结果显示,随着IL-6、TNF-α含量降低和IL-10含量升高,肺组织荷菌量增加,反之亦然,表明MTB感染后,激活PPARγ可调控促炎及抑炎细胞因子表达,诱导较低水平的炎症反应,降低机体对MTB的清除及杀伤能力,在宿主体内为MTB营造了一个良好的生存环境。
MTB的持续复制以及机体炎症反应与免疫环境的重建是导致小鼠肺组织损伤的主要原因[25]。从本研究结果可以看出,在MTB感染过程中,激活PPARγ可导致小鼠肺组织出现更严重的病理损伤,而这种损伤伴随着促炎细胞因子水平下降、抗炎细胞因子水平升高及肺组织荷菌量的增加,提示PPARγ可能通过调控MTB感染中复杂的炎症网络,导致炎症反应功能紊乱,从而加剧肺组织的病理损伤。
综上所述,本研究结果显示,激活PPARγ能下调MTB感染小鼠肺组织AP-1的表达,进而抑制肺组织炎症反应,影响机体对MTB的清除,提示PPARγ作为肺部炎症反应的关键调节器,有望成为结核病防治的新靶标。但是,机体的炎症反应是一把双刃剑:一方面,炎症反应是机体免疫系统清除及杀灭MTB的重要机制;另一方面,炎症反应也对机体造成了一定的炎性损伤。如何合理干预PPARγ活性从而有利于辅助结核病的防治尚需进一步研究。
