低频超声辐照载5-氟尿嘧啶的纳泡靶向治疗裸鼠射频消融后残留肝癌的效果
2022-04-01李红阳唐诗聪赵公芳牛英杰李乔亚
李红阳,唐诗聪,赵公芳,牛英杰,李乔亚
1昆明医科大学第三附属医院肝胆外科,昆明 650000;2昆明医科大学第二附属医院消化内科,昆明 650000;3昆明医科大学附属延安医院全科医学科,昆明 650000
射频消融(radiofrequency ablation,RFA)是无创性治疗中晚期肝癌的新方法,其优点包括原位灭活肿瘤、创伤小、恢复快、仅需局部麻醉、无瘢痕、并发症少等,但同时也存在一些缺陷:由于肋骨遮挡,导致RFA的治疗效率降低;肝癌血供丰富,造成RFA热沉积效率低,聚焦点能量低,从而导致治疗效果较差;肝脏随呼吸运动,可能导致射频定位不准确,从而出现治疗盲区,造成残癌的存在[1-3]。超声波靶向爆破携药物/基因纳泡技术(ultrasound targeted nanobubble destruction,UTND)是指当携药物/基因的纳泡造影剂经静脉注射进入肿瘤组织时,可通过超声波产生的空化效应及机械效应,击碎携药物/基因的纳泡造影剂,使外源性药物/基因进入肿瘤组织,从而彻底杀灭残余癌细胞,目前该技术已成为肿瘤治疗的研究热点[4-5]。从理论上讲,载药的纳泡治疗系统联合RFA可弥补射频治疗的不足,在肝癌治疗方面具有较好的应用前景,但目前研究尚少。本研究构建了RFA治疗后残余肝癌裸鼠模型,并合成包裹5-氟尿嘧啶(5-fluorouracil,5-FU)的纳泡,采用低强度低频超声辐照载5-FU的纳泡,靶向治疗残余肝癌,分析其对RFA不完全肝癌细胞的抑制作用,以期为肝癌的无创或微创治疗提供新方案。
1 材料与方法
1.1 实验动物及细胞 60只6~8周龄BALB/c裸鼠,体重(18±2) g,雌雄不限,购自昆明医科大学实验动物中心,混合饲料,隔笼喂养;人肝癌HepG2细胞购自中国科学院上海生物化学与细胞生物学研究所。实验过程符合国家及单位有关实验动物的管理和使用规定。
1.2 主要仪器及试剂 DZC型低频超声辐照仪(重庆医科大学超声研究所研制);普通超声仪(德国Siemens公司);752型紫外分光光度仪(日本岛津公司);Cool-tip射频消融系统(美国Valleylab公司);CKX41倒置荧光显微镜(日本Olympus公司);3000SSA型Malvern激光粒径测量仪、Zata电位检测仪(英国Malvern公司);二棕榈酰磷脂酰乙醇胺、二硬脂酰磷脂酰胆碱、多聚赖氨酸(美国Sigma公司);二棕榈酰磷脂酰磷脂酸(瑞士Genzyme公司);RPMI 1640(美国HyClone公司);胎牛血清(美国Gibco公司);1:50鼠抗人CD34单克隆抗体(北京中杉生物公司);SP免疫组化试剂盒(上海碧云天试剂公司);细胞凋亡检测试剂盒(瑞士Roche公司)。
1.3 方法
1.3.1 合成包裹5-FU的纳泡 将二棕榈酰磷脂酰乙醇胺、二硬脂酰磷脂酰胆碱、二棕榈酰磷脂酰磷脂酸按合适的浓度混合,加0.5 ml PBS稀释,制成纳泡造影剂。采用亲和素-生物素技术将纳泡与5-FU有效结合,制成包裹5-FU的纳泡。
1.3.2 裸鼠移植瘤模型的建立 使用RPMI 1640培养基将处于对数生长期的人肝癌HepG2细胞稀释成浓度为1×108/ml的细胞悬液,通过台盼蓝拒染试验检测其细胞活性>90%。于60只裸鼠右侧背部皮下注射0.2 ml的细胞悬液,密切观察肿瘤生长情况,6 d后肿瘤形成,直径达0.5~1.0 cm,超声检查成瘤率为100%。
1.3.3 分组及治疗 裸鼠处于仰卧位,用18G穿刺针垂直肿瘤长轴方向刺入肿瘤中心,超声引导下采用Cool-tip射频消融系统进行冷循环RFA(射频功率30 W,持续消融时间10 s),消融后用超声探查肝癌平均消融约80%。按随机数字表法将60只荷瘤裸鼠均分为生理盐水组、载5-FU纳泡(5-FU)组、非低频超声辐照载5-FU纳泡(非低频超声+5-FU)组、低频超声辐照载5-FU纳泡(低频超声+5-FU)组4组,每组15只。后3组裸鼠经尾静脉注入包裹5-FU的纳泡(0.1 μg/μl),每次200 μl,每3 d注射1次,连续注射3次。生理盐水组注入等体积生理盐水;非低频超声+5-FU组辐照频率为2.5 MHz,声强为5 W/cm2,辐照时间5 min;低频超声+5-FU组注入纳泡后采用超声监测微泡到达靶组织的情况,调整辐照频率为1.0 MHz,声强为2 W/cm2,辐照时间5 min。
1.3.4 TUNEL法检测肿瘤细胞凋亡情况 整个治疗结束后第5天,每组各处死5只荷瘤裸鼠,取其肿瘤组织,固定后常规石蜡包埋,切片4 μm;经常规脱蜡、水化等操作后,加入TUNEL反应混合液,置于37 ℃孵育1 h。按照细胞凋亡检测试剂盒说明书,采用TUNEL法检测肿瘤细胞凋亡指数。凋亡率(%)=阳性细胞数/肿瘤细胞总数×100%。阳性细胞判定标准:肿瘤细胞的细胞核呈棕褐色。
1.3.5 CD34-MVD法检测肿瘤内新生血管密度 按1.3.4中的步骤处理肿瘤组织切片,用柠檬酸盐缓冲液(pH 6.0)处理,于121 ℃环境中高压灭菌18 min,自然冷却后用PBS冲洗3次,每次5 min;用3%H2O2保持5 min,PBS冲洗3次,每次5 min;然后将切片用抗CD34抗体免疫染色并用DAB处理;洗涤、复染、脱水等。用免疫组化Elivison二步法观察CD34阳性微血管:首先使用低倍(40~100倍)物镜观察染色最强的区域(热点),然后使用高倍(200~400倍)物镜对染色的血管进行计数,计算平均微血管密度(MVD)。
1.3.6 荷瘤裸鼠生长情况观察 除去处死的荷瘤裸鼠,观察各组剩余荷瘤裸鼠(每组各10只)的生长情况,包括日常活动情况,进食及饮水情况,毛发、营养及肿瘤转移情况等。在治疗后的第7、14、21、28天,通过二维超声测量各组移植瘤的最长径(L)及最短径(W),并计算肿瘤体积(V)。V=(L×W2)/2。按如下公式计算实体瘤生长抑制率(TGIR)。TGIR(%)=(1-治疗组平均肿瘤体积/生理盐水组平均肿瘤体积)×100%。同时记录各组裸鼠的存活时间,绘制Kaplan-Meier生存曲线。
1.4 统计学处理 采用SPSS 23.0软件进行统计分析。计量资料以表示,多组间比较采用单因素方差分析,进一步组间两两比较采用LSD-t检验。采用Kaplan-Meier法分析各组的生存时间。P<0.05为差异有统计学意义。
2 结 果
2.1 各组荷瘤裸鼠生长情况 经治疗后,各组荷瘤裸鼠均表现出不同程度的体重减轻、活动减少、食欲减退等,其中低频超声+5-FU组的荷瘤裸鼠生长情况明显优于其他3组。
2.2 各组荷瘤裸鼠肿瘤大小比较 各组裸鼠肿瘤体积均随时间延长而逐渐增大,但低频超声+5-FU组的肿瘤生长速度明显低于其他3组,生长抑制率亦明显低于5-FU组与非低频超声+5-FU组,差异均有统计学意义(P<0.05,表1)。
表1 各组荷瘤裸鼠治疗后肿瘤体积变化(±s,n=10)Tab.1 Comparison of tumor volume after treatment among four groups (±s, n=10)

表1 各组荷瘤裸鼠治疗后肿瘤体积变化(±s,n=10)Tab.1 Comparison of tumor volume after treatment among four groups (±s, n=10)
与生理盐水组比较,(1)P<0.05;与5-FU组比较,(2)P<0.05;与非低频超声+5-FU组比较,(3)P<0.05
组别肿瘤体积(mm3)生长抑制率(%)治疗后第7天治疗后第14天治疗后第21天治疗后第28天生理盐水组744.5±49.9870.9±72.01062.5±122.11467.2±127.9-5-FU组618.5±48.4(1)705.9±57.9(1)895.1±90.1(1)1204.0±112.2(1)18.06±2.93非低频超声+5-FU组568.2±43.8(1)(2)672.4±53.2(1)830.6±77.2(1)1142.3±101.7(1)22.20±3.69(2)低频超声+5-FU组411.1±32.6(1)(2)(3)496.5±36.3(1)(2)(3)618.3±59.6(1)(2)(3)833.3±70.6(1)(2)(3)43.24±2.23(2)(3)F 97.48975.02242.08761.626462.482 P<0.001<0.001<0.001<0.001<0.001
2.3 荷瘤裸鼠生存时间比较 低频超声+5-FU组荷瘤裸鼠生存时间明显长于其他3组,差异有统计学意义(P<0.05,图1)。

图1 各组荷瘤裸鼠生存曲线Fig.1 The survival time of tumor-bearing in nude mice
2.4 各组肿瘤细胞凋亡情况比较 T U N E L法结果显示,低频超声+5-F U 组肿瘤细胞凋亡指数(4 3.2%±4.4%)>非低频超声+5-F U 组(31.3%±4.3%)>5-FU组(20.7%±2.9%)>生理盐水组(10.8%±2.4%),差异有统计学意义(F=74.549,P<0.05,图2)。

图2 各组残留肝癌细胞凋亡情况Fig.2 Apoptosis of residual tumor cell in each group
2.5 各组肿瘤内新生血管密度比较 低频超声+5-FU组瘤体中无明显CD34染色阳性区,其余各组瘤体中见多个CD34染色阳性区,阳性染色的肿瘤组织较多。低频超声+5-FU组MVD[(8.9±1.3)个/HP]<非低频超声+5-FU组[(20.1±3.2)个/HP] <5-FU组[(25.0±4.2)个/HP] <生理盐水组[(29.9±2.0)个/HP],差异有统计学意义(F=48.667,P<0.05,图3)。

图3 各组残留肝癌组织内新生血管密度比较Fig.3 Comparison of neovascularization density in residual tumor tissues of each group
3 讨 论
我国肝癌发病率居全球之首,每年新发及死亡患者约占全球总数的一半[6-7]。尽管近年来肝癌根治性切除术得到了长足发展[8],且术中严格遵循了无瘤原则,但由于术中挤压、搬动、肿瘤细胞微转移及肝癌本身进展等多种因素的作用,术后复发往往无法避免,多数肝癌患者死于肿瘤复发转移[9],即使是完全规范的治疗,5年生存率也仅为47%[10]。小肝癌的5年生存率仅为70%,而复发转移率却高达64%[11]。Shah等[12]认为,血管侵犯是肝癌根治性切除术后1年内复发的最高危因素,主要包括肝内大血管及微血管的侵犯。李传红等[13]发现,术前甲胎蛋白高水平、乙型肝炎病毒阳性、肿瘤数目多及吲哚氰绿15 min储留率(ICGR15)高是肝癌行根治性切除术后复发的高危因素。Melcher等[14]认为,肿瘤分化程度及血管侵犯也是肝癌患者行肝移植术后复发及生存率的独立影响因素。
纳米载药系统具有良好的靶向性、可控释性、生物相容性及物理稳定性,已成为当今临床医学研究最热门的方向之一[15-17]。UTND技术是携药物的纳泡经静脉注入体内后,当超声仪监测到微泡到达靶组织时,以超声波爆破微泡产生“空化效应”“声孔效应”,提高细胞膜的通透性,促使更多药物通过细胞膜进入靶组织,从而达到药物的治疗效果[18-19]。目前UTND技术使用的超声仪主要是普通超声仪,其发出的连续波并不利于载药微泡在靶组织器官的灌注,从而导致达到靶向部位的药物量较低,而且对正常组织也会产生一系列的生物学效应[20-22]。此外,通过普通超声仪对载药微泡进行辐照不能从真正意义上保证体内定位的精确性,在很大程度上降低了载药微泡的治疗效果。低强度聚焦超声遵循聚焦超声原理,其能量远远低于高强度聚焦超声,不会产生破坏性的致热反应[23-25]。
本研究选用重庆医科大学超声影像学研究所自制的低强度聚焦超声作为超声触发设备,通过低强度聚焦超声爆破载药纳泡,提高药物在靶组织的靶向性沉积,并通过降低正常组织的不良反应来提高治疗效果(图4)。本研究结果显示,低频超声+5-FU组的肿瘤生长体积明显小于其他3组,生存时间及凋亡指数也明显高于其他3组,肿瘤MVD值明显低于其他3组,差异有统计学意义(P<0.05),其机制可能是低频超声波爆破纳泡产生的“机械效应”使内皮细胞膜发生损伤,导致微血栓形成,栓塞肿瘤血管的血液供应,使MVD降低,引起局部肿瘤细胞坏死。此外低频超声爆破纳泡产生的“空化效应”可增加血管膜通透性,促进5-FU的吸收,使5-FU更容易进入细胞内杀灭肿瘤细胞,促进更多的肝癌细胞凋亡,进而使肿瘤体积缩小,控制肿瘤的生长,从而达到治疗效果。
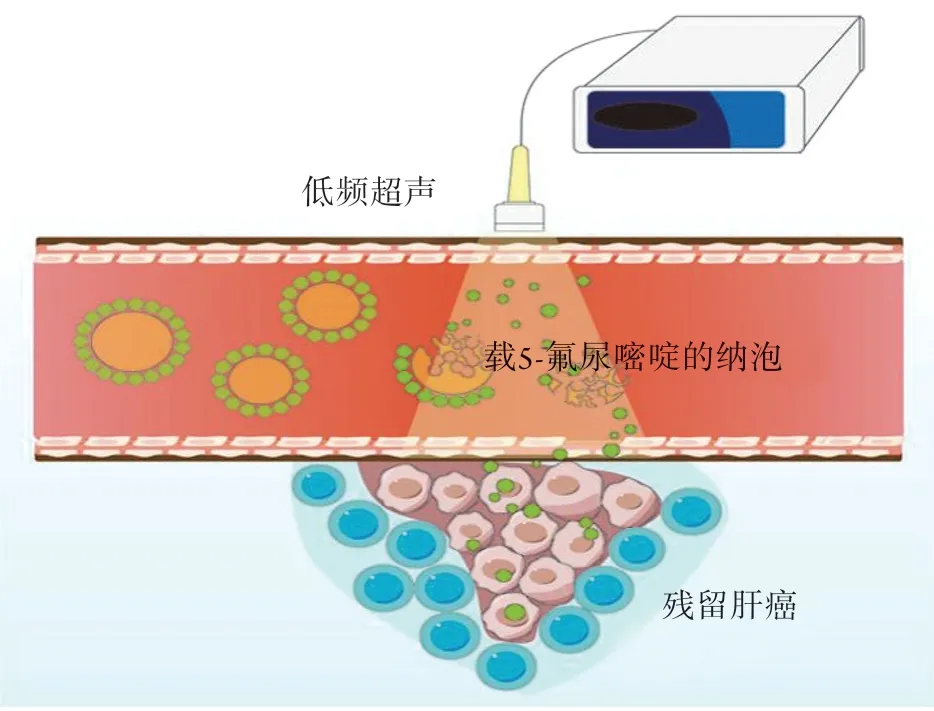
图4 低频超声辐照载5-氟尿嘧啶的纳泡Fig.4 Low frequency ultrasound radiation 5-fluorouracil loaded nanobubbles
综上所述,低频超声辐照载5-FU的纳泡治疗RFA后裸鼠残留肝癌时,可明显降低肝癌组织内的MVD,抑制肿瘤生长。随着低频超声辐照载药纳泡靶向药物释放技术在肿瘤治疗方面研究的深入,有望为肝癌提供更加安全、高效,靶向性更强的局部定位控释治疗方法。此外,本研究虽然在一定程度上证实了低频超声辐照载5-FU的纳泡对RFA残留肝癌细胞的抑制作用,有望为肝癌无创或微创治疗提供新方案,但低频超声辐照载5-FU纳泡的最佳时间参数,以及低频超声辐照载5-FU的纳泡对RFA残留的肝癌细胞的具体作用机制等仍需进一步深入研究。
