新疆发现甜菜新病害甜菜黄萎病
2022-04-01赵志强张卢慧赵全新郭庆元
赵志强,张卢慧,赵全新,郭庆元
(新疆农业大学农学院,乌鲁木齐 830052)
0 引 言
【研究意义】新疆是我国最大的甜菜生产区,也是我国北方最大的甜菜糖制糖基地[1]。2018年,全区甜菜种植面积已达57 260 hm2,占全国种植总面积的26.49%;全区甜菜总产量为424.73×104t,占全国总产量的37.66%[2]。2016年以来,在新疆多个地区的甜菜上发现了一种新病害,可以造成甜菜叶片褪绿、黄化、萎蔫,直至枯死,且半叶发病者居多。查明引起新疆甜菜黄萎症状的病原,研究病害性质,需采集病样,分离纯化,运用柯赫氏法则验证及对病原物形态观察和分子鉴定,研究该病原及所致病害类别,对该病有效防治有实际意义。【前人研究进展】根据相关文献报道,在新疆甜菜产区发生较为普遍或为害较大的病害有根腐病、立枯病、褐斑病、白粉病和丛根病等[3]。甜菜黄萎病的发生也有报道,但迄今国内对甜菜黄萎病的认识一直是将其作为植原体病害来理解的[4-5]。由于植原体病害在病原鉴定上存在一定的难度,国内有关甜菜黄萎病的报道多以病害的发生调查和防控为主,对其病原菌的研究较少[4-5]。国外曾报道,变黑轮枝菌(Gibellulopsisnigrescens)和大丽轮枝菌(Verticilliumdahliae)均为甜菜黄萎病的病原[6-7]。【本研究切入点】新疆部分甜菜种植区内发现一种与许多作物真菌性黄萎病症状类似的甜菜病害,叶片常表现为黄化、萎蔫,直至枯死,且以半叶黄化居多,而国内文献对此尚无报道。需研究该病病原及病名。【拟解决的关键问题】以传统形态学分类为基础,结合核糖体内转录间隔区(Internal transcribed spacer,ITS)、核糖体大亚基(Large subunit rDNA, LSU)及肌动蛋白(Actin, ACT)基因进行多基因系统学分析,研究该病原物分类地位,并为该病定名,为该病发生发展规律及防治技术研究奠定基础。
1 材料与方法
1.1 材 料
2016年8月在新疆伊宁县、昌吉市周边和察布查尔县等地调查甜菜病害,从伊犁州伊宁县阿热吾斯塘乡、察布查尔县奶牛场周边及昌吉市周边采集多份具有典型黄萎症状的病叶样品。
1.2 方 法
1.2.1 病原菌的分离与纯化
采用常规组织分离法对采集的甜菜病样分离病原菌。将叶柄用无菌水洗净、晾干,在超净台上用75%乙醇浸润1 min,在病健交界处切取轻度变色维管束组织(约2 mm×2 mm)用2%NaClO液消毒2 min后,再用无菌水冲洗3次,置于滤纸上晾干,最后放在 PDA培养基上25℃恒温培养。待7 d左右长出菌落后,用接种针挑取菌落边缘的菌丝在PDA上进行培养,通过单孢分离法获得各分离物的纯培养。将纯化的所有菌株(菌株编号:BV1~BV5)在PDA斜面培养基上培养10 d后保存于4℃冰箱备用。选取典型菌株进行形态学观察、致病力测定以及分子鉴定。
1.2.2 致病性测定
采用牙签针刺法[8]测定致病力。将直径为6 mm的病原分离物菌饼接种在PDA培养基中心,再把10根经121℃,30 min灭菌的细小牙签(直径1 mm,长25 mm)尖端向心,呈放射状排列在菌饼周围,28℃恒温培养,待菌丝覆盖牙签尖端约10 mm时,取出带菌牙签,针刺接种于室内盆栽的甜菜健株(品种新甜6号)的叶柄基部。共接种5株,每株接种3个叶柄,共15个重复,并以剌入无菌牙签的健株叶柄(5株,15叶)为对照。接种后将甜菜植株于室内培养,每天观察,待发病后统计发病情况,并从发病叶片再次分离病原物。
1.2.3 病原菌鉴定
1.2.3.1 病原菌的形态
将回接证病试验确定其致病性的菌株接种于PDA培养基上,28℃恒温培养20 d左右,观察并记录菌落特征和菌体显微形态特征,以及是否产生厚垣孢子、休眠菌丝及微菌核等休眠结构。
1.2.3.2 病原菌rDNA-ITS、LSU、ACT片段的PCR扩增和序列测定
依据病原菌形态学鉴定和致病力验证结果,将分离所得致病菌接种在PDA培养基上于28℃培养15 d后刮取菌丝,再用液氮将菌丝充分研磨,利用植物基因组提取试剂盒(TIANGEN BIOTECH 公司,DP320-03)提取菌丝基因组DNA。
以25 μL的反应体系在PCR仪(DL9700,北京东林昌盛生物科技有限公司)上扩增ITS、LSU及ACT基因。反应体系如下:2 ×rapPCR Master mix 13 μL,正向、反向引物(10 μmol/L)各1 μL,模板DNA 1 μL,ddH2O 补足至25 μL。ITS基因PCR扩增反应程序如下:94℃预变性4 min,94℃变性1 min,55℃退火1 min,72℃延伸1 min,总共37个循环,最后72℃延伸10 min;LSU基因PCR扩增反应程序如下:94℃预变性5 min,94℃变性45 s,53℃退火55 s,72℃延伸1.5 min,总共28个循环,最后72℃延伸10 min。ACT基因PCR扩增反应程序如下: 94℃预变性2 min,94℃变性 1 min,58℃退火1 min,72℃延伸1 min,40个循环,最后72℃延伸7 min。扩增产物4℃保存。变黑轮枝菌的ITS、LSU及ACT序列的扩增片段及引物。表1
取5 μL PCR扩增产物在1%琼脂糖凝胶中电泳,以2 000 bp DNA Marker为参照,检测产物片段大小。上海生工对该扩增产物测序,将测序后的序列在核酸序列数据库GenBank中进行序列同源性比对并提交,利用软件MEGA5.05比对并构建系统发育树。

表 1 扩增片段及其引物Table 1 Primer sequence for PCR amplification
2 结果与分析
2.1 病害田间症状
研究表明,在中国新疆伊宁县、察布查尔县及昌吉市周边的甜菜种植区内发现一种与许多作物真菌性黄萎病症状类似的甜菜病害,该病害主要症状表现在甜菜叶部,感病后轻者叶片黄化萎蔫,植株矮缩,重者枯死,且以中脉为界半叶发病者较多,疑为甜菜真菌性黄萎病。经田间病害高发期为7~9月,发病田可见大量的甜菜黄萎病病株。发病初期一般老叶先黄化,轻病株仅下部叶片黄化枯萎,重病株除心叶外全部叶片黄化枯萎(图1A);病叶上有明显的沿叶脉扩展,致脉间黄化(图1B),或半叶黄化枯萎(图1C)。发病后期感病叶片边缘向内卷曲,萎蔫,直至整个叶片枯死。剖检叶柄可见维管束略有变色,但不显著。上述症状与茄子黄萎病等多种植物真菌性黄萎病症状相似。而在调查中未见植株明显矮化,新叶短小、狭窄等症状[4],该病有别于植原体黄萎病。判断此病为真菌性黄萎病。图1

图1 甜菜黄萎病田间症状Fig.1 Sugar beet yellow wilt Symptoms on naturally infected leaf
2.2 病原菌的分离及致病性
研究表明,新疆伊宁县、昌吉市周边和察布查尔县等地采集的10份病样,约40个分离块上以较高频率分离到一种与轮枝菌菌落形态及产孢结构相似的真菌,分离频率约40%。并纯化获得5个典型菌株。
接种8 d后甜菜幼苗开始显症,部分接种叶出现脉间褪绿、黄化,或局部萎蔫干枯等症状(图2A),接种发病率约12%。接种15 d后,部分接种叶片黄化、枯死(图2B);接种发病率约为71%;而无菌牙签接种的幼苗长势良好未出现发病症状(图2C)。在被侵染叶片中可再次分离出与接种菌形态一致病分离物。人工牙签针刺接种引起的发病症状与田间自然发病症状基本一致。图2

注:A,B.发病甜菜植株;C.健康甜菜植株
2.3 病原菌的培养性状及菌体形态特征
研究表明,菌株在PDA培养基上生长较为缓慢,菌落初期呈白色,气生菌丝不发达,表面常有大小不等的白色菌丝团,并产生灰白色粉末及同心轮纹,边缘较为整齐,培养后期菌落逐渐变为灰黑色,菌落背面灰黑至黑色(图3A)。菌丝体中有明显的轮枝状分生孢子梗,分生孢子梗细长无色,常有二次轮状分枝,即分支小梗轮生于分生孢子梗上,产孢小梗又呈轮枝状着生于分生小梗上,一般每轮3~4根小枝并常在枝端聚集成容易散落的孢子球(图3B),长度为25~45 μm(30 μm avg.)。分生孢子无色透明,呈圆形或椭圆形,大小为3.7~6.8×1.8~3 μm(n=100)(图3C);其休眠体为厚垣孢子,卵圆形、球形或不规则形,深褐色,一般3~5个串生,直径5.5~8.5 μm(n=100),成熟后彼此间分散(图3D);不产生微菌核与休眠菌丝。与大丽轮枝菌有明显区别,而与已报道的Gibellulopsisnigrescens[7]的形态描述比较一致。图3

注:A.PDA培养基上的菌落;B.分生孢子梗;C.分生孢子;D.厚垣孢子 标尺:B,C,D=20 μm
2.4 病原菌ITS、LSU及ACT序列
研究表明,对BV4菌株ITS、LSU、ACT区进行PCR扩增和产物序列测定,分别获得长度为525、879和261 bp的片段。将所测菌株序列提交至GenBank,获得序列登陆号分别为MG824977.1、MH229355.1和MN700655.1。利用该菌株序列在NCBI中进行BLAST比对,确定亲缘关系最近的种属。从数据库中获得相关序列,通过软件MEGA5.05,采用邻接法(Neighbor-Joining)构建系统进化树。结果显示:菌株BV4的ITS序列与G.nigrescens(MG855143.1)在同一分支,同源性为99%;LSU序列与Gibellulopsisnigrescens(MH866593.1)在同一分支,同源性为99%;ACT序列与Gibellulopsisnigrescens(JN18840.1)在同一分支,同源性为100%。
甜菜真菌性黄萎病的病原菌为变黑轮枝菌(Gibellulopsisnigrescens),其病害为甜菜真菌性病害,可命名为甜菜黄萎病(Sugar beet Gibellulopsis yellow wilt)。图4~图7
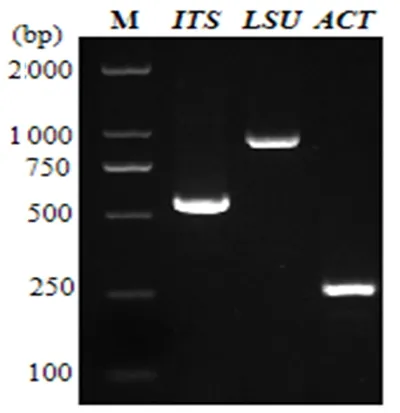
图4 基于ITS、LSU、ACT基因扩增的电泳图Fig 4. The PCR amplification product of ITS、LSU and ACT sequences

图5 甜菜黄萎病病原菌菌株BV4的ITS序列系统进化树Fig.5 Phylogenetic tree of the pathogenic strain BV4 based on rDNA-ITS sequence
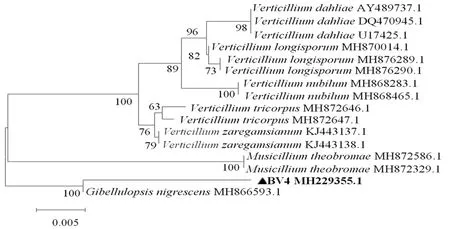
图6 甜菜黄萎病病原菌菌株BV4的LSU序列系统进化树Fig.6 Phylogenetic tree of the pathogenic strain BV4 based on rDNA - LSU sequence

图7 甜菜黄萎病病原菌菌株BV4的ACT序列系统进化树Fig.7 Phylogenetic tree of the pathogenic strain BV4 based on ACT sequence
3 讨 论
Pethybridge[12]在1917年从马铃薯块茎中分离得到一种真菌,通过形态学的分类方法将其归属于Plectosphaerellaceae科Verticillium属,并将其命名为VerticilliumnigrescensPethybr.(中文译名为变黑轮枝菌)。在2007年,对该菌ITS和LSU序列的进化树进行分析,结果发现该菌株归属于Plectosphaerellaceae科,Gibellulopsis属,最终将其拉丁名定名为Gibellulopsisnigrescens[7,13]。在2011年,Inderbitzin等[14]又基于多个基因对轮枝菌建立了新的分类框架,Verticillium属内共包含10个种,并又将黑白轮枝菌细分为3个种,即为黑白轮枝菌(Verticilliumalbo-atrum)、苜蓿轮枝菌(Verticilliumalafalfae)和非苜蓿轮枝菌(Verticilliumnonalfalfa)。G.nigrescens与Verticillium属内种不易区分,但各菌种在PDA培养基上培养2周后均菌丝休眠结构略有不同。黑白轮枝菌(Verticilliumalbo-atrum)和大丽轮枝菌(Verticilliumdahliae)分别以暗褐色菌丝体或菌核作为休眠结构;三体轮枝菌(Verticilliumtricorpus)可同时产生厚垣孢子、休眠菌丝、微菌核3种休眠体;云状轮枝菌(Verticilliumnubilum)和变黑轮枝菌(G.nigrescens)仅可产生深褐色厚垣孢子,而云状轮枝菌厚垣孢子的直径(8.4~17.5 μm)明显大于G.nigrescens的直径(5.3~8.1 μm)[12,15-17]。由于G.nigrescens在形态上与轮枝菌属内近似种的分生孢子梗大小、轮状分枝小梗数目、分生孢子大小上的差异不明显,而且随着培养环境的变化,一些形态特征可能不会稳定表现,仅从形态上区分仍然较为困难[18]。
真菌ITS序列是介于与5.8S rRNA、18S rRNA及28S rRNA之间的区域,其序列不加入成熟核糖体,进化速率较快且更易突变累计,其在种内高度保守,种间差异较为明显。属内种间和亚种间的分类鉴定常以ITS序列为依据[19]。近年来,据文献报道,在种内鉴定中ITS的区分度不是很理想,这说明利用单独特定片段作为DNA条形码具有一定的局限性。因此,结合其他序列作为辅助鉴定就显得很有必要[20]。核糖体大亚基(LSU)序列是一段相对保守的位于25~28S的RNA序列[21],Zare通过分析LSU序列,完成了轮枝菌属内种间的物种鉴定,并发现新的分类单元。ITS与LSU序列已逐渐成为鉴定大部分丝状真菌的DNA条形码[22]。ACT基因也常作为多基因联合鉴定中的基因之一来区分轮枝菌属内种与G.nigrescens[14],在菌物鉴定过程中,采用多基因位点来识别和鉴定已逐渐成为趋势。因此,研究分析了变黑轮枝菌的ITS、LSU及ACT序列,也证明这3个基因可以将变黑轮枝菌与其它近似种进行区分。其中,分离菌株的ACT基因与G.nigrescen的ACT基因的同源性高达100%,且在该序列比对结果中未出现轮枝菌属相关种,因此,目前可将ACT基因作为首选片段将其近似种区分,从而达到快速鉴定的目的。
甜菜黄萎病的病原菌包括变G.nigrescens和V.dahliae,但关于甜菜来源的G.nigrescens报道甚少。多地曾报道甜菜黄萎病的发生,经鉴定其病原菌均为V.dahliae[6,23-25]。而Zare[7]在2007年曾报道G.nigrescens可引起甜菜黄萎病,这与研究结果一致。研究从采集到的甜菜病株上未分离出V.dahliae,可能与采集的病样数较少有关。新疆甜菜种植区分布较广,甜菜真菌性黄萎病是否存在由V.dahliae与G.nigrescens复合侵染的情况,有待于广泛采样开展进一步研究。
20世纪70、80年代,国内外大量报道均将植原体作为甜菜黄萎病病原,其症状描述也与研究观察到的症状有不少相似之处,是否存在植原体、G.nigrescens、Verticillium属内致病种混合侵染的情况或其病原种类是否存在地域差异有待进一步研究。
目前,国内还未见甜菜来源的G.nigrescens的报道,但据已有报道,G.nigrescens寄主种类较为繁多[26]。1982年,陈吉棣[27]从马铃薯、菜豆、茄子、豇豆和芹菜等植物上分离出G.nigrescens;1987年,王克荣[28]从棉花黄萎病病株中分离出G.nigrescens,并发现其在棉花上表现弱致病力;2009年,段维军[29]在宁波从进境芹菜中分离出G.nigrescens;2010年,Hu等[30]从苜蓿分离出一株G.nigrescens。该菌寄主范围较广。今后宜对各寄主的危害情况及该菌在甜菜等多种作物的潜在风险评估,以及针对该病害的控制方法开展进一步的研究。
4 结 论
新疆甜菜真菌性黄萎病的病原菌为变黑轮枝菌,其病害可命名为甜菜黄萎病,是变黑轮枝菌在甜菜上的国内新寄主记录。
