纤维素降解菌的分离、鉴定与产酶条件探究
2022-04-01佀胜利邹莎莎吴书云王成湘
佀胜利 邹莎莎 吴书云 王成湘


摘 要 从林下腐熟土壤中筛选可降解纤维素的天然微生物,经过初筛、复筛得到降解能力较强的菌株DT13,革兰氏染色和分子生物学鉴定结果显示该菌株为枯草芽孢杆菌(Bacillus subtillis DT13)。以羧甲基纤维素酶活性(Carboxymethyl Cellulase Activity,CMCA)为指标,设计单因素试验与正交试验对菌株DT13产纤维素酶条件进行优化,确定其最佳产酶条件为初始pH值7.0、发酵温度40 ℃、发酵时间96 h。
关键词 芽孢杆菌;羧甲基纤维素酶活性;发酵条件;酶活测定
中图分类号:Q93 文献标志码:B DOI:10.19415/j.cnki.1673-890x.2022.02.007
纤维素是植物细胞壁的主要成分之一,是自然界中现有数量最多且最低廉的资源,目前尚未得到充分合理的利用[1]。在自然状态下,纤维素的生物降解主要通过微生物分泌的纤维素酶来完成,降解过程无污染、成本低,因而纤维素降解微生物的筛选一直受到研究者的关注[2-3]。自然界存在的产纤维素酶的微生物种类较多,对纤维素的降解能力差异较大,通过对其培养条件的优化可以有效提高产纤维素酶的效率和对纤维素的降解能力[4-6]。
1 材料与方法
1.1 土壤样品
多年自然生长松树林下充分腐熟的松针土,采集于贵州省镇远县。
1.2 培养基
富集培养基:K2HPO4 1.00 g·L-1、NaCl 0.10 g·L-1、MgSO4·7H2O 0.30 g·L-1、NaNO3 2.50 g·L-1、FeCl3 0.001 g·L-1、CaCl2 0.10 g·L-1。培养基按照每瓶50 mL进行分装,每个三角瓶中放入约0.50 g滤纸条,121 ℃灭菌20 min。
筛选培养基:(NH4)2SO4 2.00 g·L-1、MgSO4·7H2O 0.50 g·L-1、K2HPO4 1.00 g·L-1、NaCl 0.50 g·L-1、羧甲基纤维素钠(CMC-Na)2.00 g·L-1、琼脂20.00 g·L-1,121 ℃灭菌20 min。
含刚果红的筛选培养基:在筛选培养基中加入2.00 g·L-1刚果红。
发酵培养基:蛋白胨3.00 g·L-1、酵母粉0.50 g·L-1、(NH4)2SO4 2.00 g·L-1、KH2PO4 4.00 g·L-1、CaCl2 0.30 g·L-1、MgSO4·7H2O 0.30 g·L-1,121 ℃灭菌20 min。
1.3 纤维素降解菌株的筛选
称量1.00 g土壤样品,在30 ℃ 150 r·min-1富集培养基中振荡培养至滤纸条完全裂解。用无菌水连续稀释培养后的富集培养基,得到10-7稀释液,取稀释液200 μL均匀涂布到含刚果红的筛选培养基上,30 ℃恒温培养,待菌落长出后,挑选培养特征不同且具有明显透明圈的单菌落转接到筛选培养基,纯化后冷冻保存。将纯化后的菌株转接筛选培养平板,30 ℃恒温培养24 h。用0.5%的刚果红溶液染色60 min,再用1 mol·L-1 NaCl溶液褪色60 min,观察染色后的透明圈大小。选择透明圈直径(D)/菌落直径(d)比值较大的菌株,接入发酵培养基,30 ℃ 150 r·min-1培养72 h,测定培养液的羧甲基纤维素酶活性(CMCA),选择CMCA最高的菌株,进行下一步试验。
1.4 纤维素降解菌株的鉴定
1)形态学鉴定。接种菌株到筛选培养基培养24 h,观察菌落培养特征,进行革兰氏染色。
2)分子生物学鉴定。将培养24 h的纯化菌液送至生工生物工程(上海)股份有限公司进行鉴定,利用细菌16S rDNA通用引物27F(5'-AGAGTTTGATCATGGCTCAG-3')、1492R(5'-TAGGGTTACCTT GTTACGACTT-3')对菌株16S rDNA序列进行扩增,对PCR产物纯化回收后测序,利用BLAST软件将测序结果与GenBank中已有序列进行比对,使用MEGA-X软件构建系统发育树,确定菌株的种属。
1.5 发酵条件对纤维素降解菌株产纤维素酶的影响
1.5.1 单因素试验
选取发酵时间、发酵初始pH值和发酵温度进行单因素试验,研究各因素对筛选出的菌株产纤维素酶的影响。将筛选出的菌株接种到一定初始pH值的发酵培养基中,在指定温度下150 r·min-1振荡培养一定时间,将发酵液3 000 r·min-1离心10 min,得粗酶液。测定单因素条件下粗酶液的CMCA确定合适的正交设计参数。每个处理设3个重复组。
1.5.2 正交优化
依据单因素试验结果,选择发酵时间、初始pH值和发酵温度,设计3因素3水平正交试验,采用L9(33)正交表。
1.6 纤维素酶活性的测定
纤维素酶活性用DNS法进行测定[6]。在特定条件下,1 mL粗酶液1 min转化产生1μg还原糖所需的酶量规定为1个酶活力单位(U)。取0.50 mL粗纤维素酶溶液、1.00 mL柠檬酸缓冲液(pH=4.8)和1.50 mL CMC-Na溶液充分混匀,50 ℃ 150 r·min-1酶解180 min,之后加入3.00 mL DNS溶液,充分混匀后沸水浴5 min,冷却后加入3.00 mL蒸馏水,充分混匀后在540 nm处测定吸光值。同时,设置底物空白和酶空白。
1.7 葡萄糖标准曲线的制作
向干燥试管中分别加入1.00 mg·mL-1标准葡萄糖溶液0.00 mL、0.30 mL、0.60 mL、0.90 mL、1.20 mL、1.50 mL,再分别加蒸馏水至体积为1.50 mL,加入DNS试剂3.00 mL,混匀,沸水浴5 min后冷却,最后用蒸馏水定容至10 mL,充分混匀后测定在540 nm的吸光值。以葡萄糖濃度为纵坐标,吸光值为横坐标,得到葡萄糖标准曲线方程为y=1.290 8x+0.059 4(R2=0.999 1)。
2 结果与分析
2.1 纤维素降解菌株的筛选
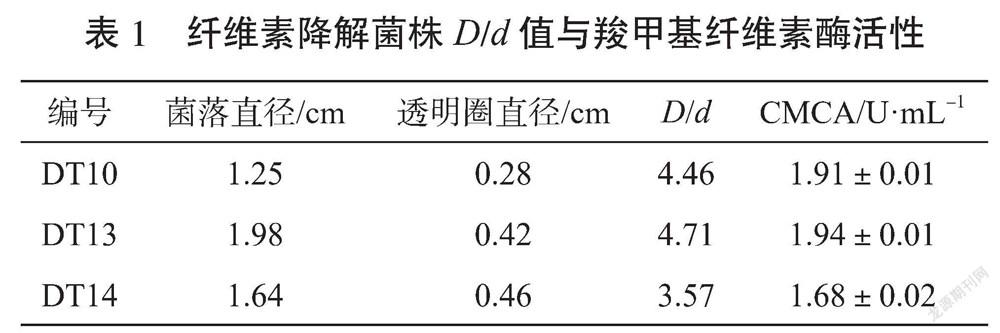
将富集液稀释后涂平板,共分离纯化得到12个产生明显降解圈的纤维素降解菌株。对转接后的菌株进行刚果红染色,如图1所示。通过测定透明圈直径(D)和菌落直径(d),菌株DT10、DT13、DT14的透明圈直径比值(D/d)较大。测定3个菌株发酵所得粗酶液的CMCA,如表1所示,DT13的酶活最高,作为进一步研究的菌株。
2.2 纤维素降解菌株的鉴定
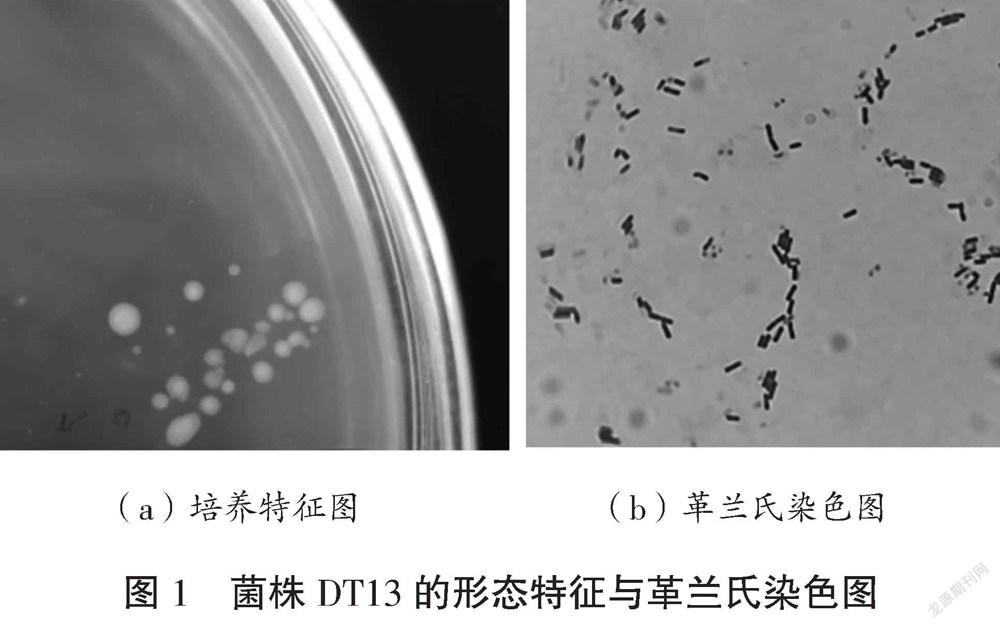
DT13菌株在筛选培养基上生长24 h的菌落呈白色、圆形、湿润无皱褶,如图1(a)所示。经革兰氏染色后显微观察,菌体为细杆状,呈紫红色,为革兰氏阳性菌,如图1(b)所示。该菌株经DNA提取、PCR扩增获得长度为1 434 bp的16S rDNA片段,通过BLAST序列比对,菌株DT13与枯草芽孢杆菌(B.subtillis)相似度在99.7%以上;選择相似度较高的代表菌株构建系统发育树,见图2,DT13与枯草芽孢杆菌的进化关系较近,可靠性较高,确定菌株DT13为枯草芽孢杆菌(B.subtillis)。
2.3 发酵条件对菌株DT13产纤维素酶的影响
2.3.1 发酵条件对纤维素酶产量影响的单因素试验
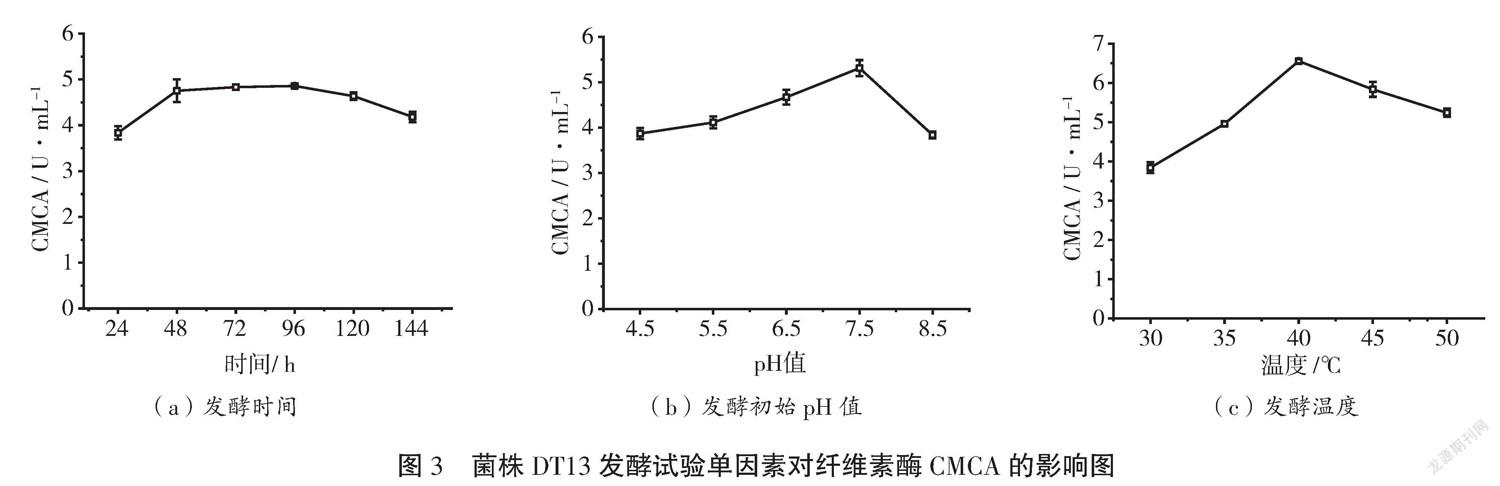
将菌株DT13在30 ℃ 150 r·min-1条件下进行纤维素酶发酵144 h,自发酵开始每隔24 h取出一次样品测定其纤维素酶粗酶液的CMCA。结果如图3(a)所示,CMCA随着发酵时间的增加呈增加趋势,在96 h时达到最高,为4.86 U·mL-1;菌株DT13接种在不同初始pH值的发酵培养基中,在30 ℃ 150 r·min-1条件下发酵96 h,发酵后粗纤维素酶液的CMCA如图3(b)所示,CMCA随着pH值的增加而增大,至pH值7.5时达到最大,为5.31 U·mL-1;菌株DT13接种在初始pH值为7.5的发酵培养基中,在不同温度150 r·min-1条件下发酵96 h,发酵后粗纤维素酶液的CMCA如图3(c)所示,CMCA随着温度的增加而增大,至40 ℃时达到最高值,为6.56 U·mL-1,温度继续增加CMCA呈下降的趋势。综合试验结果,菌株DT13发酵产纤维素酶的较合适的单因素条件分别为发酵时间96 h、初始pH值7.5、发酵温度40 ℃。
2.3.2 正交试验设计结果
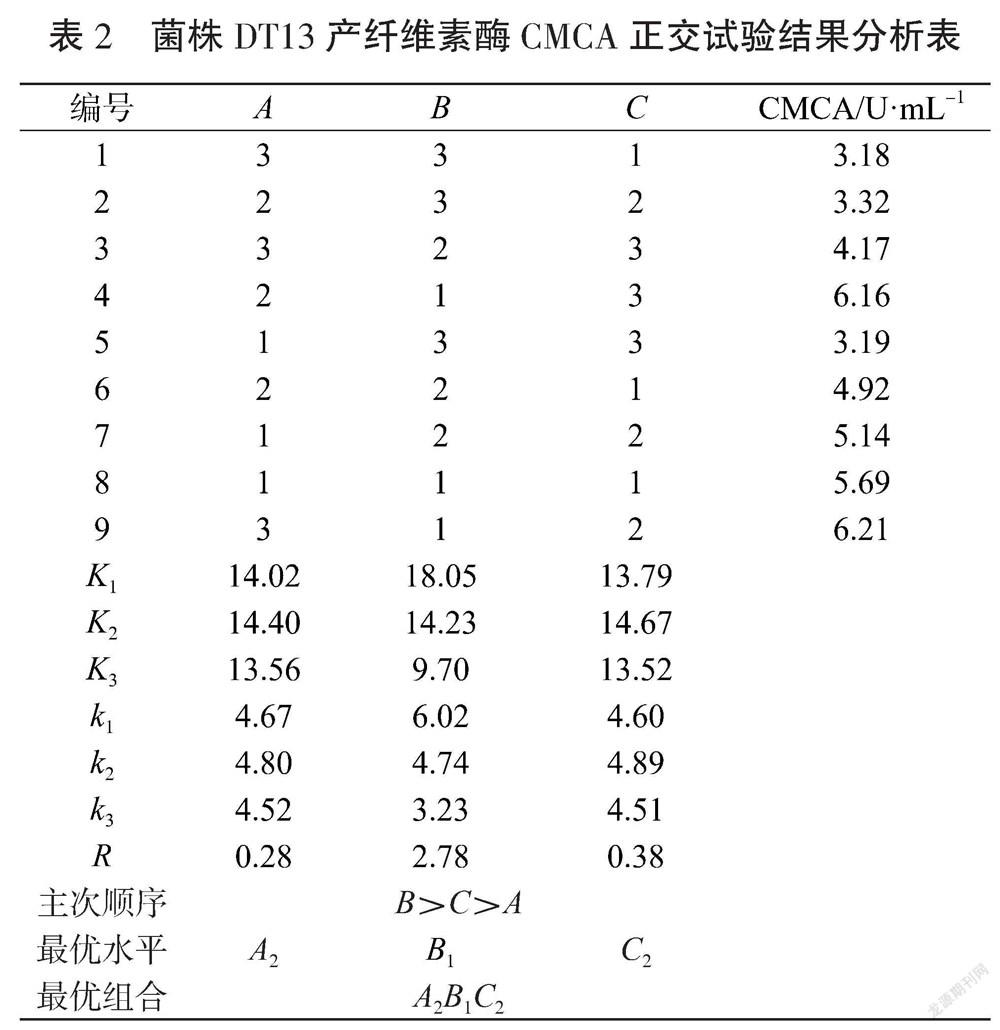
根据单因素试验结果,选择A发酵时间(84 h、96 h、108 h)、B初始pH值(7.0、7.5、8.0)、C发酵温度(37 ℃、40 ℃、43 ℃)设计3因素3水平正交试验。发酵结束后,测定各组合得到的粗酶液的CMCA,试验结果如表2所示。影响发酵产纤维素酶CMCA的3个因素排序为初始pH值(B)>发酵温度(C)>发酵时间(A),产酶的最佳组合为A2B1C2。
2.3.3 验证试验
正交极差分析表中,A3B1C2培养组合所产的CMCA值最高,选取A2B1C2、A3B1C2发酵组合进行验证试验,结果如表3所示,组合A2B1C2所产生的粗酶液的CMCA约为6.69 U·mL-1,显著高于组合A3B1C2。因此,确定菌株DT13的最佳培养组合为A2B1C2,即初始pH值7.0、发酵温度40 ℃,发酵时间96 h。
3 结论
本研究从森林腐熟土壤中筛选出一株产纤维素降解菌DT13,经形态学、革兰氏染色和分子生物学鉴定确定DT13为枯草芽孢杆菌(B.subtillis)。通过单因素试验和正交试验设计,对菌株DT13发酵产纤维素酶的条件进行研究,确定菌株DT13的最佳发酵条件为初始pH值7.0、发酵温度40 ℃、发酵时间96 h。
参考文献:
[1] 任晓冬,史旭洋,尚鑫,等.木质纤维素预处理研究进展[J].吉林农业大学学报,2016,38(5):567-570.
[2] 王士强,顾春梅,赵海红.木质纤维素生物降解机理及其降解菌筛选方法研究进展[J].华北农学报,2010,25(S1):313-317.
[3] 许从峰,艾士奇,申贵男,等.木质纤维素的微生物降解[J].生物工程学报,2019,35(11):2081-2091.
[4] 杨茜,李维尊,鞠美庭,等.微生物降解木质纤维素类生物质固废的研究进展[J].微生物学通报,2015,42(8):1569-1583.
[5] 张俊,许超,张宇,等.纤维素酶降解机理的研究进展[J].华南理工大学学报(自然科学版),2019,47(9):121-130.
[6] 薛藩.纤维素降解微生物的筛选及高效纤维素酶活条件研究[D].扬州:扬州大学,2019.
(责任编辑:刘宁宁)
