棘球蚴通过mTOR途径抑制糖酵解的研究
2022-03-31刘颖颖孟娟娟许军英陈雪玲
刘颖颖,孟娟娟,常 瑗,蔺 珂,廖 原,许军英,侯 隽,陈雪玲,王 仙
棘球蚴病(又称囊型包虫病)是细粒棘球绦虫幼虫寄生而引发的一种人兽共患病[1]。感染后,患者体内T细胞的分化出现偏移,表现出以Treg细胞为主的免疫抑制,但其机制尚不清楚[2]。代谢免疫学研究[3]表明,T细胞的分化与代谢选择有密切关系,效应T细胞采用有氧糖酵解 。调控糖酵解,可以影响T细胞的分化方向,上调糖酵解可促进Th17细胞分化,抑制Treg细胞的生成[4-5]。mTOR通路是调控糖酵解代谢中经典的能量代谢通路[6]。该研究通过构建棘球蚴感染小鼠的疾病模型,初步探讨mTOR途径是否参与调控T细胞的糖酵解代谢,为进一步研究在包虫病中糖酵解对宿主T细胞的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1小鼠与感染棘球蚴的羊肝来源 30只6~8周龄,体质量约为20 g的Balb/c小鼠,购于新疆医科大学实验动物中心;感染棘球蚴的羊肝来自新疆昌吉自治州屠宰场。
1.1.2主要试剂与仪器 RPMI-1640购自美国GIBCO公司,胎牛血清购自以色列BI公司,小鼠脾脏淋巴细胞分离液、SDS-PAGE凝胶制备试剂盒购自北京索莱宝公司,流式抗体、Fixation/Permeabilization Buffer、Brefeldin A(BFA)和逆转录试剂盒均购自美国Thermo Fisher Scientific公司,Western blot抗体购自美国Cell Signaling Technology公司,PMA/Ionomycin购自中国联科生物有限公司,总RNA提取试剂盒购自美国 Omega Bio-Tek公司。
1.2 方法
1.2.1提取原头蚴 清水多次冲洗感染棘球蚴的羊肝后,用75%乙醇喷洗消毒,以50 ml注射器抽取棘球蚴囊液,静置后留取沙粒样沉淀,用含有1%青-链霉素混合液的PBS冲洗10次,以除去残留囊皮和活性不好的原头蚴。将原头蚴吹打混匀后,吸取50 μl混合液滴加于载玻片上,然后加入5 μl伊红染液,混匀静置30 s,显微镜下观察计数,原头蚴活性>95%。
1.2.2构建棘球蚴感染小鼠模型 将30只健康Balb/c小鼠,随机分为对照组、感染组和抑制剂组,每组10只。感染组和抑制剂组肝被膜下接种5 000个原头蚴,对照组则接种同等体积的PBS。同时,抑制剂组从第2天起每日腹腔注射雷帕霉素(1.25 mg/kg)。
1.2.3采集外周血 摘除小鼠眼球收集血液,待血液凝固后,8 000 r/min,离心10 min,分装上层血清,-80 ℃冰箱保存,备用。
1.2.4制备脾脏淋巴细胞悬液 摘除小鼠脾脏,刮取脾脏细胞,将淋巴细胞分离液分离得到的细胞,用含10%胎牛血清的1640培养基制备成1×107/ml的细胞悬液,备用。
1.2.5Western blot检测mTOR途径的蛋白表达 提取蛋白样本,按照说明书配制一抗和二抗缓冲液,制备SDS-PAGE凝胶,4 ℃过夜,取出制胶梳,按照分组向孔内加入蛋白Marker(8 μl)或样本蛋白(20 μl)进行电泳,剪取适当大小的PVDF放入甲醇激活5 min,转膜,5% BSA封闭2 h,加入一抗缓冲液4 ℃慢摇过夜,1×TBST洗膜3次,每次计时10 min,孵育二抗1 h,1×TBST洗膜3次,每次计时10 min,将ECL发光试剂盒中的A液和B液,按照1 ∶1比例配制显色液,然后滴加在PVDF膜上,使显色液与膜上蛋白充分结合后,曝光,拍照及初步处理图像,Image J扫描条带蛋白灰度值。
1.2.6qRT-PCR检测糖酵解相关转录因子的mRNA表达 用试剂盒提取各组细胞总RNA后采用Nanodrop 2000测定浓度,逆转录成cDNA,按SYBR Green两步法操作进行qRT-PCR检测糖酵解代谢中酶以及乳酸转运蛋白:己糖激酶3 (hexokinase 3, HK3)、丙酮酸激酶M2(pyruvate kinase M2, PKM2)、乳酸脱氢酶A(lactic dehydrogenase A, LDHA)和单羧酸转运蛋白4(mnocarboxylate transporter 4, MCT4)的mRNA表达。引物序列见表1,以β-actin为内参,采用2-ΔΔCt法进行数据分析。

表1 相关引物序列
1.2.7流式细胞术检测Th17和Treg细胞 每组取1×106个脾脏淋巴细胞至各标记管中,按照标记分别加入 CD4-PE、CD25-Percpcy 5.5,4 ℃避光孵育30 min,PBS洗涤1次,洗去未结合的抗体,固定、破膜后再按照标记分别加入IL-17A-FITC、FoxP3-FITC,各自4 ℃避光孵育30 min和40 min后,破膜液洗涤1次,加500 μl PBS重悬细胞,上机,Flowjo 10软件处理数据绘制图。
2 结果
2.1 原头蚴活性的测定在光学显微镜下可以观察到伊红染色后的原头蚴,着色为深红色的是已经凋亡的,未着色的为活性好的。见图1。
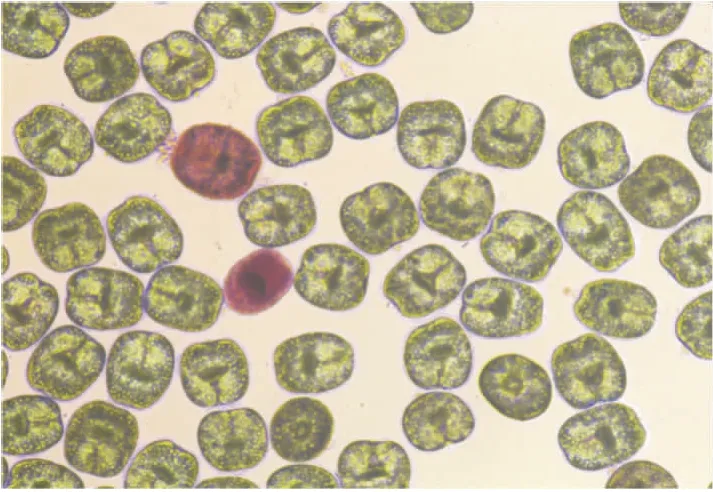
图1 不同视野下原头蚴伊红染色 ×40
2.2 棘球蚴感染小鼠肝脏的大体形态感染后,小鼠肝脏在15 d可见有乳白色囊泡形成,在30 d可见乳白色囊泡体积增大并凸起,70 d可见囊泡不仅体积增大,也向周围扩散,囊泡的数量增多,囊泡透明度增加并有囊液的形成。见图2。
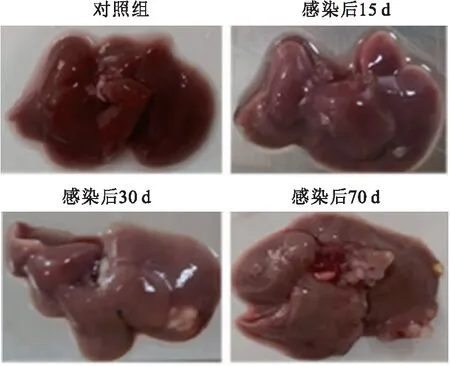
图2 棘球蚴感染小鼠不同时间的肝脏
2.3 棘球蚴感染后糖酵解变化与mTOR途径的蛋白表达通过 qRT-PCR检测HK3、PKM2、LDHA和MCT4的mRNA表达反映糖酵解代谢的变化,如图3A所示,与对照组比较,棘球蚴感染后,感染组中糖酵解相关转录因子的mRNA表达水平降低,且均在感染后70 d达到最低,其中HK3(F=50.63,P<0.001)、PKM2(F=26.52,P<0.05)、LDHA(F=22.16,P<0.05)和MCT4(F=18.84,P<0.05);感染后15、30和70 d各组mTOR下游分子的蛋白表达由Western blot检测,如图3B~E所示,各指标蛋白相对表达量分别为[HIF-1α (0.42±0.034)、 (0.11±0.006)、(0.18±0.006) 和 (0.01±0.003),F=196.4,P<0.000 1;P-p70S6 (0.57±0.055)、(0.08±0.026)、(0.12±0.025)和(0.06±0.028),F=87.76,P<0.000 1;P-4EBP-1 (0.58±0.071)、(0.19±0.056)、(0.28±0.028)和(0.15±0.058),F=24.73,P<0.01]。与对照组比较,感染后HIF-1α、P-p70S6和P-4EBP-1的蛋白表达降低(均P<0.05)。
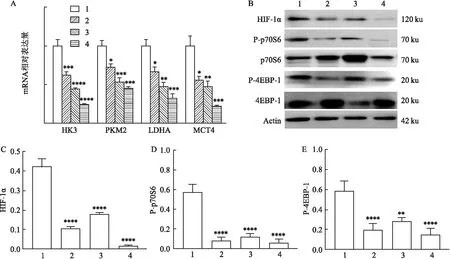
图3 棘球蚴感染后糖酵解变化与mTOR途径的蛋白表达
2.4 抑制mTOR途径对糖酵解的影响
2.4.1雷帕霉素抑制mTOR途径 对照组、感染组和抑制剂组中mTOR下游分子的蛋白表达由Western blot检测,各指标蛋白相对表达量分别为[HIF-1α (0.37±0.035)、(0.15±0.040) 和 (0.06±0.018),F=59.24,P<0.05;P-p70S6 (0.86±0.007)、(0.26±0.024)和 (0.18±0.014),F=649.30,P<0.01;P-4EBP-1 (0.73±0.020)、(0.31±0.021) 和 (0.19±0.008),F=535.80,P<0.001]。与对照组比较,感染组和抑制剂组中淋巴细胞内mTOR下游分子的蛋白表达明显降低 (均P<0.05)。见图4。
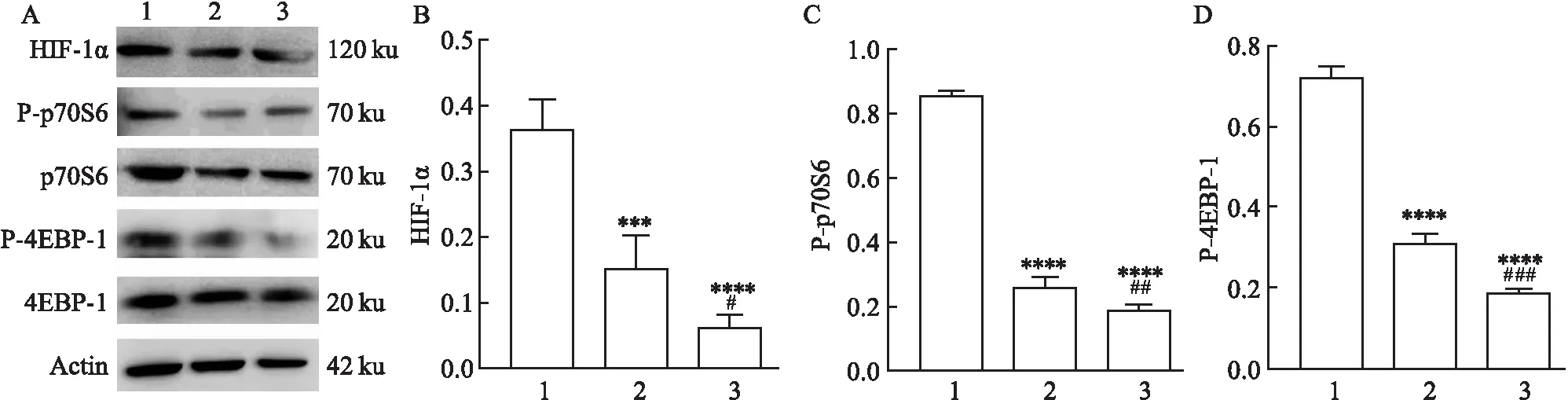
图4 雷帕霉素抑制mTOR途径
2.4.2抑制mTOR途径对糖酵解代谢变化的影响 qRT-PCR检测HK3、PKM2、LDHA和MCT4的mRNA表达,与对照组和感染组比较,抑制剂组淋巴细胞内的糖酵解相关转录因子的mRNA表达水平明显降低,其中HK3(F=65.39,P<0.01)、PKM2(F=13.43,P<0.01)、LDHA(F=26.81,P<0.05)和MCT4(F=28.44,P<0.05),见图5A。PMA/Inomycin和BFA刺激小鼠脾脏淋巴细胞5 h后,收集细胞,流式细胞术检测脾脏淋巴细胞中Th17和Treg细胞的比例,在对照组、感染组和抑制剂组中CD4+IL-17A+(Th17)细胞的百分比分别是(5.60±0.49)%、(2.78±0.38)%和(1.26±0.06)%(F=67.79,P<0.01);CD4+CD25+Foxp3+(Treg)细胞的百分比分别为(4.98±1.30)%、(10.96±0.45)%和(14.30±1.07)%(F=92.12,P<0.001)。与对照组和感染组比较,抑制剂组Th17细胞比例降低,Treg细胞比例升高(P<0.05),见图5B~D。
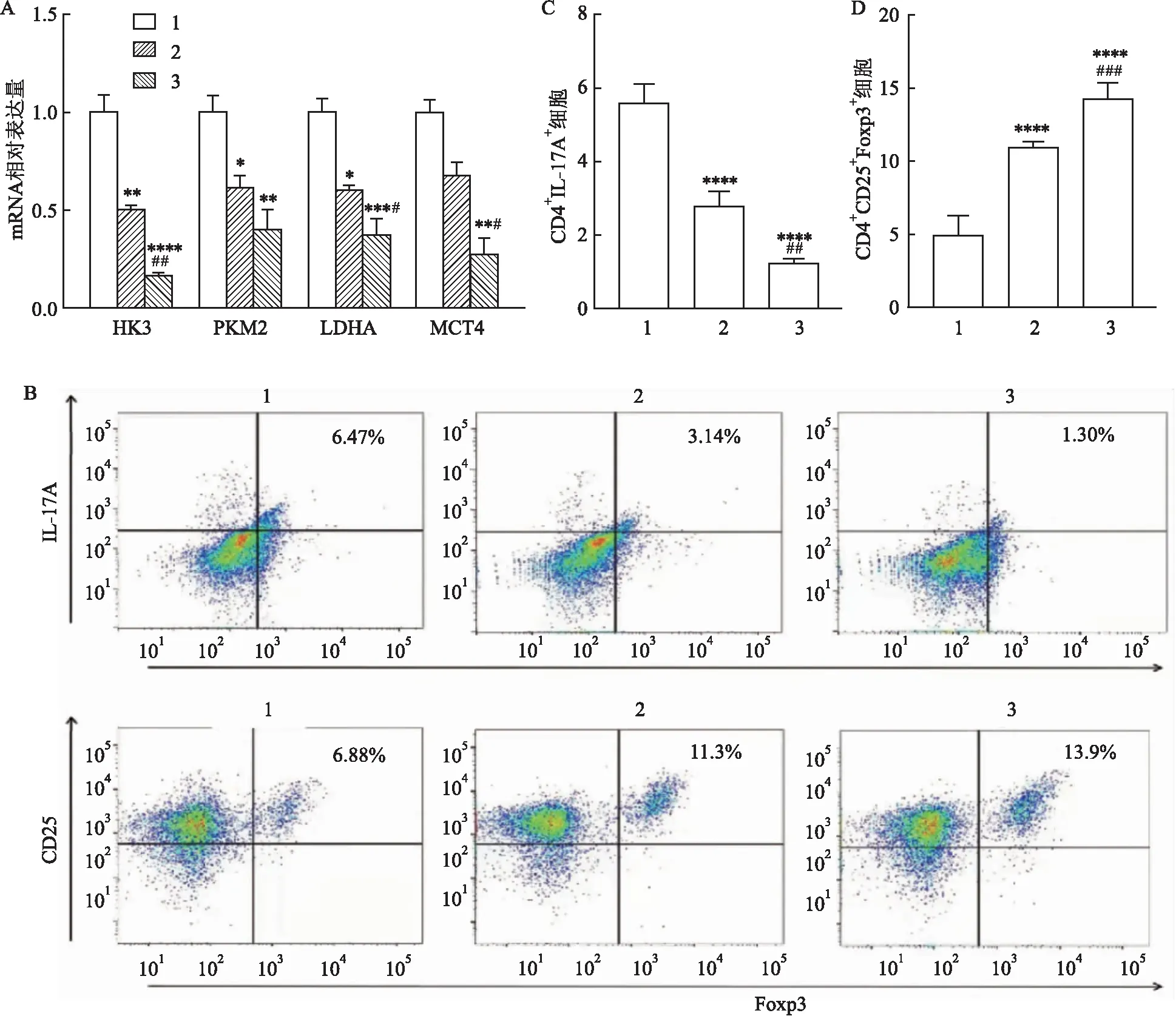
图5 阻断mTOR对糖酵解代谢变化的影响
3 讨论
犬类作为终宿主排出含有虫卵的粪便,污染土壤、水流和食物,通过粪-口传播进入中间宿主体内,棘球蚴常寄生于肝脏和肺脏,形成一个囊状体,并随着寄生时间延长不断长大,压迫和破坏器官[7-8]。研究发现[9-10],棘球蚴感染早期,机体的免疫应答以Th1和Th17细胞主导的炎症反应,有利于抗包虫的保护作用;感染晚期,机体的免疫应答向Th2细胞方向偏移,甚至出现Treg细胞负调控,免疫应答受到抑制,不利于虫体的清除。据报道[11-12],有氧糖酵解在T细胞的增殖、分化和应答中有着至关重要的作用,当初始T细胞在抗原刺激后会广泛的活化,表现出糖酵解代谢加强,以及葡萄糖和氨基酸摄取的增加。即使在氧气充足的情况下,仍然是依靠糖酵解来生成ATP,从而快速有效地产生更多生物合成中间体,满足细胞迅速增殖的需求[13]。mTOR途径在细胞生长和增殖中发挥重要作用[14],mTOR通过激活下游的HIF-1α,能够调控多种糖酵解基因的表达如:GLUT1、PKM2、LDHA 等[15]。但在棘球蚴感染中,糖酵解的作用以及mTOR途径和糖酵解之间的关系尚不清楚。通过本研究发现,棘球蚴感染后,T细胞内mTOR的下游分子蛋白表达降低,糖酵解相关转录因子的mRNA表达降低,运用雷帕霉素阻断mTOR途径后,观察糖酵解的变化,结果显示糖酵解代谢明显抑制,提示棘球蚴感染可能通过mTOR途径抑制了T细胞内糖酵解代谢。因此,在棘球蚴感染中棘球蚴对宿主免疫的免疫抑制,可能与mTOR途径抑制糖酵解有关。
此外,流式细胞术检测了脾脏组织CD4+T细胞中Th17和Treg细胞的比例,发现当阻断mTOR引起糖酵解代谢减弱时,Th17/Treg细胞平衡偏移,但具体糖酵解在棘球蚴感染中如何影响T细胞的分化,进而影响宿主免疫反应,还需要进一步研究。
