CDH1受幽门螺杆菌感染调控及其在胃癌组织中表达分析
2022-03-31陈定宇何小凤全欣莹王琴容周建奖
陈定宇,何小凤,程 薇,全欣莹,张 瑜,赵 艳,王琴容,周建奖,谢 渊
胃癌是我国第二大常见肿瘤,其病死率高,要降低胃癌的总体病死率,早期发现并及时治疗非常重要[1]。胃癌的发生发展涉及多个方面,包括宿主因素、环境因素和幽门螺杆菌(Helicobacter pylori,Hp)感染,流行病学资料显示Hp及其特定毒力因子与胃癌的发生相关[2]。Hp是引起胃炎、消化性溃疡、胃癌和与黏膜相关的淋巴样组织淋巴瘤的主要病因之一[3]。Hp对胃黏膜损伤涉及因素众多,其中其毒素蛋白引起的损伤是一个重要的方面。Hp相关毒素蛋白包括空泡细胞毒素A(vacuolating cytotoxin,VacA)、细胞毒素相关蛋白A(cytotoxin-associated gene A,CagA)等,其中CagA是一种亲水性强的、暴露于菌体表面的外膜蛋白[4-5]。课题组前期经转录组分析发现CagA组能引起E-钙黏蛋白(epithelial cadherin,CDH1)表达增高[6]。CDH1是一种依赖钙离子的细胞黏附分子,编码E-钙黏蛋白,主要在细胞黏附和细胞极性中发挥作用[7]。有研究[8]发现CDH1基因突变可能与弥漫性胃癌的发病有关,是弥漫性胃癌的危险因素和标志之一,而目前Hp感染对CDH1表达的影响及其在胃癌发生中的作用尚不清楚。因此,该研究用Hp灌胃蒙古沙鼠和Hp感染人胃上皮细胞分析Hp对CDH1表达的影响,数据库分析CDH1在胃癌和癌旁组织中的表达差异、胃癌患者的预后分析及KEGG富集分析,检测临床人胃癌组织CDH1表达,探究Hp调控CDH1表达在胃癌发生中的作用。
1 材料与方法
1.1 材料
1.1.1蒙古沙鼠 SPF级4~5周龄雄性蒙古沙鼠50只,体质量60~100 g,购于浙江省实验动物中心,许可证号:SCXK(浙2003-0001)。在室温(20±2) ℃,湿度 55%~65%,明暗交替,光照适度,通风洁净良好条件下饲养,严格遵守SPF级动物管理规定进行饲养和动物实验。
1.1.2细胞与菌株 人胃上皮细胞AGS购于ATCC细胞库,由贵州医科大学分子生物学重点实验室保存。Hp国际标准株NCTC11637菌株由贵州医科大学分子生物学重点实验室提供。
1.1.3人胃癌组织与正常组织 人胃癌组织和正常组织由贵州医科大学附属医院病理科提供,并获得贵州医科大学附属医院伦理委员会的批准及患者知情同意。
1.1.4试剂 兔抗GAPDH(10494-1-AP)购自美国Proteintech公司;兔抗CDH1(20874-1-AP)购美国Proteintech公司;山羊抗兔二抗购自美国Proteintech公司;DMEM培养基和胎牛血清购自美国Gibco公司;双抗、胰蛋白酶均购自美国Hyclone公司;Western blot配胶试剂盒、蛋白提取试剂盒购自美国Proteintech公司。
1.2 方法
1.2.1细胞培养 人胃上皮细胞AGS培养在DMEM培养液中(含10%胎牛血清、1%青-链霉素),置于37 ℃含5% CO2的恒温培养箱内培养,待细胞贴壁生长到密度为90%以上时进行传代备用。
1.2.2细菌培养Hp国际标准株NCTC11637接种于含有10%绵羊血、0.4%Hp选择剂的哥伦比亚血琼脂平板上,置于37 ℃、5% O2、10% CO2的微需氧环境中培养,细菌接种后3 d左右待生长旺盛时,通过接种环将菌收集至含PBS的无菌离心管中,5 000 r/min、2 min离心-重悬3次,在分光光度计上确定菌液浓度。
1.2.3胃癌动物模型的构建 用Hp国际标准株NCTC11637经口接种蒙古沙鼠,间隔48 h灌胃一次,每次1 ml(15×108个/ml),共3次,连续观察24个月。分别选取Hp感染后3、12、24个月3个时间点,每个时间点各选取3只,组成Hp感染3、12、24个月实验动物组。禁食24 h、禁水12 h后处死实验动物,取出胃组织,平均分为2份,1份4%甲醛固定,1份快速液氮冷冻。以Hp未感染的蒙古沙鼠各3只为对照组。
1.2.4Hp感染细胞 在哥伦比亚血琼脂培养基上刮下Hp,用分光光度计测量菌的浓度。取胃上皮细胞计数后按1×106个/孔接种6孔板,过夜培养使细胞贴壁后,经MOI感染复数40 ∶1感染细胞,24 h后收集样品。
1.2.5免疫组化 石蜡包埋的组织切片置于二甲苯中脱蜡3次,每次10 min,再经乙醇水化脱二甲苯,100%乙醇作用3次,每次10 min,之后再90%、70%、50%、30%乙醇分别作用3 min,高温高压抗原修复,3% H2O2冷却10 min,1×PBS洗涤切片10 min,室温孵育一抗2 h,PBS洗涤3次,每次10 min,室温孵育二抗2 h,DAB显色1~3 min,PBS终止显色,苏木精染色3 min,ddH2O终止反应,氨水反蓝1~2 min,ddH2O终止反应,50%、70%、90%、无水乙醇、无水乙醇分别作用3 min,二甲苯作用3次,每次10 min,封片。
1.2.6Western blot检测CDH1蛋白的表达 按裂解液试剂盒说明书提取总蛋白,经BCA蛋白定量试剂盒定量后进行SDS-PAGE电泳2 h,转膜2 h,含脱脂奶粉的1×TBST(0.05% Tween 20)溶液室温封闭2 h,CDH1一抗(1 ∶5 000)4 ℃孵育过夜,1×TBST(0.05% Tween 20)溶液洗膜3次,每次10 min,加入二抗(1 ∶10 000)室温孵育2 h,1×TBST(0.05% Tween 20)溶液洗膜3次,每次10 min,化学发光法(ECL)显色,经化学发光成像仪曝光成像,ImageJ读取灰度值。
1.3 统计学处理采用SPSS 18.0软件进行数据分析,采用t检验进行组间均数比较。验证Hp感染AGS细胞对CDH1调控的影响,采用t检验。验证Hp感染感染蒙古沙鼠后对CDH1调控的影响,采用χ2检验。生存曲线分析采用 Kaplan-Meier 法,并采用Log-Rank检验。验证CDH1在人胃癌组织及其癌旁组织中的表达情况,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1Hp感染蒙古沙鼠胃组织CDH1的表达Hp灌胃蒙古沙鼠,分别选取Hp感染后3、12、24个月3个时间点,每个时间点各选取3只,取胃组织4%甲醛固定,石蜡包埋并制成切片。胃组织临床病理表型Hp感染后3个月为固有层及黏膜下层血管扩张,黏膜局部浅表糜烂;Hp感染后12个月为固有层内散在淋巴浆细胞浸润且黏膜糜烂;Hp感染后24个月固有层内散在淋巴浆细胞浸润,部分区域轻度非典型增生且黏膜糜烂。免疫组化检测Hp对CDH1表达的影响,Hp感染3、12、24个月胃组织CDH1阳性率分别为13.70%、13.20%、22.90%,对照组阳性率分别为0.04%、4.50%、4.77%,差异有统计学意义(χ2=6.039,P<0.05),表明Hp感染可引起CDH1表达增高,且可能与胃部病理表型变化有关。见图1。
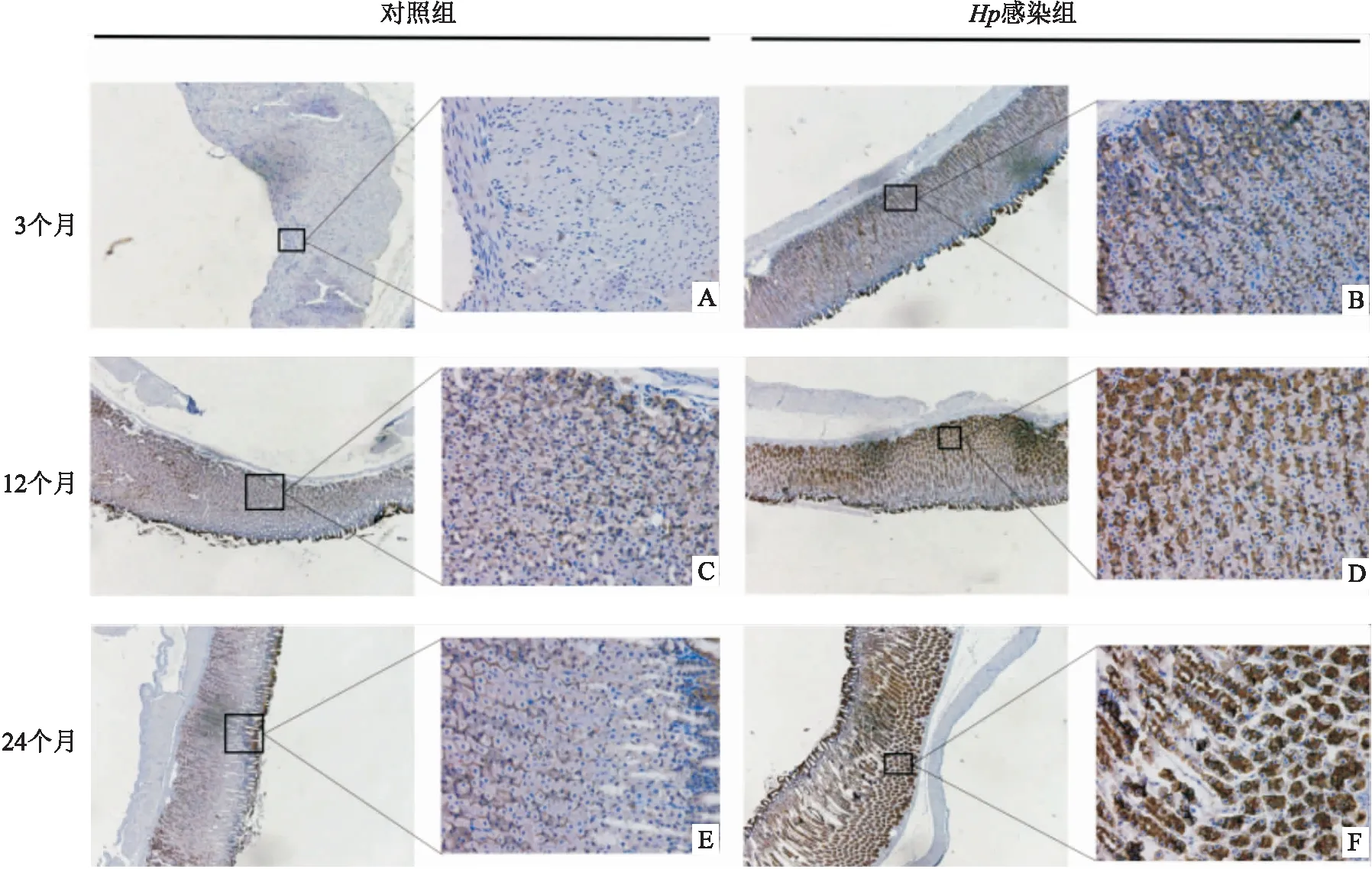
图1 Hp感染蒙古沙鼠胃组织CDHI表达
2.2Hp感染胃上皮细胞AGS CDH1的表达以MOI为40 ∶1感染胃上皮细胞细胞AGS,24 h后提取蛋白,进行SDS-PAGE电泳,Western blot检测目的蛋白CDH1的变化。结果显示,与未感染对照组比较,Hp感染组CDH1蛋白表达增高,差异有统计学意义(P<0.05)。见图2。
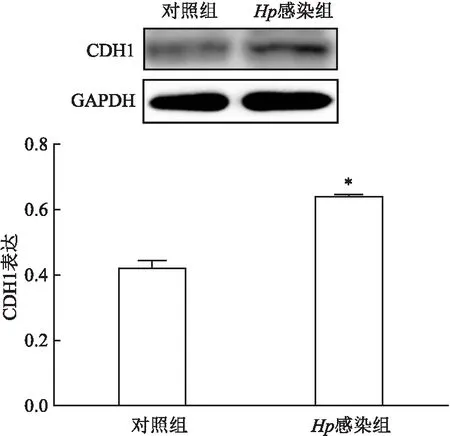
图2 Hp感染胃上皮细胞AGS CDH1的表达
2.3 TCGA数据库分析CDH1在胃癌和癌旁组织中的差异表达TCGA胃癌数据库中共收集449例具有临床病理参数的病例及其对应的CDH1 mRNA表达量。生物信息学分析得出,胃癌组标本CDH1基因表达量为(147.59±0.11),癌旁组织组的表达量为(76.36±0.48),胃癌组织组表达量高于癌旁组织组,差异有统计学意义(P<0.05),见图3。
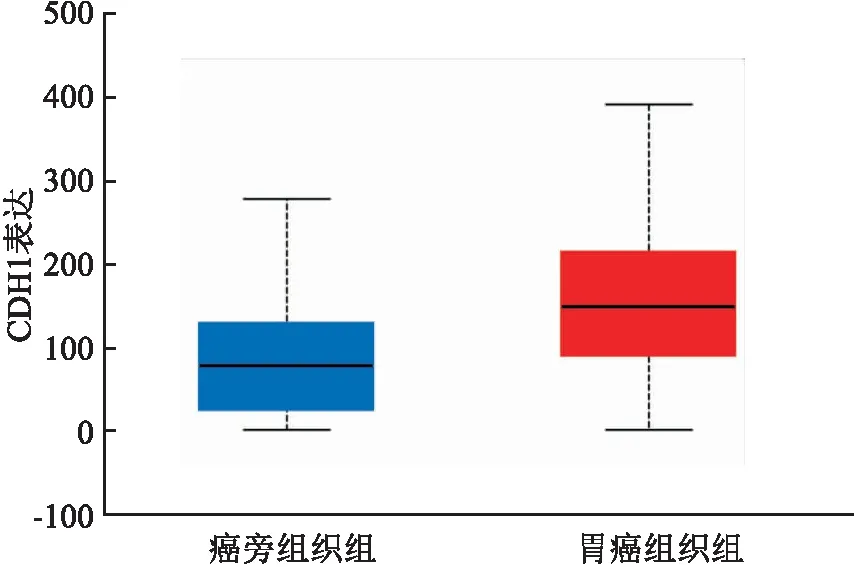
图3 胃癌组织与癌旁组织CDH1基因表达
2.4 Kaplan-Meier Plotter数据库分析CDH1表达与生存的相关性通过Kaplan-Meier Plotter数据库进行生存分析,随着在50、100、150个月的时间变化,CDH1高表达相比低表达胃癌患者生存率降低,表现为CDH1高表达胃癌患者低生存,差异有统计学意义[P<0.05,HR(95%CI)=1.49(1.25~1.77)]。见图4。
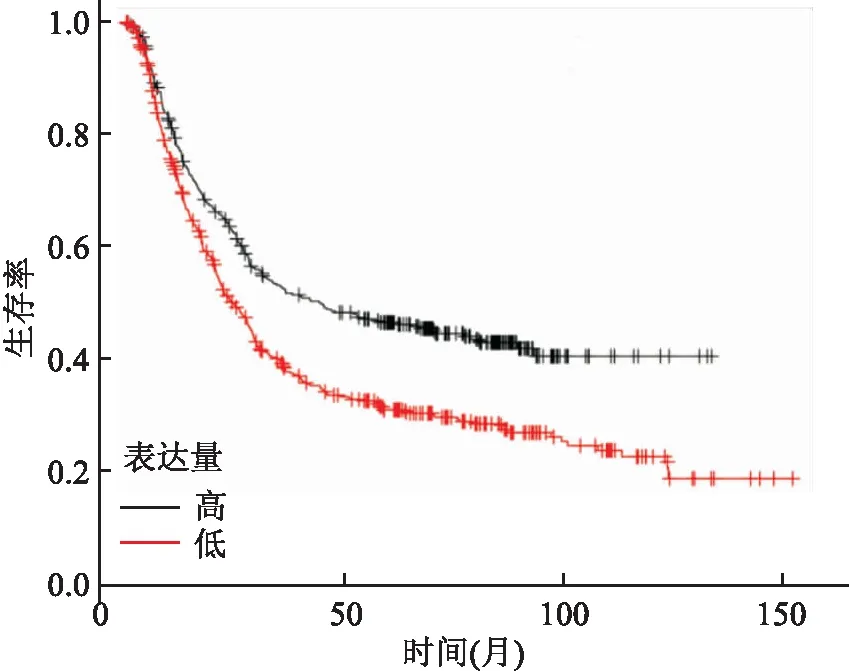
图4 CDH1基因高、低表达水平的胃癌患者生存率
2.5 CDH1基因KEGG富集分析通过R语言对CDH1进行KEGG富集分析,结果CDH1表达与胃癌、甲状腺癌、膀胱癌、子宫内膜癌、黑素瘤等肿瘤相关,功能显著富集到细菌侵袭上皮细胞、黏附连接、细胞黏附分子,通路显著富集到Apelin信号通路、Hippo信号通路和Rap1信号通路等。见图5。
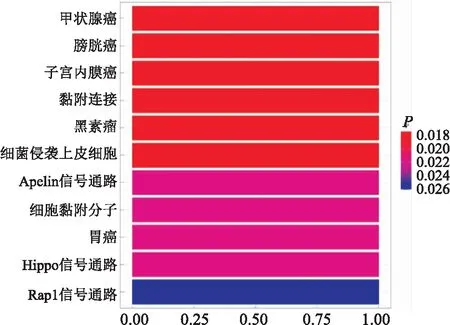
图5 CDH1基因的KEGG富集分析
2.6 CDH1蛋白在人胃癌组织和癌旁组织中的表达人胃癌组织和癌旁组织标本各10例,免疫组化染色检测CDH1的表达。结果显示,CDH1阳性率在人胃癌组织为76.27%,高于癌旁组织45.68%,差异有统计学意义(χ2=6.909,P<0.01)。见图6。
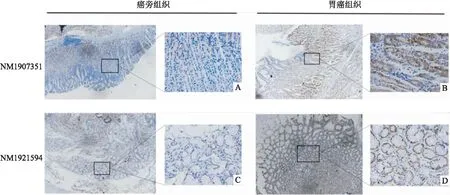
图6 CDH1在人胃癌组织中的表达
3 讨论
胃癌是常见的消化系统恶性肿瘤之一,大部分胃癌患者为散发病例,约10%的胃癌患者存在家族聚集现象,可能与遗传、饮食、环境等因素有关。其中,与遗传因素相关的胃癌即弥漫性胃癌[9]。弥漫性胃癌以早发性弥漫型胃癌为特征,病理类型多为印戒细胞癌,诊治困难且预后差[10]。在胃癌的发生中,Hp诱导的慢性炎症被认为是重要的诱因之一,这也意味着环境因素可诱导细胞发生癌变,这与遗传因素诱导的可能不同[9]。目前Hp诱导胃黏膜炎症机制尚未完全明了,可能机制包括Hp定植引起的炎症、Hp毒素引起的炎症等,但其致癌机制尚不清楚[4]。研究[11]发现,弥漫性胃癌家族病例的基因分析提示,CDH1在多位点均易发生高频突变,是弥漫性胃癌的危险因素和标志之一。而Hp感染与CDH1表达及胃癌之间的关系鲜有研究。本研究通过免疫组化检测发现,Hp灌胃组与对照组比较,3、12、24个月3个时间点蒙古沙鼠胃组织CDH1表达量升高;Hp感染胃上皮细胞后,通过Western blot检测发现,与对照组比较,Hp感染组CDH1蛋白表达量上升,以上结果表明Hp可上调CDH1表达。有研究[12]发现,CDH1与多种上皮来源的恶性肿瘤的发生、发展、侵袭转移密切相关,且在多种上皮性肿瘤组织中均发现其异常表达。多数肿瘤都存在至少一个癌变驱动基因 ,CDH1种系突变便是弥漫性胃癌形成的重要驱动基因[13]。因此,本研究通过TCGA数据库和Kaplan-Meier Plotter数据库分析分析发现胃癌组织组相比癌旁组织组CDH1表达水平高,CDH1的高表达对胃癌患者低生存呈正相关;通过KEGG富集分析发现,CDH1表达与胃癌、细菌侵袭上皮细胞等相关;免疫组化实验发现,人胃癌组织相比癌旁正常组织CDH1表达水平高,表明CDH1与胃癌发生可能呈正相关,提示CDH1在Hp相关性胃癌中有着重要作用。
综上所述,CDH1表达量在蒙古沙鼠Hp灌胃组明显高于对照组,在Hp感染AGS细胞组高于对照组;生物信息学分析CDH1基因在胃癌组织中高表达,CDH1基因高表达与胃癌不良预后呈正相关,KEGG富集得出CDH1与胃癌和细菌侵袭上皮细胞等相关;临床人胃癌组织CDH1表达量高于癌旁正常组织,表明Hp感染引起的CDH1高表达可能在Hp相关性胃癌发生中具有重要的作用,结果为进一步探索Hp引起胃癌发生的机制和靶向治疗提供理论支持。
