FASTKD4在骨肉瘤组织中表达及对骨肉瘤细胞增殖和凋亡的影响
2022-03-31张香路马广文
张香路,王 震,常 俊,马广文,黄 斐
骨肉瘤是恶性程度最高的肿瘤之一,好发于儿童和青少年,目前以手术治疗和化学治疗为主,复发率较高,预后往往不佳[1-3]。过去三十年来,骨肉瘤患者的预后并未改变,凸显了临床对新研究、新方法的需求[4]。肿瘤的发生、发展涉及多个基因、多个环节的调控异常,寻找有效的靶基因治疗骨肉瘤可能会有效的改善其预后[5-6]。
Fas活化激酶结构域蛋白4 (fast kinase domain-containing protein4,FASTKD4)也被称为细胞周期进程修复蛋白2(cell cycle progression restoration protein 2,CPR2)和转化生长因子β调节蛋白4(transforming growth factor beta regulator 4 ,TBRG4),是一种线粒体蛋白,广泛分布在整个线粒体基质中,能够调节线粒体中RNA的表达[7]。FASTKD4在之前的研究报道中较少,2014年Wolf et al[8]首次通过MitoString测试发现FASKTD4是一种新的线粒体蛋白。随后2017年Boehm et al[7]证实FASKTD4对线粒体能量代谢有着重要的调节作用,这也是首次证实FASTKD4可以通过影响线粒体,从而进一步干预肿瘤的发生发展。但是FASTKD4对骨肉瘤是否有影响,目前尚无研究。为了明确FASTKD4在骨肉瘤中的作用,该研究拟检测FASTKD4在骨肉瘤组织和骨肉瘤细胞中的表达,并通过小干扰RNA沉默骨肉瘤细胞中的FASTKD4,观察其对骨肉瘤细胞生物学的影响。
1 材料与方法
1.1 标本的采集收集2017—2019年安徽医科大学第四附属医院30例骨肉瘤患者的股骨远端骨肉瘤标本。通过免疫组化和qPCR检测骨肉瘤组织和癌旁组织中FASTKD4的表达。
1.2 细胞系骨肿瘤细胞系Saos-2、HOS和成骨细胞株均购自中国科学院上海细胞库。使用含10%胎牛血清、100 U/ml 青-链霉素的RPMI-1640培养基,并在37 ℃、5% CO2的环境中进行细胞培养。
1.3 免疫组化将骨肉瘤组织和癌旁组织切片进行福尔马林固定和石蜡包埋后,切片(5 μm)进行免疫组化。用抗FASTKD4的一抗(兔抗,浓度1 ∶1 000,CST)4 ℃孵育过夜,重复洗涤后再用二抗孵育30 min。最后切片用DAPI染色,并用苏木精复染。
1.4 shFASTKD4慢病毒的构建与转染为了有效阻止FASTKD4的表达,本研究构建了靶向干扰FASTKD4的小干扰RNA small interfering RNA (shRNA) 慢病毒载体。方法如下:靶向干扰FASTKD4的shRNA的干扰序列为GTTCTTCAGCCTGGTACAT。被用于对照组的,加扰(scrambled) shRNA(shCtrl)的干扰序列为TTCTCCGAACGTGTCACGT。相关茎环结构的DNA oligo (oligonucleotides ) 被合成,并被植入pGV115-GFP慢病毒载体(上海吉凯基因医学科技股份有限公司)。通过这个慢病毒表达系统来构建shFASTKD4和scrambled shRNA。为了进行慢病毒转染,用6孔板培养Saos-2细胞,并根据MOI加入shFASTKD4和shCtrl慢病毒。转染后 72 h左右,荧光显微镜观察绿色荧光蛋白(green fluorescent protein,GFP)的表达情况。转染120 h后,收集细胞进行qPCR和Western blot检测敲减效率。
1.4.1RNA提取和qPCR检测 按照说明书的方法,使用Trizol 裂解肿瘤组织、癌旁组织和肿瘤细胞并收集RNA。每个样本取2.0 μg RNA在M-MLV逆转录酶和oligo dT作用下合成cDNA。使用SYBR Green Premix Ex Taq试剂进行qPCP实验,并在ABI 7500 QPCR仪进行检测。使用GAPDH做为内参。FASTKD4的正向引物为5′- CAGCTCACCTGGTAAAGCGAT-3′,反向引物为5′-GGGAGTAGATGCTCGTTCCTTC-3′ (194 bp);GAPDH的正向引物为 5′-TGACTTCAACAGCGACACCCA-3′,反向引物为5′-CACCCTGTTGCTGTAGCCAAA-3′(121 bp), 参考GAPDH的表达结果标准化FASTKD4的表达结果。用 DNA 相对拷贝数和相对表达量(2-ΔΔCt) 表示FASTKD4基因的相对表达量。
1.4.2Western blot检测 为了检测Saos-2细胞中FASTKD4的敲减效率,采用Western blot的方法检测细胞中FASTKD4蛋白的表达水平。Saos-2细胞被转染shFASTKD4和shCtrl慢病毒后培养72 h,然后用PBS洗涤,并用预冷的lysis buffer进行裂解。细胞裂解液在4 ℃,12 000 r/min离心15 min,收集上清液,并用BCA试剂盒检测蛋白水平。40 mg的蛋白被8%~12%的SDS-PAGE溶解后转移到 PVDF 膜上,然后用TBTS配制的5%的脱脂牛奶封闭PDVF膜1 h,一抗4 ℃孵育过夜,TBTS液洗涤3次后,二抗孵育室温孵育1 h,使用ECL法显影。
1.4.3细胞增殖实验 通过高内涵筛选的方法检测shFASTKD4和shCtrl慢病毒转染的Saos-2细胞的增殖。将处于对数生长期并转染shFASTKD4和shCtrl慢病毒的Saos-2细胞按2×103个/孔种植到96孔板中。在37 ℃、5% CO2环境中培养4 d,且每天用高内涵细胞分析仪CellomicsArrayScan VTI (Thermo) 检测读板一次并定量细胞数量,连续检测读板4 d,实验重复3次。
除了高内涵筛选的方法,本研究还采用CCK-8试剂盒来检测shFASTKD4和shCtrl慢病毒转染的Saos-2细胞的增殖。按2×103个/孔将细胞种植到96孔板中,连续培养4 d。每天在每孔加入10 μl CCK-8溶液37 ℃孵育4 h,酶标仪ELx800 Absorbance Microplate Reader (BioTek Instruments,Winooski,VT,USA) 选择490 nm检测OD值,连续检测4 d。所有实验重复3次。
1.4.4细胞克隆形成实验 将处于对数生长期的shFASTKD4和shCtrl慢病毒转染的Saos-2细胞与基质胶混匀后,1×103个/孔将细胞种植到24孔板中,使用含有20 ng/ml EGF、10 ng/ml b-FGF、5 μg/ml胰岛素和0.4% 胎牛血清的DMEM/F12培养液培养12 d,并在1、6、12 d时进行荧光拍照,每组实验重复3次。并用荧光图像分析软件(PhenoRipper)测量克隆球直径。
1.4.5细胞凋亡检测 采用Annexin V-APC 凋亡试剂盒检测细胞凋亡。将shFASTKD4和shCtrl慢病毒转染的Saos-2细胞培养48 h后,收集细胞,并用PBS洗涤,用细胞染色液调整细胞浓度为1×106/ml,每100 μl细胞悬液加入 10 μl Annexin V-APC 染色,室温避光 15 min。使用FACS Calibur 流式细胞仪检测细胞凋亡,每组实验重复3次。
2 结果
2.1 FASTKD4在骨肉瘤组织和骨肉瘤细胞系中的表达分析采用免疫组化和qPCR的方法检测FASTKD4在骨肿瘤组织中的表达情况,结果见图1A、B,FASTKD4在骨肉瘤组织中呈高表达,而在癌旁组织中呈低表达,qPCR的结果也表明FASTKD4 mRNA在骨肉瘤组织中表达水平要高于癌旁组织,两组之间差异有统计学意义(图1C,t=10.86,P<0.05)。同时FASTKD4 mRNA在骨肉瘤细胞系Saos-2中表达最高,与HOS及成骨细胞比较差异有统计学意义(图1D,t=19.72,P<0.05)。因此选择Saos-2骨肉瘤细胞系进行后续实验。
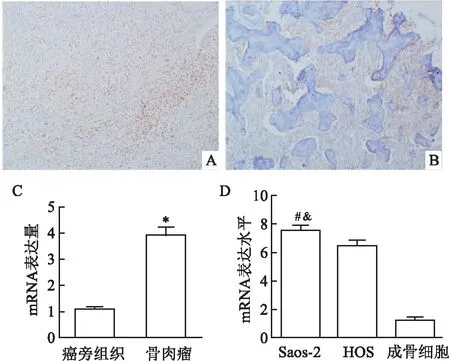
图1 FASTKD4在骨肉瘤及癌旁组织中的表达
2.2 慢病毒介导的shRNA转染骨肿瘤细胞抑制FASTKD4的表达为了评估慢病毒的敲减效率,Saos-2细胞被分别转染shFASTKD4和shCtrl慢病毒载体。如图2A~D所示,转染72 h后,shFASTKD4和shCtrl组中超过80%的细胞GFP表达阳性。随后,本研究用qPCR和Western blot的方法验证FASTKD4的表达情况。如图2E所示,与shCtrl组比较,shFASTKD4组中FASTKD4 mRNA的表达下降61%,两组之间差异有统计学意义(t=12.45,P<0.05)。Western blot结果(图2F)与qPCR一致,同样显示shFASTKD4组FASTKD4的蛋白表达水平低于shCtrl组。因此慢病毒介导的shRNA转染有效的抑制了FASTKD4 mRNA和蛋白的表达。

图2 FASTKD4转染效率及转染后细胞中表达水平
2.3 FASTKD4敲除抑制骨肉瘤细胞增殖增殖是肿瘤细胞的一个重要特性,本研究通过高内涵筛选和CCK-8实验分析了FASTKD4敲除后对骨肉瘤细胞增殖的影响。在高内涵检测实验中,转染shFASTKD4和shCtrl的Saos-2细胞,被培养在96孔板中,并且通过CellomicsArrayScan VTI 连续观察细胞4 d生长情况(图3A)。如图3B所示,与shCtrl组比较,shFASTKD4组中细胞增殖能力受到抑制。培养到第4天时,shCtrl组细胞增殖3.05倍,而shFASTKD4组中细胞增殖1.73倍,两者之间差异有统计学意义(t=4.68,P<0.05)。课题组同时还用CCK-8实验检测了FASTKD4敲除对骨肉瘤细胞增殖能力的影响。如图3C所示,CCK8结果同样显示了shFASTKD4组中细胞增殖能力低于shCtrl组,两组之间差异有统计学意义(t=4.72,P<0.05)。

图3 FASTKD4沉默后骨肉瘤细胞增殖能力检测
2.4 FASTKD4敲除抑制骨肉瘤细胞克隆能力本研究通过基质胶成球实验测定模拟体内三维情况下肿瘤细胞的克隆和成瘤能力。肿瘤细胞被接种在24孔板中,并在1、6、12 d时进行荧光拍照(图4A)。如图4B所示,在培养12 d shFASTKD4组中肿瘤细胞形成的克隆球直径小于shCtrl组,两组之间差异有统计学意义(t=14.87,P<0.05),表明FASTKD4敲除后抑制了肿瘤细胞的克隆形成能力。

图4 FASTKD4沉默后骨肉瘤细胞克隆形成能力检测
2.5 FASTKD4敲除诱导骨肿瘤细胞凋亡为了分析FASTKD4敲除对骨肿瘤细胞凋亡的影响,本实验采用Annexin V-APC 单染法流式细胞仪检测细胞凋亡(图5A)。检测结果显示shCtrl组和shFASTKD4组细胞凋亡百分比分别为(2.36±0.11)%和(8.41±1.31)%(图5B),两组之间差异有统计学意义(t=7.97,P<0.05)。这表明FASTKD4敲除可以诱导骨肿瘤细胞的凋亡。

图5 FASTKD4沉默后骨肉瘤细胞凋亡检测
2.6 FASTKD4的敲除使骨肉瘤细胞中PI3K/AKT信号通路失活为了进一步探讨FASTKD4在骨肉瘤中发生的分子机制,本课题组研究了PI3K/AKT信号通路,这是骨肉瘤中最常见的异常信号通路之一。通过Western blot检测FASTKD4敲低对Saos-2细胞中p-PI3K、PI3K、p-AKT和AKT表达的影响。如图6A、B所示,与shCtrl组比较,敲除FASTKD4下调了shFASTKD4组中p-PI3K和p-AKT蛋白的表达,两组之间差异有统计学意义(t=26.42、24.98,均P<0.05),但在总的PI3K和AKT水平上未观察到明显差异。这些数据进一步说明,敲除FASTKD4使PI3K/AKT信号通路失活。

图6 Western blot检测Saos-2细胞中FASTKD4沉默对PI3K/AKT信号通路的影响
3 讨论
随着分子靶向治疗技术的发展以及对骨肉瘤发生、发展机制研究的深入,目前骨肉瘤的分子靶向治疗是临床研究的一个热点[9]。
肿瘤的发生、发展与肿瘤细胞的快速增殖和凋亡有关。作为与代谢和凋亡两大癌症标志相关的细胞器,线粒体正受到越来越多的关注。研究[7]表明肿瘤中抑癌基因的突变和癌基因的表达是通过作用线粒体来执行逃避凋亡和改变细胞代谢,进而促进癌细胞的生长。FASTKD4是线粒体基因中的一种,被认为是细胞周期相关基因,受到IL-2和JAK3的负调控。虽然FASKTD4与骨肉瘤之间的直接关系,目前尚无报道,但FASKTD4也已经被证实与多种肿瘤的发生有关,有研究[10]表明FASKTD4在肺癌组织中高表达,敲除FASKTD4后可以下调CAV1和RRM2,上调DDIT3来抑制肺癌细胞的增殖并促进凋亡。还有研究[11]发现FASKTD4在鳞状细胞癌中发挥着重要作用,下调FASKTD4后,可以下调CAV-1并引起氧自由基的蓄积,同时抑制线粒体介导的凋亡反应。这也证实FASKTD4可以通过影响线粒体,在肿瘤的发生发展中发挥作用。因此本课题组推测FASTKD4可能也参与骨肉瘤的发生、发展。
本研究的结果表明在FASTKD4在骨肿瘤组织中表达显著高于癌旁组织。在细胞实验中,选择了FASTKD4在骨肿瘤细胞中表达最高的Saos-2作为研究对象,通过细胞转染小干扰RNA沉默FASTKD4的表达,qPCR和Western blot的结果证实了小干扰RNA沉默FASTKD4的有效性。FASTKD4沉默后的Saos-2细胞增殖的数量和克隆球直径均小于对照组,而凋亡细胞的百分比高于对照组。这些结果表明FASTKD4沉默可以有效的抑制Saos-2细胞的增殖和克隆能力的形成,并促进Saos-2细胞的凋亡。本研究认为FASTKD4促进Saos-2细胞凋亡可能是导致细胞增殖受限的一个重要原因,这也与之前FASTKD4在其他肿瘤研究中的报道一致。
本研究评估了敲除FASTKD4对骨肉瘤细胞中PI3K/AKT信号通路的影响。结果显示,敲除FASTKD4可抑制p-PI3K和p-AKT的表达水平,但在总的PI3K和AKT水平上未观察到明显差异,因此本研究推测FASTKD4基因表达下调是通过PI3K-AKT信号通路抑制骨肉瘤细胞的增殖、转移和诱导细胞凋亡,进而抑制FASTKD4表达,这可能成为改善骨肉瘤预后的一个可行方法。然而,FASTKD4在骨肉瘤进展中的潜在抑瘤机制涉及多个分子水平,需要进一步研究。下一步本课题组将进一步研究FASTKD4在骨肉瘤其他细胞中作用的分子机制,为临床治疗提供坚实的理论基础。
