生物保鲜剂真空浸渍对冰温贮藏罗非鱼蛋白特性的影响
2022-03-31张乾熙阮健文关志强
刘 岩,李 敏,金 枝,罗 静,张 莹,张乾熙,阮健文,叶 彪,关志强
生物保鲜剂真空浸渍对冰温贮藏罗非鱼蛋白特性的影响
刘 岩1,李 敏1,金 枝2,罗 静2,张 莹2,张乾熙1,阮健文1,叶 彪1,关志强1
(1.广东海洋大学机械与动力工程学院; 2.广东海洋大学食品科技学院 / 广东省水产品加工与安全重点实验室 / 水产品深加工广东普通高等学校重点实验室,广东 湛江 524088)
【目的】通过肌原纤维蛋白生化特性的变化,考察生物保鲜剂结合真空浸渍处理在罗非鱼冰温贮藏中的应用效果。【方法】分别将罗非鱼片进行蒸馏水常压浸渍(对照组)、生物保鲜剂常压浸渍、生物保鲜剂真空浸渍处理,后测定冰温保藏过程中肌原纤维蛋白的盐溶性、Ca2+-ATPase酶活性、总巯基含量、表面疏水性和羰基含量。【结果】与对照组对比,生物保鲜剂处理常压浸渍和真空浸渍组冰温贮藏5 d后的表面疏水性、Ca2+-ATPase酶活性,10 d后的肌动球蛋白的盐溶性、总巯基含量和羰基含量与对照组出现显著差异(<0.05),而VI浸渍和常压浸渍组之间此时的相应指标对比并无显著差异(>0.05);真空浸渍组在10 d表面疏水性、Ca2+-ATPase酶活性、总巯基含量,15 d的肌动球蛋白的盐溶性、20 d羰基含量与常压浸渍组出现显著差异(<0.05)。在贮藏期间,对照组的各肌原纤维蛋白(MP)相关指标变化显著,VI组各指标在30 d的贮藏时间内变化最平缓。真空浸渍结合生物保鲜剂处理能使冰温罗非鱼的贮藏期延长到30 d。【结论】生物保鲜剂结合真空浸渍预处理工艺能进一步保护肌原纤维蛋白构象的完整性,延缓蛋白质氧化进程,改善罗非鱼片在冰温货架期的品质。
真空浸渍;生物保鲜剂;冰温;罗非鱼;肌原纤维蛋白
罗非鱼()蛋白质含量高,在贮藏与运输过程中易受自身内源酶和微生物生长繁殖及氧化作用等影响,导致肌原纤维蛋白(MP)的盐溶性、Ca2+-ATPase酶活性、总巯基含量、羰基含量以及表面疏水性等生化特性发生变化,进而影响鱼肉的品质和加工性能。
水产品加工预处理时添加保鲜剂并结合低温贮藏是常用的保鲜方式[1,2]。生物保鲜剂因其安全、无毒、可食用的特点被广泛关注,国内外学者也针对生物保鲜剂和冰温贮藏技术对蛋白质功能特性的保护作用进行了探讨[3-5]。但是上述研究在水产品蛋白质特性变化方面并不完整,目前尚未见有系统研究蛋白质特性的报道。
真空浸渍技术(Vacuum Impregnation,VI)能够影响食品的多孔结构,加速食品基质和浸渍溶液之间的双向传质,从而提高食品浸渍效果和加工效率[6],目前普遍应用于肉类腌制[7-9]和果蔬加工贮藏[10-14]。近年来仅有极少量将VI应用于水产品贮藏的研究,其中Zhao等[6]研究发现,鱼胶和葡萄籽提取物联合VI有效改善鱼片的新鲜度和安全性。ShiekhKhursheed等[15]采用云树叶提取物,结合脉冲电场和VI,有效延长凡纳滨对虾()的货架期。目前生物保鲜剂结合真空浸渍处理方面的研究主要集中在产品的新鲜度,对蛋白质的功能特性综合研究尚未见报道。
本课题组前期对冰温罗非鱼生物保鲜剂进行研究[16],获得复合生鲜剂的最佳配比为:海藻酸钠质量浓度为8 g/L,Nisin质量浓度为0.8 g/L,异抗坏血酸钠质量浓度7.5 g/L,经该生物保鲜剂处理后的罗非鱼可将其冰温(-2℃)货架期由15 d延长至22 d。结合前期研究,本研究拟通过VI辅助生物保鲜剂预处理对生态冰温贮藏期间罗非鱼MP生化特性变化影响的探讨,了解真空浸渍水产品冰温货架期的优势,以期为该技术的推广应用提供可靠的理论依据。
1 材料与方法
1.1 主要材料
材料:罗非鱼,购于广东省湛江市湖光市场。
试剂:海藻酸钠,源叶生物有限公司;Nisin,万利达生物科技有限公司;异抗坏血酸钠(异VC钠),广州利源食品添加剂有限公司;Ca2+-ATPpase活性测试盒、蛋白质定量测试盒(考马斯亮蓝法)、总巯基测定试剂盒、羰基含量测试盒,南京建成生物工程研究所;溴酚蓝,天津市化学试剂研究所。
1.2 主要仪器与设备
真空包装机 DZ400/2D(瑞利包装机械有限公司);紫外分光光度计UV-8000A(上海元析仪器有限公司);真空预冷实验机VCD-02(上海鲜绿真空保鲜设备有限公司)。
1.3 实验设计与方法
1.3.1 样品处理 将活鱼宰杀,除去头、尾、表皮及内脏,修整成规格为12 cm×5 cm×1 cm、质量为(80±2)g的鱼片。将鱼片随机分成3组:A组鱼片使用无菌蒸馏水常压浸渍27 min(对照组);B组鱼片使用生物保鲜剂常压浸渍27 min(常压浸渍组);C组鱼片采用生物保鲜剂真空浸渍处理(真空浸渍组,VI组),真空压力为0.06 MPa,真空浸渍时间为15 min,常压恢复时间为12 min。3组鱼片浸渍处理结束后取出沥干,真空包装存放于-2 ℃环境中贮藏,每5 d对鱼片进行相关蛋白指标测定。
1.3.2 肌动球蛋白的提取 参照Zhou等[17]的方法测定。准确称取绞碎的2 g罗非鱼肉于烧杯中,随后加入20 mL已预冷的提取试剂KCl溶液(0.6 mol/L,pH 7.0),在冰浴条件下对鱼肉进行2 min均质分散,为防止过热,每均质10 s停10 s。均质结束后溶液进行冷却离心(4 ℃、10 000 r/min,30 min),离心完成后收集上清液。向上清液加入3倍体积已预冷的蒸馏水,并继续按该条件(4 ℃、10 000 r/min)离心20 min。离心结束后保留沉淀,然后向沉淀中加入已预冷20 mL KCl溶液(0.6 mol/L,pH 7.0),置于4 ℃环境中30 min。最后在4 ℃、10 000 r/min的条件下离心20 min,离心后收集的上清液即为肌动球蛋白溶液。
1.3.3 盐溶性的测定 参照南京建成蛋白定量测试盒(考马斯亮蓝法)说明书进行测定。
1.3.4 Ca2+-ATPase活性的测定 参照南京建成公司的ATP酶测试盒说明书进行测定。
1.3.5 总巯基含量的测定 参照南京建成公司蛋白质巯基含量测试盒指导方法进行。
1.3.6 羰基含量测定 参照南京建成公司蛋白质羰基含量测试盒指导方法进行。
1.3.7 表面疏水性的测定 参照Chelh等[18]的方法进行。使用20 mmol/L、pH 6.0的磷酸缓冲液将蛋白样液的质量浓度调整为5 mg/mL,取2 mL蛋白样液和40 μL 1 mg/mL溴酚蓝(BPB)试剂于离心管中,充分振荡混匀后室温静置10 min。然后在4 ℃、4 000 r/min条件下冷却离心15 min,取上清液并稀释10倍后595 nm处测定光密度值。把加入40 μL 1 mg/mL BPB试剂的2 mL磷酸盐缓冲液作为空白对照组,使用磷酸盐缓冲液进行调零。将结合态BPB(μg)作为表面疏水性指数,按照下列公式计算:
溴酚蓝结合量 = 200×(空白-样品)/空白,
式中,空白是磷酸盐缓冲液加入BPB试剂后在595 nm处的光密度值;样品表示蛋白样液加入BPB试剂后在595 nm处的光密度值。
1.4 数据处理
采用Excel 2007进行数据记录和整理,用SPSS18.0软件进行统计分析,设置显著水平为<0.05,使用Origin8.0作图。实验结果均为3次平行实验平均值。对照组在贮藏20 d、常压浸渍组在贮藏25 d后外观已经开始腐败,无参数测量的意义。
2 结果与分析
2.1 罗非鱼片贮藏期间蛋白盐溶性的变化
从图1可知,随着贮藏时间延长,三组鱼片的肌动球蛋白盐溶性蛋白含量逐渐下降,说明贮藏过程中肌动球蛋白的构象发生改变导致盐溶性受到影响[19]。VI组下降幅度最小,对照组在贮藏过程中差异显著(< 0.05)。贮藏5 d,三组的肌动球蛋白盐溶性间没有显著差异(> 0.05),但与0 d相比,对照组开始出现显著差异,而常压浸渍组和VI组变化不明显。贮藏10 d,对照组开始与常压浸渍组和VI组出现显著差异(< 0.05),此时与0 d和5 d相比常压浸渍组和VI组盐溶性显著降低,但组间没有差异。这表明生物保鲜剂可以起到抑制肌动球蛋白变性的作用。鱼肉在冰温贮藏过程中由于微生物大量繁殖使得内部微环境改变,导致不溶性大分子量蛋白质聚集体的形成,从而引起蛋白质溶解性降低[20]。且贮藏时间的累加会造成蛋白质的逐渐变性,分子间疏水性残基相互交联形成不溶性聚集体,蛋白质盐溶性也会下降[21]。VI组和常压浸渍组鱼片盐溶性下降幅度远低于对照组,可能是生物保鲜剂中的海藻酸钠、异VC钠有较好的抗氧化性,阻碍蛋白质氧化变性进程,减慢蛋白质盐溶性的下降速率,这一点与郭利芳等[5]和郭芳等[3]的研究结论一致。贮藏15 d,常压浸渍组的盐溶性开始显著低于VI组(<0.05)。随着时间的推移,贮藏20 d与0 d相比,VI组、常压浸渍组和对照组的下降幅度分别为41.49%、45.15%和68.8%,而且VI组在30 d的蛋白盐溶性含量仍在可接受范围内,说明VI处理效果优于常压浸渍处理。这可能是因为真空状态和恢复常压之间的压力差,改变了鱼肉肌间的间隙分布[7],促使保鲜剂更有效地渗透到鱼肉内部,增强其抑制蛋白变性的效果。

凡含一个相同字母表示差异不具统计学意义(P > 0.05);小写字母表示同样处理方式不同贮藏时间,大写字母表示相同贮藏时间不同处理
2.2 罗非鱼片贮藏期间Ca2+-ATPase活性的变化
如2所示,三组罗非鱼片在冰温贮藏过程中Ca2+-ATPase活性呈现下降趋势。因为鱼肉在低温贮藏过程中发生pH下降、微生物繁殖、脂肪氧化等变化会破坏蛋白质相对的稳定体系,从而引起肌球蛋白头部区域的构象发生改变,Ca2+不能将变性的肌球蛋白头部的ATP点位激活,导致Ca2+-ATPase活性下降[22]。但三组罗非鱼片在冰温贮藏过程中Ca2+-ATPase活性下降速度并不相同。相同贮藏时间点,常压浸渍组和VI组鱼片的Ca2+-ATPase活性下降速度均低于对照组,其中VI组下降速度最小。从10 d开始,对照组鱼片Ca2+-ATPase活性均显著低于同贮藏时间的常压浸渍组和VI组(<0.05),这与刘锋等[4]的研究结论一致,说明生物保鲜剂可以在一定程度上保护肌球蛋白的完整性,有效抑制Ca2+-ATPase的活性下降。
VI组在贮藏期间,Ca2+-ATPase活性下降平缓,10 ~ 20 d之间下降不显著(> 0.05)。20 d时与0 d相比,对照组、常压浸渍组和VI组活性分别下降了72.15%、51.19%和39.82%,VI组在30 d时与25 d相比Ca2+-ATPase活性变化不显著(>0.05),且比常压浸渍组25 d的含量还高。综合来看,VI组的保鲜效果最好。这是因为肌肉中的大部分水分是由毛细血管力控制的,而毛细血管力分布在MP内部各类蛋白丝排列中,VI作用使蛋白丝之间的间隙增大,有利于保鲜剂进入蛋白丝内部,而保鲜剂进一步改变了蛋白丝上的电荷数量,导致蛋白丝之间的空间发生排斥并进一步扩大[23],从而使更多的保鲜剂进入内部,使肌动球蛋白分子的球状头部结构的破坏程度小于常压浸渍组,因此VI处理的鱼片保鲜效果优于常压浸渍处理。

凡含一个相同字母表示差异不具统计学意义(P > 0.05);小写字母表示同样处理方式不同贮藏时间,大写字母表示相同贮藏时间不同处理
2.3 罗非鱼片贮藏期间总巯基含量的变化
三组鱼片冰温贮藏期间总巯基含量的变化见图3。随着贮藏的进行,各组鱼片的总巯基含量趋势线在10 d前均呈陡降形式,而在10 d后趋势线变得相对平缓,其中对照组下降程度最剧烈,在整个贮藏过程中均下降显著(<0.05);10 d时,对照组、常压浸渍组和VI组间含量差异显著(<0.05)。贮藏20 d,对照组、常压浸渍组和VI组总巯基质量摩尔浓度分别下降76.63%、58.85%,52.76%,此时对照组鱼片已开始出现腐败迹象,常压浸渍组和VI组状态尚可。在25 d,常压浸渍组与VI组出现显著差异(<0.05),25 d之后常压浸渍组开始出现腐败迹象,而VI组状态尚可。在整个过程中VI组总巯基下降更缓慢,尤其在15 d以后,趋势线比其他两组更平缓,说明VI处理增强了保鲜效果。
巯基基团对于维持MP空间结构稳定起着非常重要的作用[24],由于活性酶参与氧化、冰晶对蛋白质结构的破坏等原因[25]导致低温贮藏过程中处于鱼肉MP的活性巯基暴露出来,被自由基氧化形成二硫键—S—S—[26,27],肌球蛋白的球状头部上的巯基发生氧化使肌球蛋白聚集同时会引起Ca2+-ATPase活性下降[4],因此本研究中巯基的含量变化与Ca2+-ATPase活性下降情况总体保持一致。上述结果表明,生物保鲜剂的强抗氧化能力,能够抑制MP变性,减少二硫键—S—S—的交联和肌球蛋白的聚集,减缓鱼片巯基的氧化程度,减慢鱼片贮藏品质劣变进程。同时,施加真空使鱼片肌肉纤维膨胀,肌肉组织内部气体和部分液体被消除,使接触面积增大,恢复大气压时,溶液更容易进入孔隙,这就是VI作用带来的压力梯度变化和毛细管效应,即水动力机制[28],其增强了保鲜剂在鱼片组织结构中的渗透。VI组的总巯基含量在30 d时与25 d相比变化不显著,而且与25 d的真空浸渍组数值接近。
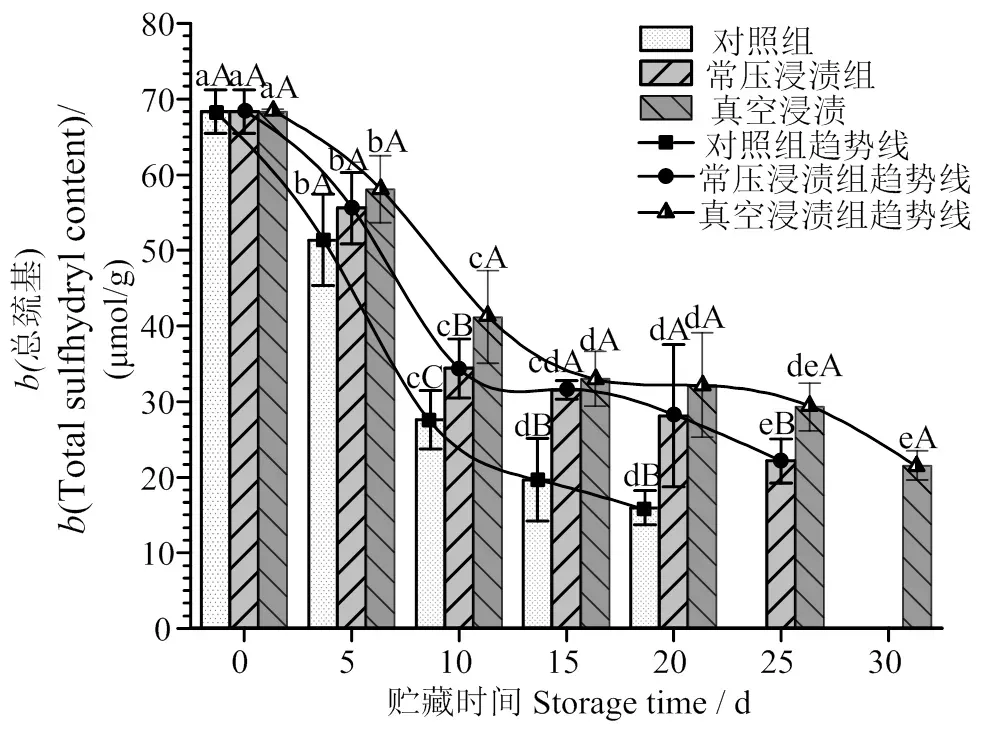
凡含一个相同字母表示差异不具统计学意义(P > 0.05);小写字母表示同样处理方式不同贮藏时间,大写字母表示相同贮藏时间不同处理
2.4 罗非鱼片贮藏期间表面疏水性的变化
图4通过溴酚蓝结合量反映表面疏水性的大小[26],可以看出在冰温贮藏过程中,三组鱼片的疏水性均呈上升趋势。对照组的趋势线上升最快,远高于其他两组,说明未经保鲜剂处理的样品表面疏水性变化很快。这可能是因为生物保鲜剂促进蛋白质与外部水分子之间的缔合作用,疏水性基团暴露得较少[29],溴酚蓝与疏水位点结合的可能性减小,因而保鲜剂处理的各组鱼片溴酚蓝结合量较低。
整个贮藏过程中,对照组的表面疏水性显著升高(< 0.05)。贮藏前10 d,常压浸渍组与VI组的溴酚蓝结合量上升趋势较为平缓,贮藏10 d之后溴酚蓝结合量加快,趋势线变陡。在贮藏末期,对照组、常压浸渍组和VI组溴酚蓝结合量与初始值相比分别增大了4.58倍、3.22倍和2.17倍,说明贮藏过程中鱼片的MP发生严重的变性而引起构象改变,内部巯基组分的外露导致二硫键—S—S—被进一步氧化,产生大量的非二硫键和二硫键交联,蛋白基团不断聚合,进一步加剧了疏水基团的增长[30],最终导致MP发生不可逆的变性[31]。
VI组的疏水性趋势线较为平缓,VI组30 d的疏水性与25 d相比差别不显著(>0.05),与常压浸渍组20 d的数值近似。这是因为VI预处理产生的水动力机制还伴随着变形弛豫现象,不仅影响系统的动力和平衡状态,而且影响食品组织的物理、机械和微观结构特性[28],进一步促进了生物保鲜剂在鱼片蛋白丝之间的传递,有效保护MP构象的完整性,抑制疏水基团的增长。
2.5 罗非鱼片贮藏期间羰基含量的变化
图5可知,在冰温贮藏过程中各组罗非鱼片羰基含量呈上升趋势,是因为MP分子中的氨基酸侧链被氧化、还原糖发生非酶糖化应、非蛋白糖基化合物结合和多肽链的氧化断裂[32-34]等多种因素导致羰基的不断产生。对照组羰基含量始终高于常压浸渍组和VI组,说明未经任何处理的鱼片MP氧化进程很快。其中常压浸渍组在5 d之后、VI组在15 d之后趋势线才变陡,VI组和常压浸渍组之间在20 d才开始出现显著差异(< 0.05)。这表明生物保鲜剂可显著延缓MP的氧化进程,生物保鲜剂中的活性成分具有很好的抗菌作用[16],能够抑制氨基酸侧链的氧化,一定程度上抑制肽链的氧化断裂。
VI组鱼片羰基含量增加缓慢,在30 d时,其羰基含量与25 d差异不大,均小于常压浸渍组20 d的含量。这是因为VI预处理可以使外部溶液通过的孔隙以快速、可控、均匀的方式直接进入食品组织内部,而不破坏原有的结构[23],一方面使保鲜剂在鱼片表面形成保护薄膜,另一方面能通过制造真空状态而改善肌肉内部孔隙结构、真空-恢复常压带来的压力变化而产生的震动进一步增强了的水动力渗透机制[7],使生物保鲜剂更好地渗透到鱼片内部,增强保鲜效果,因而VI处理组鱼肉氧化变性程度最低。
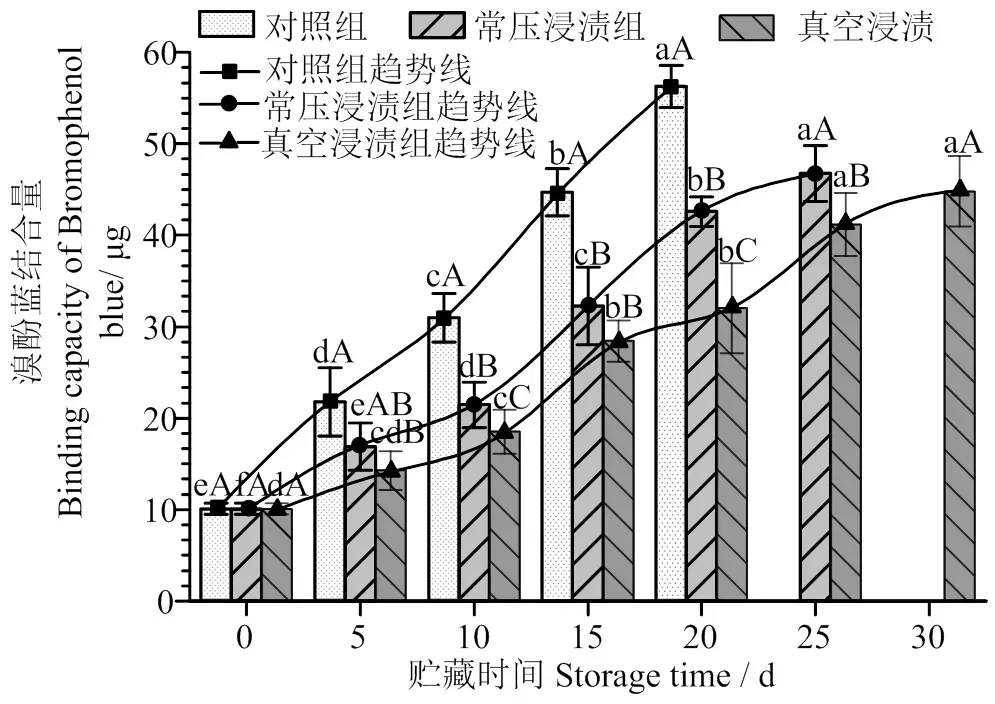
凡含一个相同字母表示差异不具统计学意义(P > 0.05);小写字母表示同样处理方式不同贮藏时间,大写字母表示相同贮藏时间不同处理

凡含一个相同字母表示差异不具统计学意义(P > 0.05);小写字母表示同样处理方式不同贮藏时间,大写字母表示相同贮藏时间不同处理
3 结论
1)冰温贮藏过程中,经生物保鲜剂处理的鱼片MP各生化指标变化幅度均低于对照组,其中及以后的蛋白盐溶性、总巯基含量和羰基含量在贮藏10 d开始、Ca2+-ATPase活性和表面疏水性在贮藏5 d开始与对照组有显著差异(<0.05),表明生物保鲜剂能有效保护罗非鱼片MP构象的完整性,延缓鱼肉腐败变质进程。
2)相比常压浸渍组,VI组的鱼片MP变性程度更低。VI组罗非鱼片冰温贮藏25 ~ 30 d时各MP指标差异不大(>0.05),其中羰基、总巯基含量低于常压浸渍组20 d时的含量,表面疏水性与常压浸渍组20 d数值接近,蛋白盐溶性和Ca2+-ATPase活性高于常压浸渍组25 d,使VI组保质期延长到30 d,比单独使用生物保鲜剂增加8 d,说明VI预处理能使生物保鲜剂有效地渗入到鱼片内部,使得生物保鲜剂抑制MP变性的作用增强,有效延长延长冰温罗非鱼贮藏期。
[1] 梁桉婕, 缪小兰, 段杉.冰温及4 ℃贮藏罗非鱼的腐败特征差异[J].广东海洋大学学报, 2021, 41(3): 99-104.
[2] 蓝蔚青, 赵家欣, 张溪, 等.微酸性电解水-复合保鲜剂对冷藏凡纳滨对虾品质及菌群结构影响[J].广东海洋大学学报, 2021, 41(6): 91-98.
[3] 郭芳, 周铭懿, 张抒爱, 等.冰温技术结合生物保鲜剂对中国对虾品质的影响[J].食品工业科技, 2020, 41(15): 274-280.
[4] 刘锋, 谢晶.柠檬马鞭草精油结合亚麻籽胶对大菱鲆肌原纤维蛋白生化特性及构象的影响[J].食品与发酵工业, 2020, 46(1): 104-111.
[5] 郭利芳, 吴肖淮, 颜燕, 等.黑麦多酚对泥鳅冰温贮藏过程中肌原纤维蛋白功能特性的影响[J].食品工业科技, 2021, 42(1): 312-316.
[6] ZHAO X, CHEN L, WONGMANEEPRATIP W, et al.Effect of vacuum impregnated fish gelatin and grape seed extract on moisture state, microbiota composition, and quality of chilled seabass fillets[J].Food Chemistry, 2021, 354: 129581.
[7] AYKıN-DINÇER E.Application of ultrasound-assisted vacuum impregnation for improving the diffusion of salt in beef cubes[J].Meat Science, 2021, 176: 108469.
[8] DEMIR H, ÇELIK S, SEZER Y Ç.Effect of ultrasonication and vacuum impregnation pretreatments on the quality of beef marinated in onion juice a natural meat tenderizer[J].Food Science and Technology International, 2021: 108201322110129.
[9] FIGUEROA C, RAMÍREZ C, NÚÑEZ H, et al.Application of vacuum impregnation and CO2-laser microperforations in the potential acceleration of the pork marinating process[J].Innovative Food Science & Emerging Technologies, 2020, 66: 102500.
[10] HINESTROZA-CÓRDOBA L I, BARRERA C, SEGUÍ L, et al.Potential use of vacuum impregnation and high-pressure homogenization to obtain functional products from lulo fruit (Lam.)[J].Foods, 2021, 10(4): 817.
[11] KRĘCISZ M, KOLNIAK-OSTEK J, STĘPIEŃ B, et al.Influence of drying methods and vacuum impregnation on selected quality factors of dried sweet potato[J].Agriculture, 2021, 11(9): 858.
[12] ZHANG L F, WANG P, CHEN F S, et al.Effects of calcium and pectin methylesterase on quality attributes and pectin morphology of jujube fruit under vacuum impregnation during storage[J].Food Chemistry, 2019, 289: 40-48.
[13] ZURA-BRAVO L, RODRÍGUEZ A, STUCKEN K, et al.Nutritional and organoleptic properties of murta (Turcz) berries impregnated withvar.and dehydrated by different methods[J].Food Chemistry, 2019, 299: 125117.
[14] LUO W, TAPPI S, PATRIGNANI F, et al.Essential rosemary oil enrichment of minimally processed potatoes by vacuum-impregnation[J].Journal of Food Science and Technology, 2019, 56(10): 4404-4416.
[15] SHIEKH K A, BENJAKUL S, QI H, et al.Combined hurdle effects of pulsed electric field and vacuum impregnation of Chamuang leaf extract on quality and shelf-life of Pacific white shrimp subjected to high voltage cold atmospheric plasma[J].Food Packaging and Shelf Life, 2021, 28: 100660.
[16] 金枝, 关志强, 李敏.复合保鲜剂对冰温罗非鱼片的保鲜效果[J].广东海洋大学学报, 2019, 39(6): 115-123.
[17] ZHOU A M, LIN L Y, LIANG Y, et al.Physicochemical properties of natural actomyosin from threadfin bream (spp.) induced by high hydrostatic pressure[J].Food Chemistry, 2014, 156: 402-407.
[18] CHELH I, GATELLIER P, SANTÉ-LHOUTELLIER V.Technical note: a simplified procedure for myofibril hydrophobicity determination[J].Meat Science, 2006, 74(4): 681-683.
[19] BENJAKUL S, SEYMOUR T A, MORRISSEY M T, et al.Physicochemical changes in Pacific whiting muscle proteins during iced storage[J].Journal of Food Science, 1997, 62(4): 729-733.
[20] HERRERA J R, MACKIE I M.Cryoprotection of frozen-stored actomyosin of farmed rainbow trout () by some sugars and polyols[J].Food Chemistry, 2004, 84(1): 91-97.
[21] 张红杰.臭氧减菌化处理罗非鱼片冰温贮藏过程中品质变化及蛋白质降解抑制研究[D].上海: 上海海洋大学, 2016.
[22] SULTANBAWA Y, LI-CHAN E C.Structural changes in natural actomyosin and surimi from Ling cod () during frozen storage in the absence or presence of cryoprotectants[J].Journal of Agricultural and Food Chemistry, 2001, 49(10): 4716-4725.
[23] LEAL-RAMOS M Y, ALARCÓN-ROJO A D, GUTIÉRREZ-MÉNDEZ N, et al.Improving cull cow meat quality using vacuum impregnation[J].Foods (Basel, Switzerland), 2018, 7(5): 74.
[24] THANONKAEW A, BENJAKUL S, VISESSANGUAN W, et al.The effect of antioxidants on the quality changes of cuttlefish () muscle during frozen storage[J].LWT - Food Science and Technology, 2008, 41(1): 161-169.
[25] TAO Y M, MA L, LI D D, et al.Changes in oxidation and secondary structure of myofibrilla protein, water distribution, and quality of vacuum packaged Tan mutton during storage at different temperatures[J].Journal of Food Processing and Preservation, 2021, 45(7):e15647.
[26] 李艳青, 孔保华, 杨赫鸿, 等.自由基氧化引起鲤鱼肌原纤维蛋白结构的变化[J].食品科学, 2012, 33(13): 70-74.
[27] BENJAKUL S, VISESSANGUAN W, THONGKAEW C, et al.Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage[J].Food Research International, 2003, 36(8): 787-795.
[28] GALVÃO MARTINS M, NUNES CHADA P S, DA SILVA PENA R.Application of pulsed-vacuum on the salt impregnation process of pirarucu fillet[J].Food Research International, 2019, 120: 407-414.
[29] MOURE A, SINEIRO J, DOMÍNGUEZ H, et al.Functionality of oilseed protein products: a review[J].Food Research International, 2006, 39(9): 945-963.
[30] JI H F, HOU X Z, ZHANG L W, et al.Effect of ice-temperature storage on some properties of salt-soluble proteins and gel from chicken breast muscles[J].CyTA - Journal of Food, 2021, 19(1): 521-531.
[31] KOBAYASHI Y, PARK J W.Biochemical and physical characterizations of fish protein isolate and surimi prepared from fresh and frozen whole fish[J].LWT, 2017, 77: 200-207.
[32] LI F F, DU X, REN Y M, et al.Impact of ice structuring protein on myofibrillar protein aggregation behaviour and structural property of quick-frozen patty during frozen storage[J].International Journal of Biological Macromolecules, 2021, 178: 136-142.
[33] 崔旭海, 孔保华.蛋白质氧化及其对乳蛋白结构与功能性的影响[J].中国乳品工业, 2008, 36(1): 44-47.
[34] 文镜, 张春华, 董雨, 等.蛋白质羰基含量与蛋白质氧化损伤[J].食品科学, 2003, 24(10): 153-157.
Effect of Vacuum Impregnation Assisted Biological Preservatives on the Protein Properties of Tilapia Fillets During Ice-Temperature Storage
LIU Yan1, LI Min1, JIN Zhi2, LUO Jing2, ZHANG Ying2,ZHANG Qian-xi1, RUAN Jian-wen1, YE Biao1, GUAN zhi-qiang1
(1.; 2.,,,,,524088,)
【Objective】To evaluate the biochemical characteristics of myofibrillar protein and ice-storage shelf life of tilapia fillets after treatment of a preservatives add a vacuum impregnation process.【Method】 Tilapia fillets were treated with compound preservatives combined with vacuum impregnation and compound preservatives at atmosphere pressure, and compared with the control group.The salt solubility of actin, Ca2+-ATPase enzyme activity, total sulfhydryl content, surface hydrophobicity and carbonyl content were determined.【Results】Compared with the control group, biological preservative treatment group in atmosphere pressure impregnation and vacuum impregnation at ice temperature storage, the surface hydrophobicity and Ca2+-ATPase enzyme activity after 5 d, the salt solubility of actomyosin, content of total sulfhydryl content and carbonyl group after 10 d, were significantly different from the control group (< 0.05).However, there was no significant difference (> 0.05) in the corresponding indicators at the above time between the vacuum impregnation and atmosphere impregnation groups.There was a significant differences(< 0.05) between the vacuum impregnation and atmosphere impregnation in the surface hydrophobicity, Ca2+-ATPase activity, and total sulfhydryl content of 10 d, the salt solubility of actomyosin of 15 d, the carbonyl content of 20 d.During the storage period, the MP-related indicators of the control group have been showing significant changes.However, the change curve of the VI impregnation group is steady.Vacuum impregnation combined with biological preservative treatment can prolong the storage period of ice-temperature tilapia for 30 days.【Conclusion】Biological preservation combined with the vacuum immersion pretreatment process can further protect the conformational integrity of myofibril protein, delay the protein oxidation process, improve the shelf-life and quality of tilapia fillets at ice temperature.
vacuum impregnate; biological preservatives; ice temperature; tilapia; myofibril protein
TS254.4
A
1673-9159(2022)02-0088-07
10.3969/j.issn.1673-9159.2022.02.011
2021-11-22
广东省自然科学基金(2015A030313613),湛江市科技计划项目(2019A01043)
刘岩(1979―),女,讲师,硕士,研究方向为食品冷冻冷藏工艺与制冷技术。E-mail:liuyanz@163.com
李敏((1967―),女,教授,硕士,研究方向为食品冷藏与制冷热泵应用技术。E-mail:E-mail:limin2080@163.com
刘岩,李敏,金枝,等.生物保鲜剂真空浸渍对冰温贮藏罗非鱼蛋白特性的影响[J].广东海洋大学学报,2022,42(2):88-94.
(责任编辑:刘朏)
