日本囊对虾核因子κB抑制蛋白激酶ε2基因克隆及表达
2022-03-31范嗣刚侯思禹邱丽华
范嗣刚,刘 勇,2,赵 超,侯思禹,邱丽华,2,
日本囊对虾核因子κB抑制蛋白激酶ε2基因克隆及表达
范嗣刚1,刘 勇1,2,赵 超1,侯思禹3,邱丽华1,2,3
(1.中国水产科学研究院南海水产研究所/广东省渔业生态环境重点实验室/农业农村部水产品加工重点实验室,广东 广州 510300;2.上海海洋大学水产与生命学院,上海 201306;3.天津农学院水产学院,天津 300384)
【目的】了解核因子κB抑制蛋白激酶ε2(IKKε2)基因在日本囊对虾()受细菌刺激后的应答情况,以阐释在对虾先天免疫中所起的作用。【方法】从日本囊对虾转录组数据中获得日本囊对虾(命名为)的cDNA序列,并进行生物信息学分析,采用荧光定量PCR分析的组织表达以及受哈维弧菌()刺激后在肝胰腺组织的表达情况。【结果】全长为4 009 bp,其中开放阅读框长2 337 bp,编码778个氨基酸,5′UTR(Untranslated region)174 bp,3′UTR 1 498 bp。PjIKKε蛋白含有一个激酶结构域、一个类泛素结构域和一个TANK结合激酶卷曲螺旋结构域。多重序列比对结果显示,PjIKKε2蛋白序列与其他甲壳类IKKε的相似性高,在激酶结构域保守性高。系统进化树结果显示,PjIKKε2与其他对虾属的IKKε聚集在一支。在日本囊对虾9个组织中均有表达,在淋巴组织中表达量最高(< 0.05)。在哈维弧菌刺激6 h后,在肝胰腺中表达量显著上调,达到最大值(< 0.05)。【结论】PjIKKε2参与了日本囊对虾的先天免疫。
日本囊对虾;核因子κB抑制蛋白激酶ε2;基因表达;先天免疫
先天免疫是机体抵御病原体侵犯的第一道防线[1],依赖于核因子κB(Nuclear factor Kappa-B,NF-κB)和干扰素调控因子(interferon regulatory factor,IRF))等转录因子的激活。核因子κB抑制蛋白激酶 [inhibitor of κB kinase (IKK)] 家族能激活NF-kB信号途径[2]。该途径与I型干扰素、炎症细胞因子和趋化因子共同作用,消除细菌和病毒的入侵[3-4]。因此,IKK/NF-κB是动物先天免疫系统中一条重要信号转导通路,已广受关注[2,5-6]。
在哺乳动物中,IKK家族成员分为经典的IKK(IKKα、IKKβ)和非经典的IKK(IKKε和TANK结合激酶)[7]。IKKε有IKKε1和IKKε2两种。IKKε主要在胰腺、胸腺和脾脏中表达,在T细胞中也有表达。然而,许多细胞在佛波酯、脂多糖、病毒RNA等微生物产物和TNF、IL-1、IL-6等细胞因子诱导下,IKKε表达量快速上调[9]。IKKε通过激活体内NF-κB、IRF3等转录因子,使IκB α、IFN-α和IFN-β蛋白磷酸化[10-11],调节免疫反应、炎症反应和细胞凋亡等生理活动。当病毒入侵时,IKKε能使IRF3和IRF7磷酸化,也能使IκBa、IKKb、NF-κB亚基p65等转录因子磷酸化,从而激活NF-κB[10-11]。
日本囊对虾()又称花虾、九节虾,属亚热带种类,主要分布在日本、朝鲜沿海,非洲东海岸,印度-西太平洋热带,中国东南沿海等地[12],是我国对虾养殖的主要物种之一,有生长快、适应性强、食性杂、耐低氧等特点[12]。目前,已有日本囊对虾先天免疫研究[13-14],IKKε在甲壳类亦有少量研究[5,15-16]。在斑节对虾()中,IKKε2和IKKε1均参与先天免疫过程,可能在细胞因子系统和信号传导交互作用中起正向作用[5]。Wang等[15]发现,凡纳滨对虾()IKKε通过激活NF-kB 信号途径激活AMP表达,抵御白斑综合征病毒(WSSV)感染[15]。Jiang等[16]获得拟穴青蟹()的、基因,发现在注射溶藻弧菌()或poly (I:C)后,表达量显著增多。而IKKε是否参与日本囊对虾的先天免疫,未见报道。本研究获得日本囊对虾基因序列,研究哈维弧菌刺激后在肝胰腺的表达情况,为探究该基因在日本囊对虾先天免疫中的作用提供理论依据。
1 材料和方法
1.1 材料
体质量(21.3 ± 2.0)g的日本囊对虾,购自湛江某对虾养殖场。剖取对虾肝胰腺、肌肉、淋巴鳃、神经节、胃、心、血淋巴、眼柄等组织,液氮冷冻后保存,用于克隆和组织表达分析。
随机选取400尾健康有活力体质量(30 ± 2)g的日本囊对虾,在盐度35、水温(25 ± 1)℃水池中暂养3 d,用于菌液注射实验。养殖期间,每天换水2/3,及时清除池内的残留物,投喂对虾饲料。
1.2 细菌刺激实验
实验分为实验组和对照组2组,每组3个平行组,即每组设3桶(水体为1 000 L),每桶50尾虾。实验组每桶中的每尾虾腹腔注射50 μL 1 × 106cfu•mL-1哈维弧菌悬液,对照组每尾虾腹腔注射50 μL磷酸盐缓冲液(PBS, 137 mmol/L NaCl, 2.7 mmol/L KCl, 8 mmol/L Na2HPO4, 2 mmol/L KH2PO4, pH 7.4)。在注射后0、6、12、24、48、72 h分别取虾5尾,剖取肝胰腺,液氮冷冻后移至– 80℃冰箱中保存。
1.3 RNA提取和cDNA合成
用Tirzol(Invitrogen,美国)提取上述样品的RNA。用琼脂糖凝胶电泳和Nanodrop 2000分别检测RNA完整性和浓度。
用M-MLV反转录试剂盒合成肌肉组织cDNA的第一条链。用PrimeScriptTM RT reagent Kit with gDNA Eraser(Takara,日本)试剂盒,以IKKε cDNA序列为模板,以Oligo-dT为引物进行反转录,得到IKKε的cDNA链,用于实时定量PCR实验。
1.4 日本囊对虾IKKε基因克隆和测序
从日本囊对虾转录组数据(SRX2030618)中获得基因cDNA序列。用Primer Premier 5设计引物-S1和-A1(表1)。PCR反应体系为20 µL,含13.8 µL ddH2O,2.0 µL 10×PCR Ex Buffer(Mg2+Plus),1.6 µL dNTP(各2.5 mmol/L),0.8 µL正/反向引物(10 mmol/L),0.8 µL cDNA模板,0.2 µL ExTaq(5 U/µL)(TaKaRa,日本)。反应程序:94℃,3 min;94℃ 30 s,50℃ 30 s,72℃ 50 s,35个循环;72℃ 7 min。用胶回收试剂盒[生工生物工程(上海)股份有限公司]回收PCR产物,在16 ℃条件下将纯化的PCR产物连接到pMDTM18-T(TaKaRa)载体中,转化到DH5α感受态(北京全式金生物技术有限公司)。通过菌液PCR筛选出阳性克隆,送至广州擎科生物公司(广州)测序。

表1 引物序列
1.5 序列和系统发育分析
用ORF Finder(https://www.ncbi.nlm.nih.gov/ orffinder/)查找开放阅读框和预测编码蛋白序列;用ProtParam(http://web.expasy.org/protparam/)预测编码蛋白理化特性;用Global Align软件分析蛋白相似性。用Conserved domains软件(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析蛋白结构;预测糖基化位点用NetNGIys 1.0(http://www.cbs.dtu.dk/services/NetNGlyc/);用软件SignalP5.0(http://www.cbs.dtu.dk/services/SignalP/)预测蛋白信号肽结构。用TMHMM (http://www.cbs.dtu.dk/ services/TMHMM-2.0/) 预测蛋白的跨膜结构域;用Clustal X进行序列多重比对;用MEGA 7.0[17]的邻接(Neighbor-joining,NJ)法构建系统进化树,Bootstrap置信值为1 000。
1.6 组织表达分析
用PrimeScript RT reagent kit with gDNA Eraser (Perfect Real Time)(Takara,日本)将提取的RNA逆转录成cDNA,每种组织cDNA设置3个重复,并稀释至50 ng/μL,备用。用引物qIKKε-S和qIKKε-A(表1)进行荧光定量PCR,以日本囊对虾为内参基因。按照SYBR Premix Ex TaqTM试剂盒说明书配制反应体系并进行实时荧光定量PCR。反应程序:95℃30 s;95℃5 s,60℃30 s,40个循环;最后进行溶解曲线反应,以检测扩增特异性。每种组织cDNA和内参均设置3个平行。用2-ΔΔCt法[18]计算的相对表达量。
1.7 统计学分析
用SPSS 22.0对数据进行单因素方差分析,结果以平均值± 标准差表示,当< 0.05时差异显著,< 0.01时差异极显著,用Excel 2020作图。
2 结果与分析
2.1 IKKε的克隆与鉴定分析
获得日本囊对虾基因,命名为(GenBank号MZ707249)。cDNA全长4009 bp,其中开放阅读框(ORF)长2337 bp,编码778个氨基酸,5非编码区长174 bp,3UTR长1498 bp。PjIKKε2蛋白理论分子质量为88.076 ku,理论等电点pI为6.07。PjIKKε2蛋白无跨膜结构和信号肽,含有一个激酶结构域(第18-331位氨基酸)、一个类泛素结构域(第310-388位氨基酸),一个TANK结合激酶卷曲螺旋结构域(第407–670位氨基酸)。Global Align分析显示,PjIKKε2蛋白序列与甲壳类IKKε的相似性均高于80%。PjIKKε2与PvIKKε2的相似性最高(89%),与HsIKKε的最低(27%)(表2)。氨基酸序列(图2)多重比对结果表明,IKKε2蛋白在激酶结构域中保守性较高,有140个完全保守的氨基酸(用‘‘*”标记),89个相对保守的氨基酸(用‘‘:”和‘‘.”标记),保守率高达70.68%。

PK为激酶结构域;Ubl_TBK1_like为类泛素结构域;TBK1_CCD1为TANK结合激酶卷曲螺旋结构域

表2 用于多重序列比对的IKKε蛋白及其与PjIKKε2的相似性


下划直线为激酶结构域,“*”, “:”和“.” 分别表示完全保守,保守性强和保守性弱的位点
图3显示,无脊椎动物(甲壳动物、昆虫和海鞘)与脊椎动物各聚为一支,PjIKKε2与其他对虾属的IKKε聚集在一支。斑节对虾和凡纳滨对虾的IKKβ氨基酸序列为外群。
2.2 PjIKKε2的组织表达
在日本囊对虾9个组织中均有表达,其中在淋巴组织中表达量最高(0.05),其次是在神经节和眼柄,在肝胰腺、肌肉、胃和心脏的表达量最低,差异不显著(图4)
2.3 哈维弧菌刺激后PjIKKε2的表达情况
注射哈维弧菌6 h后,在肝胰腺中的表达量显著上调,达到最大值 (< 0.05),随后逐渐减弱并持续至72 h,48 h后恢复正常水平,在6、12和24 h,mRNA的表达量与0 h时有显著差异 (< 0.05)(图5)。

图3 基于IKKε氨基酸序列构建NJ系统进化树
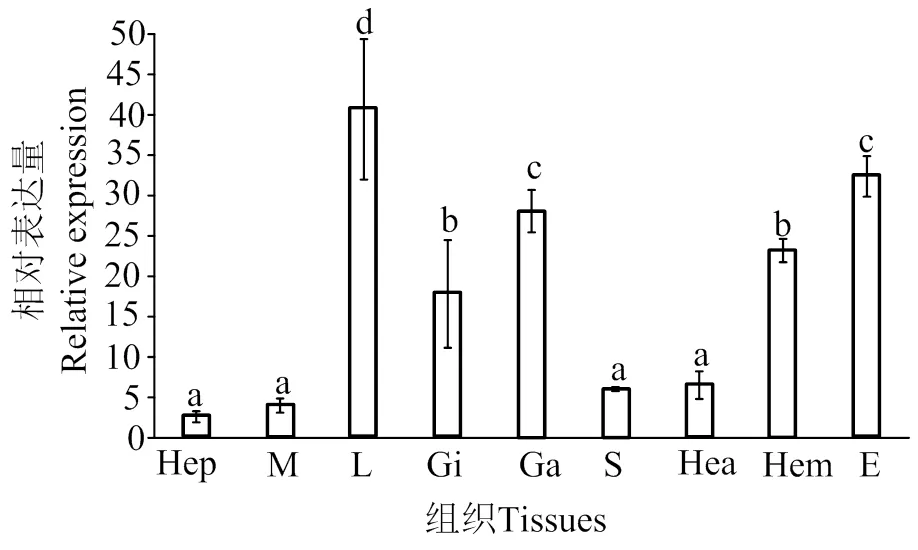
不同字母表示差异显著(P < 0.05)。Hep,肝胰腺;M,肌肉;L,淋巴;Gi,鳃;Ga,神经节;S,胃;Hea,心;Hem,血淋巴;E,眼柄

不同字母表示有显著差异(P < 0.05)
3 讨论
本研究获得日本囊对虾基因的cDNA全长序列,其中ORF长2 337 bp,编码778个氨基酸,含有一个激酶结构域、一个类泛素结构域,一个TANK结合激酶卷曲螺旋结构域。斑节对虾基因编码710个氨基酸,凡纳滨对虾基因编码704个氨基酸,均比的氨基酸序列短。PjIKKε2氨基酸的C端序列比斑节对虾和凡纳滨对虾IKKε2氨基酸C端多70多个氨基酸。这段多出的序列功能需进一步研究。同时,这3种对虾IKKε2蛋白序列均含有激酶结构域。序列比对结果显示,激酶结构域在各物种中高度保守。激酶结构域的功能是催化gamma-磷酸基团的转移。另外,在日本囊对虾PjIKKε2中有类泛素结构域,这与Verhelst等[2]的报道一致。类泛素结构域能优化激酶活性[8]。系统进化树表明,PjIKKε与其他对虾IKKε聚为一支,与物种分类结果一致。
研究证明,IKKε主要在哺乳动物的胰腺、胸腺、脾脏等免疫相关组织和T细胞、白细胞、巨噬细胞、神经细胞和星形状胶质细胞等细胞中表达[2,19]。本研究发现,在日本囊对虾9个组织中均有表达。在其他甲壳动物中,在各组织中均有表达[5,15-16],这可能说明在低等动物中,基因功能更加广泛,在许多组织中均有作用。在淋巴组织中表达量最高。淋巴中有免疫因子,是对虾主要的免疫组织[20]。这也说明的功能保守性,即主要在先天免疫中起作用。另外,在神经节的表达量高,这与凡纳滨对虾的研究结果[15]相似。Möser等[21]发现,IKKε通过激活NF-κB参与小鼠的神经性疼痛。IKKε在对虾神经中的作用,还需进一步研究。
先天免疫是对虾抵御外界病原体的第一道防线[20]。在机体感染病原后,宿主的模式识别受体能识别病原体的配体,从而引起一系列的信号转导,通过IKK复合物产生抗菌肽[22]。在脊椎动物中,IKKε及IKK相关的激酶能使IRF-3和IRF-7磷酸化,从而激活宿主的抗细菌反应[23]。本研究中,注射哈维弧菌6 h后,在肝胰腺中的表达量显著上调,达到最大值。在斑节对虾注射哈维弧菌后,在血细胞的表达量在注射6 h时降低,在12 h时升至注射前,随后逐渐降低[14]。在凡纳滨对虾中,注射溶藻弧菌6 h后,在肝胰腺的表达量上升,是0 h表达量的1.5倍,在24 h达到最大值(是0 h表达量的2倍)[15]。拟穴青蟹在注射溶藻弧菌6 h后,在肝胰腺的表达量达到最大值,随后逐渐下降,在72 h时略有升高[16]。这些结果均说明甲壳类的参与了细菌引起的先天免疫应答过程。
综上,本研究克隆出基因cDNA全长,在哈维弧菌刺激下,mRNA表达表达量均出现不同程度的变化,表明基因参与了日本囊对虾的先天免疫。这为研究IKKε2的免疫功能提供了理论依据,也为研究甲壳类动物的先天免疫应答奠定了基础。
[1] HILLION S, ARLEEVSKAYA M I, BLANCO P, et al.The innate part of the adaptive immune system[J].Clinical Reviews in Allergy & Immunology, 2020, 58(2): 151-154.
[2] VERHELST K, VERSTREPEN L, CARPENTIER I, et al.IκB kinase ε (IKKε): a therapeutic target in inflammation and cancer[J].Biochemical Pharmacology, 2013, 85(7): 873-880.
[3] LAWRENCE T.The nuclear factor NF-kappaB pathway in inflammation[J].Cold Spring Harbor Perspectives in Biology, 2009, 1(6): a001651.
[4] TAKEUCHI O, AKIRA S.Pattern recognition receptors and inflammation[J].Cell, 2010, 140(6): 805-820.
[5] NHNHKORN Z, AMPARYUP P, KAWAI T, et al.IKKs participate in regulation of cytokine-like system and antiviral responses of innate immune system[J].Frontiers in Immunology, 2019, 10: 1430.
[6] MÖSER C V, MEISSNER M, LAARMANN K, et al.The protein kinase IKKepsilon contributes to tumour growth and tumour pain in a melanoma model[J].Biochemical Pharmacology, 2016, 103: 64-73.
[7] PETERS R T, LIAO S M, MANIATIS T.IKKepsilon is part of a novel PMA-inducible IkappaB kinase complex[J].Molecular Cell, 2000, 5(3): 513-522.
[8] IKEDA F, HECKER C M, ROZENKNOP A, et al.Involvement of the ubiquitin-like domain of TBK1/IKK-i kinases in regulation of IFN-inducible genes[J].The EMBO Journal, 2007, 26(14): 3451-3462.
[9] CLÉMENT J F, MELOCHE S, SERVANT M J.The IKK-related kinases: from innate immunity to oncogenesis[J].Cell Research, 2008, 18(9): 889-899.
[10] HEMMI H, TAKEUCHI O, SATO S, et al.The roles of two IkappaB kinase-related kinases in lipopolysaccharide and double stranded RNA signaling and viral infection[J].The Journal of Experimental Medicine, 2004, 199(12): 1641-1650.
[11] KRAVCHENKO V V, MATHISON J C, SCHWAMBORN K, et al.IKKi/IKKepsilon plays a key role in integrating signals induced by pro-inflammatory stimuli[J].The Journal of Biological Chemistry, 2003, 278(29): 26612-26619.
[12]梁志发.日本对虾健康养殖技术[J].海洋与渔业, 2020(7): 62-63.
[13] ZHENG J B, WANG P P, MAO Y, et al.Full-length transcriptome analysis provides new insights into the innate immune system of[J].Fish & Shellfish Immunology, 2020, 106: 283-295.
[14] ZHANG H Q, CHENG W Z, ZHENG J B, et al.Identification and molecular characterization of a pellino protein in kuruma prawn () in response to white spot syndrome virus andinfection[J].International Journal of Molecular Sciences, 2020, 21(4): 1243.
[15] WANG P H, GU Z H, WAN D H, et al.The shrimp IKK-NF-κB signaling pathway regulates antimicrobial peptide expression and may be subverted by white spot syndrome virus to facilitate viral gene expression[J].Cellular & Molecular Immunology, 2013, 10(5): 423-436.
[16] JIANG M, TU D D, GU W B, et al.Identification and functional analysis of inhibitor of NF-κB kinase (IKK) from: The first evidence of three IKKs in crab species and their expression profiles under biotic and abiotic stresses[J].Developmental & Comparative Immunology, 2018, 84: 199-212.
[17] KUMAR S, STECHER G, TAMURA K.MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets[J].Molecular Biology and Evolution, 2016, 33(7): 1870-1874.
[18] LIVAK K J, SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2−ΔΔCTmethod[J].Methods, 2001, 25(4): 402-408.
[19] MÖSER C V, KYNAST K, BAATZ K, et al.The protein kinase IKKε is a potential target for the treatment of inflammatory hyperalgesia[J].The Journal of Immunology, 2011, 187(5): 2617-2625.
[20] TASSANAKAJON A.Innate immune system of shrimp[J].Fish & Shellfish Immunology, 2013, 34(4): 953.
[21] MÖSER C V, MÖLLER M, FLECK S C, et al.Inhibition of the protein kinase IKKepsilon attenuates neuropathic pain in mice[J].Neuropharmacology, 2019, 146: 198-211.
[22] HORNUNG V, LATZ E.Intracellular DNA recognition[J].Nature Reviews Immunology, 2010, 10(2): 123-130.
[23]BAKSHI S, TAYLOR J, STRICKSON S, et al.Identification of TBK1complexes required for the phosphorylation of IRF3and the production of interferon Β[J].The Biochemical Journal, 2017, 474(7): 1163-1174.
Characterization and Expression of Inhibitor-κB Kinase Epsilon 2 in
FAN Si-gang1, LIU Yong1,2,ZHAO Chao1, HOU Si-yu3, QIU Li-hua1,2,3
(1.;,;,,510300,;2.,201306,; 3.,,300384,)
【Objective】In order to investigate inhibitor κB kinase epsilon 2 (IKKε2) response of bacterial infection and elucidate the function of IKKε2 ininnate immunity.【Method】The full-length cDNA of(named) was identified and characterized with bioinformatics strategy.The expression ofwas detected in various tissues under normal condition and in hepatopancreas after the treatment with.【Result】PjIKKε2 cDNA was 4 009 bp length, including a 2 337 bp open reading frame (ORF) encoding 778 amino acid, a 174 bp 5′untranslated region (5′-UTR) and a 1 498 bp 3′-UTR.PjIKKε2 protien contain an N-terminal catalytic kinase domain, an ubiquitin-like domain and a TANK-binding kinase 1 coiled-coil domain.Multiple sequence alignment showed that PjIKKε2 share high identity with that of another IKKε2 of crustacean.The kinase domain was conserved in most species.The phylogenetic analysis suggested that PjIKKε2 was clustered with the closely related IKKs fromand.transcript was detected in all examined tissues with high mRNA expression in lymph.Following the infection of, thewas up-regulated significantly in hepatopancreas (< 0.05) and maximize at 6 h.【Conclusion】PjIKKε2 plays an important role in innate immunity of.
; inhibitor κB kinase epsilon 2; gene expression; innate immunity
S917.4; Q786
A
1673-9159(2022)02-0013-07
10.3969/j.issn.1673-9159.2022.02.002
2021-10-09
国家自然科学基金(31802281);广东省重点领域研发计划项目(2021B0202020002);中国水产科学研究院基本科研业务费专项 (2020TD21) ;广州市科技计划项目(202102020487);广州市农村科技特派员项目(20212100051);中央级公益性科研院所基本科研业务费专项(2021TS03;2021SD11)
范嗣刚(1982―),男,博士,副研究员,从事海洋生物功能基因研究。E-mail: fansigang@scsfri.ac.cn
邱丽华(1971―),女,博士,研究员,从事海洋生物功能基因研究。E-mail: qiugroup_bio@outlook.com
范嗣刚,刘勇,赵超,等.日本囊对虾核因子κB抑制蛋白激酶ε2基因克隆及表达[J].广东海洋大学学报,2022,42(2):13-19.
(责任编辑:刘庆颖)
