ESCRT复合体在细胞质膜损伤修复中的功能*
2022-03-31赵莎莎石丽君
赵莎莎 石丽君 吴 迎
(北京体育大学运动人体科学学院,北京100084)
骨骼肌、血管内皮及胃肠道上皮等细胞质膜在生理情况下处于“损伤”和“修复”的动态平衡中。胞膜损伤的诱因包括细胞内外渗透压改变、细菌毒素打孔、寄生虫感染、机械外力改变和缺血应激等[1]。细胞膜修复(plasma membrane repair,PMR)延迟或受阻可能导致膜的损伤与修复失衡,诱发一系列生理或病理变化。如血管内皮细胞膜的损伤可致动脉粥样硬化,胃肠道黏膜上皮受损可引起胃溃疡的发生,覆盖皮肤表层的复层上皮细胞膜破坏可诱发疤痕产生等[2]。此外,当人体进行高强度或不习惯的运动后(如离心运动),骨骼肌细胞膜将发生明显破损。研究表明,细胞会在机械刺激或化学应激下诱发细胞膜损伤,如不及时进行修复将导致细胞“死亡”。相反,有效的PMR能够及时关闭细胞的“大门”,防止胞内成分的外流及胞外大量离子、氧化剂进入,从而维持胞内环境的稳态,确保细胞存活[3]。细胞膜的修复是一项复杂的“工程”,许多膜修复蛋白协同参与其中,并依据损伤的特点遵守时序性完成修复,其机制目前尚未完全清晰。
实验技术及膜修复的快速动态变化是限制膜修复研究开展的最大障碍,但随着活细胞成像技术的不断发展,这一复杂过程的“神秘面纱”逐渐被揭开。目前研究发现的参与PMR 的蛋白质包括肌营养不良蛋白(dysferlin)、膜联蛋白(annexins)、MG53 (mitsugumin 53)、小窝蛋白(caveolin)、钙激活蛋白酶(calpains)、 突触结合蛋白(synaptotagmin,Syt)、可溶性-乙基马来酰亚胺敏感因子附着蛋白受体(soluble N-ethylmaleimidesensitive factor attachment protein receptors,SNAREs)等[1,4]。近年来,与晚期内吞体形成途径有关的转运必需内体分选复合体(endosomal sorting complex required for transport,ESCRT)系统被认为是打开PMR“黑箱”的关键钥匙。2014年,Jimenez 等[5]证实了ESCRT 系统在质膜小伤口修复过程中的重要作用。随后,Scheffer等[6]又验证了其在质膜大伤口快速修复中的作用机制。基于此,ESCRT 系统是目前探究到的为数不多的既能调控小伤口“缝合”,也能介导大伤口“封印”的重要修复系统。
本文综述了ESCRT 系统介导的以胞外出芽和多囊泡体(multivesicular body,MVB)形成为核心的两种修复方式,梳理了ESCRT 系统各亚复合体在质膜损伤修复中的重要作用,旨在为细胞膜损伤修复提供新的研究思路和防治策略。
1 ESCRT系统的组成及其生理学功能
ESCRT 系统广泛存在于人体的多种组织细胞中,如肌组织、神经组织、上皮组织等,并参与胞质分裂、病毒出芽、细胞凋亡、细胞自噬、蛋白质的质量控制、PMR 及核膜重塑等重要生命过程[5-14]。ESCRT 系统由6 个亚复合体组成,包括
ESCRT-0、 ESCRT-Ⅰ、 ESCRT-ⅠⅠ、 ESCRT-ⅠⅠⅠ、Vps4-Vta1 和ALⅠX 二 聚 体[15]。以 酵 母 为 例,ESCRT系统的结构如图1所示。ESCRT系统的6个亚复合体都由蛋白质-蛋白质复合物构成,不同复合体的亚基虽结构各异,但不同亚基经特定结构域相互联系作为功能复合体共同发挥作用。人类与酵母的ESCRT 系统同源性较高,发挥其特异性作用的结构域或基序相似[15-16]。酵母与人类ESCRT 命名法的转换,各组成部分的功能序列及作用见表1[16-42]。ESCRT 的发现与人们对MVB 的研究密切相关。 MVB 中的内腔囊泡(intraluminal vesicles,ⅠLVs)在ESCRT 的作用下对“货物”蛋白进行分拣,最后由晚期内吞体的限制膜向腔内出芽而成。这些ESCRT 蛋白能够按照顺序依次被招募至内吞体膜上协同形成ⅠLVs。

Fig.1 Basic structure of the ESCRT system图1 ESCRT系统的基本结构
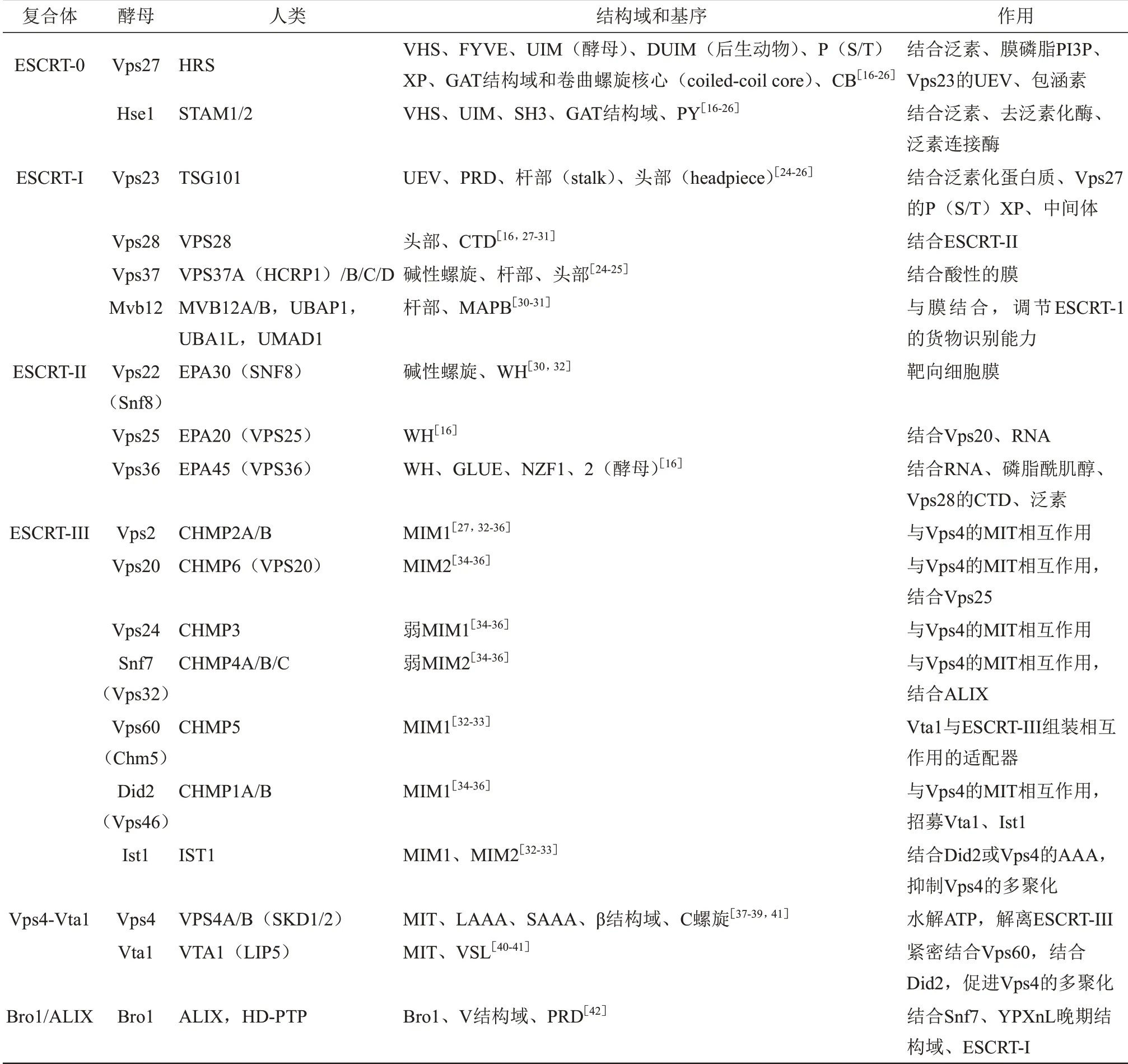
Table 1 ESCRT system composition,naming,functional domain,motif and function表1 ESCRT系统的组成、命名、功能结构域、基序及作用
1.1 ESCRT-0
ESCRT-0的主要功能是识别泛素化蛋白并富集底物。除此以外,ESCRT-0 还具有招募网格蛋白(包涵素)、泛素化连接酶及去泛素化酶的作用。ESCRT-0 由亚基Vps27/HRS 和Hse1/STAM 以1∶1比例构成[18-19]。Vps27 和Hse1 的N 端都包含了能与泛素结合的VHS 结构域[20]。Vps27 的VHS 结构域下游紧跟一个FYVE结构域,Vps27和HRS可通过FYVE结构域与早期内吞体膜的磷脂酰肌醇三磷酸(phosphatidylinosito-3-phosphate,PⅠ3P)结合,从而介导膜定位[21-22]。FYVE结构域的下游是泛素结 合 结 构 域(ubiquitin-binding motif, UⅠM),ESCRT-0的多个泛素结合结构域使其对多聚泛素化链具有很高的亲和力,并对泛素化标记的“货物”蛋白有聚集作用。包涵素通过与HRS 的包涵素结合(clathrin-binding, CB) 结 构 域 相 连, 同ESCRT-0一起被招募,以促进ESCRT-0在电子致密微域中的聚集[23]。Vps27 则通过P(S/T)XP 基序与ESCRT-Ⅰ的Vps23亚基结合[24-26],并将后者招募至内体膜上。ESCRT-0 通过VHS、UⅠM 结构域与泛素结合从而识别标记目的蛋白,是MVB 路径中募集靶蛋白的关键步骤。
1.2 ESCRT-I和ESCRT-II
ESCRT-Ⅰ和ESCRT-ⅠⅠ功能相似,通常协同发挥作用。ESCRT-Ⅰ和ESCRT-ⅠⅠ以1∶1 的比例在膜上组装,其主要功能是使内体膜内陷形成初始芽体[27-28]。ESCRT-Ⅰ由亚基Vps23/TSG101、Vps28/VPS28、Vps37/VPS37 和Mvb12/MVB12 组 成,亚基Vps22/EPA30、Vps25/EPA20 和Vps36/EPA45 则构成了ESCRT-ⅠⅠ[29-31]。其中,ESCRT-Ⅰ亚基Vps23的N 端有一个UEV(ubiquitin E2 variant)结构域,能够结合泛素化蛋白和某些病毒蛋白;Vps28 的C端有一个四螺旋结构CTD,主要负责招募ESCRT-ⅠⅠ;Vps37 的N 端结构域能够帮助ESCRT-Ⅰ与膜结合。Vps22 与ESCRT-Ⅰ的Vps37 功能类似,有助于ESCRT-ⅠⅠ的膜定位。ESCRT-ⅠⅠ亚基Vps25 包含的WH (winged-helix) 结 构 域 能 与ESCRT-ⅠⅠⅠ亚 基Vps20 结合;Vps36 包含一个GLUE 结构域,能与PⅠ3P 结合介导其定位[15]。另外,ESCRT-Ⅰ可通过Vps23 的UEV 结构域与ESCRT-0 相互作用,而ESCRT-ⅠⅠ则 通 过WH 结 构 域 与ESCRT-ⅠⅠⅠ连接[24-26,32]。 ESCRT-Ⅰ 和 ESCRT-ⅠⅠ 通 过 CTD(Vps28)-GLUE(Vps36)结构域相连接,共同驱动MVB的形成,分拣“货物”蛋白[16]。
1.3 ESCRT-III
ESCRT-ⅠⅠⅠ的主要功能是剪切芽颈、生成小泡,其在ESCRT 系统介导膜剪切中发挥了核心作用[33]。ESCRT-ⅠⅠⅠ由 亚 基Vps2/CHMP2、Vps20/CHMP6、 Vps24/CHMP3、 Snf7/CHMP4、 Vps60/CHMP5、Did2/CHMP1 和Ⅰst1/ⅠST1 组 成[15,27,33]。与ESCRT-0、ESCRT-Ⅰ、ESCRT-ⅠⅠ亚复合体不同,ESCRT-ⅠⅠⅠ亚复合体以单体形式存在于细胞基质中,只有当这些亚基在内体膜上有序组装时才能发挥其蛋白分拣转运功能。其中,Vps2、Vps20、Vps24和Snf7 是行使复合体剪切功能的核心亚基,而Vps60、Did2和Ⅰst1并不是ESCRT-ⅠⅠⅠ发挥功能所必需的[15-16]。ESCRT-ⅠⅠⅠ按Vps20-Snf7-Vps24-Vps2顺序进行组装。Vps20是组装的起点,随后Snf7介导多聚化形成丝状、环状或螺旋状结构剪切芽茎,Vps24 终止Snf7 多聚化,Vps2 招募ATP 酶Vps4,Did2 招募Vta1 或Ⅰst1[34-36]。ESCRT-ⅠⅠⅠ不仅可以通过特定区域与ESCRT-ⅠⅠ结合,而且其不同亚基通过MⅠM 基序(MⅠT interacting motif)能与Vps4 等含有MⅠT(microtubule interacting and transport)结构域的蛋白质结合[32]。在水解ATP 提供能量时,Vps4 可能与ESCRT-ⅠⅠⅠ协同作用。ESCRT-ⅠⅠⅠ剪切功能的正常执行依赖于各亚基的多聚化组装[15]。
1.4 Vps4-Vta1
Vps4-Vta1 的主要功能是调控ESCRT-ⅠⅠⅠ的解离以维持ESCRT 系统的正常功能。Vps4 属于AAA+ATP 酶 (ATPases associated with diverse cellular activities),其主要功能是水解ATP 提供能量,将内体膜上的ESCRT-Ⅲ亚复合体解聚下来,从而完成循环利用[15,37-39]。其中,Vps4 由1 个N端结合ESCRT-ⅠⅠⅠ的MⅠT 结构域、1 个大的ATPase结构域、1个小的ATPase结构域、1个β结构域和1个C端螺旋组成[37]。Vta1结合在Vps4上,促进了Vps4 的聚合、催化活性以及与ESCRT-ⅠⅠⅠ的结合[40]。Vta1 的N 端包含了两个序列不同的MⅠT 结构域,通过MⅠT 结构域既能与Did2 结合来介导Vta1 的膜定位,又能与Vps60 紧密结合相互作用。Vta1的C端VSL结构域能与Vps4的β结构域结合。虽然Vta1与Vps4在晶体结构上并不像其他ESCRT复合体亚基之间一样组合相连,但Vta1 与Vps4 在功能上以复合体的形式发挥作用。Vps4-Vta1 共同作用于MVB途径和其他Vps4参与的生命过程[41]。Vta1 与Vps4、ESCRT-ⅠⅠⅠ结合并能促进Vps4 的多聚化、激活ATP酶活性,是Vps4的组装因子。
1.5 ALIX
活化的ALⅠX 形成二聚体发挥作用,其通过Bro1 结构域与Snf7 结合以稳固Snf7 多聚体,并参与招募去泛素化酶Doa4,也可作为适配器连接ESCRT-Ⅰ和ESCRT-ⅠⅠⅠ[15]。除此之外,ALⅠX还能激活ESCRT-ⅠⅠⅠ的组装,调控ESCRT-ⅠⅠⅠ的功能,从而作为功能复合体参与PMR[42-44]。
2 ESCRT系统在PMR中的作用
大多数研究学者认为,细胞膜主要有三种修复模式:胞吞、胞外出芽和膜“补丁”[5]。细胞膜受损时细胞采用何种修复模式取决于“伤害”的性质和“伤口”的大小。如造孔毒素(pore-forming toxins,PFTs) 诱导的“伤口”较小(直径<100 nm),且它们形成的蛋白质孔不能通过脂质补丁修补,所以多采用胞吞和胞外出芽的方式修复;而大伤口(直径200~500 nm)则主要采用膜“补丁”进行修复[1,45-48]。ESCRT 系统可同时参与大伤口和小伤口的修复,但目前对于大伤口修复的研究较少[5-6]。根据ESCRT系统介导修复模式的不同,可将其分为胞外出芽和MVB 形成两种修复途径。
2.1 ESCRT系统与出芽修复
胞外出芽修复依赖于ESCRT 系统。激光诱导的HeLa 细胞膜损伤实验中,活细胞成像观察发现了膜伤口处ESCRT 系统相关蛋白招募,其中包括ESCRT-ⅠⅠⅠ 的 CHMP4B、 CHMP3、 CHMP2A、CHMP2B 亚基和VPS4。在此基础上,Jimenez等[5]进一步研究证实了CHMP4B 在该修复方式中发挥了关键作用。扫描电子显微镜观察可见,损伤区域附近带有CHMP4B 荧光标记的细胞外芽,用siRNA-CHMP4B 技术处理损伤细胞后发现细胞存活率显著下降,证实ESCRT-ⅠⅠⅠ可通过出芽的方式参与PMR[5]。随后在其他研究中又陆续验证了Ca2+、Annexin A7和ALG-2(apoptosis link protein)是ESCRT 系统介导出芽修复的重要参与者,ESCRT系统介导的出芽修复机制如图2所示。
2.1.1 Ca2+触发ESCRT系统相关蛋白的顺序性装配
Ca2+是启动ESCRT系统介导出芽式修复的“钥匙”。Scheffer等[6]证实只有当细胞内Ca2+增多时,细胞膜表面的ALⅠX、ALG-2、VPS4 和ESCRT-ⅠⅠⅠ聚集才会增强。反之,无Ca2+时未能观察到ESCRT参与的修复发生。
ESCRT 系统介导的出芽修复相关蛋白的募集呈现出严格的时序性。损伤后的细胞膜表面可见修复蛋白呈现顺序性聚集,如ALⅠX和ALG-2在损伤后30 s 内开始组装,CHMP1A 和CHMP4B 于损伤后45 s 开始组装,而VPS4 则于损伤后60 s 开始组装[6]。该修复过程中招募的钙离子结合蛋白ALG-2已被证实以Ca2+依赖的方式与ALⅠX、TSG-101 和CHMP4B相联系。Sønder等[44]用免疫共沉淀证明了ALG-2 与Annexin A7 以复合体的形式聚集于损伤处,ESCRT-ⅠⅠⅠ和VPS4功能的执行依赖于ALG-2与Annexin A7 精确的膜定位。首先,Annexin A7以Ca2+和磷脂酰丝氨酸依赖的方式与游离的膜边缘结合,并促进Ca2+与膜的结合;其次,Annexin A7在细胞膜损伤时被招募至损伤部位靶定于细胞膜,并于损伤处与具有EF-Hand结构的钙离子结合蛋白ALG-2结合,ALⅠX通过与ALG-2直接作用被招募至细胞膜缺口处;最后,ALG-2 与ALⅠX 组装ESCRT-ⅠⅠⅠ亚复合体和TSG101,在伤口愈合过程中帮助切除和脱落细胞膜的受损部分[6,44,49]。综上所述,ESCRT-ⅠⅠⅠ和VPS4 等ESCRT 系统相关蛋白在损伤细胞膜上的定位累积需要Annexin A7、ALG-2和ALⅠX复合体的形成,且缺一不可[44]。
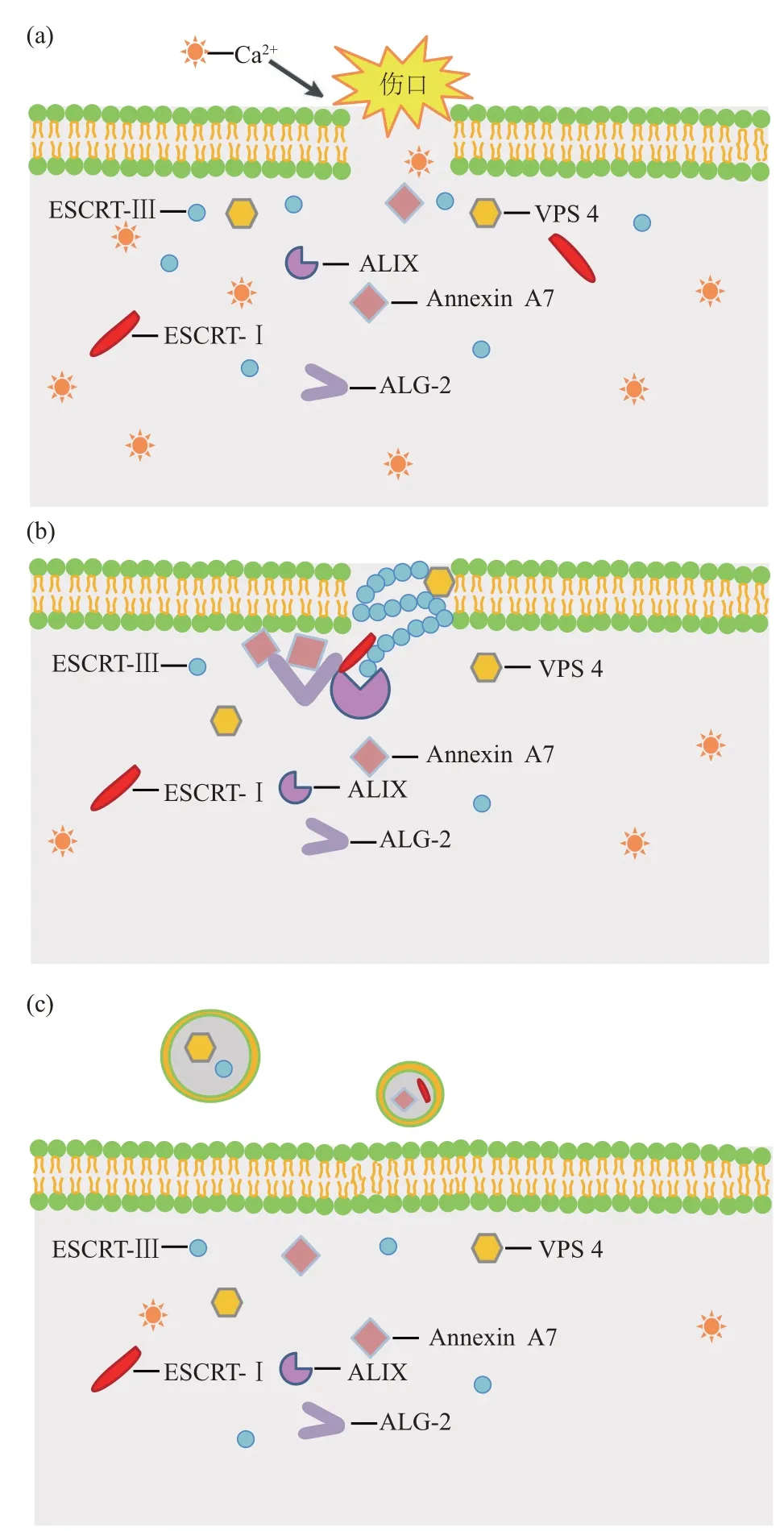
Fig.2 Budding repair mediated by the ESCRT system图2 ESCRT系统介导的出芽式修复
2.1.2 ESCRT-III和VPS4参与出芽小泡的形成及脱落
膜断裂和囊泡形成是修复所必需的,ESCRT-Ⅲ和VPS4参与了出芽小泡的形成及脱落过程。行使重要修复职能的ESCRT-ⅠⅠⅠ由众多亚基组成,这些亚基是细胞质中不活跃的单体,当膜修复触发后,它们能组装成具有活性的ESCRT-ⅠⅠⅠ异型聚合物[15]。在此过程中,ESCRT-ⅠⅠⅠ一方面驱动细胞膜向胞外突出变形、剪切芽颈,促进胞外小泡(或微囊泡体)的释放[33],另一方面,Meng 等[50]研究发现ESCRT-ⅠⅠⅠ可作为上游信号招募与细胞膜修复相关的关键蛋白Syntaxin2 和EFF-1。VPS4 主要在水解ATP 提供能量的条件下介导ESCRT-ⅠⅠⅠ的解离。
ESCRT-ⅠⅠⅠ介导的胞外出芽式修复具有以下特点:a.ESCRT-ⅠⅠⅠ靶向细胞膜聚集不需要ATP。出芽修复过程中的关键亚基CHMP4B 在细胞膜中的募集不需要完全聚合的微管,不依赖于ATP。b.胞外出芽修复主要依赖于ESCRT-Ⅲ和VPS4。于“伤口”处监测ESCRT-0、ESCRT-Ⅰ和ESCRT-ⅠⅠ,只观察到了TSG101 在膜处的聚集[5-6]。TSG101 在适配器ALG-2 的作用下连接ALⅠX,这可能是TSG101在PMR 部位积累的基础[49]。ALⅠX 通过特定结构域直接与ESCRT-ⅠⅠⅠ相连接,在出芽修复中损伤诱导的ESCRT-ⅠⅠⅠ组装绕过了ESCRT-0、Ⅰ和ⅠⅠ。c.与MVB 路径相比,出芽修复中的泛素化反应相对滞后。MVB 途径中“货物”蛋白的泛素化是修复的初始过程,而出芽修复中TSG101引起的多聚泛素化反应相对延迟。与MVB 路径不同,出芽式修复中滞后的泛素化反应主要是为了加强最初ESCRT系统的招募[51]。两种修复方式中ESCRT参与工作的机制并不相同,相比之下,ESCRT 介导的MVB修复更为复杂。
2.2 ESCRT系统与MVB形成的修复
MVB生物发生涉及20多种囊泡分拣蛋白,其中最重要的是在内吞体膜上聚集的ESCRT 蛋白。PMR 过程中,损伤细胞膜向内凹陷形成约300~500 nm 大小的细胞内吞泡,经内吞体途径发展,在ESCRT 系统的作用下,内吞泡融合在一起形成富含多个ⅠLVs 的MVB[16]。MVB 形成后一方面可以通过溶酶体途径将侵害细胞膜的PFTs 或受损蛋白降解,另一方面可与细胞膜融合并胞出大量促使组织修复和再生的细胞外囊泡(extracellular vesicles, EVs), 通 过 这 两 种 途 径 完 成PMR[45,52-55]。
2.2.1 ESCRT-0、Ⅰ 、Ⅱ、Ⅲ介导MVB的形成
MVB 的形成始发于细胞膜内陷。当细胞膜受损时,胞外Ca2+向胞内聚集,Ca2+浓度升高触发溶酶体胞吐,溶酶体与细胞膜的融合可减轻膜张力,引起酸性鞘磷脂酶(acid sphingomyelinase,ASM)释放。鞘磷脂酶移至细胞膜表面,水解鞘磷脂磷脂酰胆碱头部基团产生富含神经酰胺的微域,随后神经酰胺驱动膜内陷使受损脂质和蛋白质等内化形成内吞囊泡[47,53]。这种膜响应方式作为真核生物保护自己免受细菌攻击的早期有效方法。该过程中的内陷囊泡也被称为早期内吞体,早期内吞体是晚期内吞体形成的基础,MVB就是含有众多ⅠLVs的成熟晚期内吞体。ⅠLVs 的形成依赖于ESCRT 亚复合体蛋白,这些蛋白质是泛素化蛋白正确分选后内陷到MVB腔间隙囊泡中所必需的[7]。
ESCRT系统是MVB形成的重要参与者,其亚复合体通过特定的功能结构域使“货物”蛋白实现顺序性呈递[7,16]。首先,“货物”蛋白被泛素化修饰。“货物”蛋白需被泛素标记后才能被ESCRT-0的Vps27 亚基和Hse1 亚基的VHS、UⅠM 泛素结合结构域所识别。其次,ESCRT-0、ESCRT-Ⅰ及ESCRT-ⅠⅠ通过特定亚基与内吞体膜上的特异性脂质磷脂酰肌醇三磷酸结合,这有助于ESCRT 系统在内吞体的靶向定位。ESCRT-0、Ⅰ、ⅠⅠ亚复合体按照P(S/T)XP 基序-UEV 和CTD-GLUE 的顺序连接起来,随后经各自的泛素结合结构域实现泛素化“货物”的顺序性呈递。最后,ESCRT-ⅠⅠⅠ通过亚基Vps25 与Vps20 之间的连接被ESCRT-ⅠⅠ招募。ESCRT-0能结合泛素连接酶和去泛素化酶协调泛素化及去泛素化过程,是簇集“货物”蛋白的主要因子。ESCRT-Ⅰ和ESCRT-ⅠⅠ这两种亚复合体富集于囊泡芽颈处,显著降低了泛素化蛋白的运动性,能够有效诱导芽体生成,启动膜内陷。ESCRT-ⅠⅠⅠ的组装是按照亚基Vps20-Snf7-Vps24-Vps2 的顺序依次进行,主要功能是剪切芽颈驱动囊泡的产生。在ESCRT 系统的调控下,泛素化“货物”被分选并向内凹陷形成囊泡释放至内腔中。随着ⅠLVs 的增多,MVB逐渐形成[7,15-16,28]。
最新研究表明,哺乳动物细胞中除了典型的ESCRT-0、 ESCRT-Ⅰ和ESCRT-ⅠⅠ依 赖 途 径 外,ALⅠX 能绕开ESCRT-Ⅱ直接激活ESCRT-ⅠⅠⅠ,作为替代的适配器将“货物”蛋白分选到ⅠLVs[7]。活化的ALⅠX 形成二聚体,作为支架蛋白偶联CHMP4,调控及稳定CHMP4 的多聚化。ALⅠX 通过 亚 基CHMP4、 TSG101 分 别 与ESCRT-ⅠⅠⅠ、ESCRT-Ⅰ相互作用,具有连接ESCRT-Ⅰ和ESCRT-ⅠⅠⅠ的潜力。此外,Baietti 等[56]和Hurley 等[57]报道了ALⅠX 与细胞内接合蛋白syntenin 的结合能促进MVB 来源EVs 的释放。目前认为ALⅠX 在MVB途径中充当“辅助角色”,但这些该研究的重要发现提示了ALⅠX 可能在MVB 修复中举足轻重,这需要进一步研究证实。
2.2.2 Vps4-Vta1介导ESCRT-ⅠⅠⅠ的解聚与循环
ESCRT-ⅠⅠⅠ完成剪切后,不会进入ⅠLVs 内部,而是留在内体膜表面。Vps4-Vta1 亚复合体的催化作用使ESCRT-ⅠⅠⅠ各亚基发生解聚并从内体膜释放到细胞质中,完成循环并作用于下一轮膜剪切。ESCRT-ⅠⅠⅠ的解聚是一个耗能过程,Vps4 水解ATP提供能量使ESCRT-ⅠⅠⅠ构象改变,最终使其解聚。Vps4 是ESCRT 整个系统的反应能量来源,也是ESCRT系统参与的生理过程的“总开关”,其缺失将导致MVB途径被完全阻断[58-59]。
除此之外,MVB 途径的正常进行需要完整的泛素化和去泛素化过程。因此,控制蛋白质的泛素化对于ESCRT 系统调控的ⅠLVs“货物”分选至关重要[60]。E3泛素连接酶和去泛素化酶是ESCRT系统介导的蛋白质分选的关键调节因子。MVB 途径的调控不仅是通过调节“货物”泛素化实现的,而且也是通过控制ESCRT 系统组件(如HRS、TSG101 和ALⅠX) 的泛素化来实现的。Amerik等[61]在萌芽酵母实验中证实,“货物”去泛素化发生在ⅠLVs分选之前。“货物”蛋白被泛素化修饰以进入MVB 途径进行分拣,并在进入MVB 囊泡之前及时去掉泛素分子,这对于维持细胞内泛素的稳态具有重要意义。
2.2.3 MVB发展路径与PMR
MVB 形成后可通过两种不同的发展路径促进PMR,即通过溶酶体途径直接将内含物降解和驱动MVB同细胞膜融合释放ⅠLVs。MVB中的PFTs、膜表面蛋白及膜脂质等可趋向溶酶体降解。Corrotte 等[45]已证实,内吞毒素以MVB 的形式趋向溶酶体降解。PFTs 或受损膜蛋白的内吞清除过程包括溶酶体的胞吐和窖体的内吞,以及ESCRT系统介导的ⅠLVs 在晚期内吞体内的萌发。“货物”被泛素化修饰后分选进入MVB,最后通过溶酶体途径在酸性环境中将囊泡中的“货物”蛋白进行降解。虽然ⅠLVs 中的“货物”主要靶向至溶酶体,但一些ⅠLVs 及其“货物”并不一定要降解。MVB经胞吐释放出传递细胞外信号的ⅠLVs,这些ⅠLVs也是一种EV。大量研究发现细胞间存有众多来源于MVB 的EVs[62]。PMR 过程中,SNARE 蛋白和众多束缚因子,如突触关联蛋白(SNAP23)、突触融合蛋白1a(Syntaxin1a)、囊泡相关膜蛋白7(vesicle-associated membrane protein 7,VAMP7)、VAMP8、Rabs11、Rabs27 和Rabs35 等协同作用,促使MVB 趋向细胞膜进行胞吐,并在胞外分泌时释放ⅠLVs[53]。通过囊泡运输,受损的细胞膜一般可在损伤后几分钟内完成修复。但当质膜受损严重时,EVs 释放的细胞外信号将调控修复过程持续进行。
ESCRT系统介导的胞外出芽和以MVB形成为核心的两种修复途径既有区别又有联系。它们的共通点是在修复过程中都有EVs产生,不同点是这两种修复方式所产生的EVs 大小、组成和来源不同。例如,出芽小泡的直径约在150~1 000 nm,而ⅠLVs 直径约在30~150 nm。Roefs 等[54]和Cabral等[55]认为,EVs 能够以旁分泌或内分泌的方式促进组织修复和创面愈合。此外,Bittel等[53]报道出芽和MVB 两种途径产生的EVs 均可参与骨骼肌细胞膜损伤修复。骨骼肌作为人体运动的主要功能器官,细胞膜的损伤较为常见。大强度运动或离心收缩后骨骼肌最明显的损伤就是细胞膜通透性提高,若能促进骨骼肌运动后细胞膜的损伤修复,将有利于骨骼肌疲劳的恢复加速,改善运动疲劳恢复效率。基于此,深入研究ESCRT系统在PMR中的作用,将有助于探寻促进骨骼肌细胞膜损伤修复的新方法,为促进运动骨骼肌疲劳恢复提供新思路。
3 ESCRT系统膜修复异常与疾病
细胞膜破损出现“伤口”是程序性坏死、细胞焦亡及铁死亡等细胞坏死的主要诱因[63]。一方面,经“伤口”释放的细胞因子能够诱导细胞裂解并刺激机体进行免疫应答,而这与癌症、败血症和神经退行性疾病等密切相关。另一方面,ESCRT 系统及时、有效地修复可延缓细胞“死亡”,成为相关疾病治疗的新靶点[64-67]。
ESCRT 系统的膜修复功能为治疗癌症提供了新思路。大量研究证实,ESCRT-Ⅲ亚复合体通过修复受损的细胞膜能抑制程序性坏死、细胞焦亡及铁死亡[64-66]。ESCRT-Ⅲ亚基CHMP4B 在这三个不同的调控细胞“死亡”途径中具有共同作用,即抗衡膜穿孔和延迟细胞“死亡”,这为细胞存活争取了宝贵时间,受损细胞得以释放特异性细胞因子向邻近细胞发出危险信号。ESCRT-Ⅲ的“拯救”机制有可能延长被病毒感染的细胞寿命,降低氧气缺乏导致的移植损伤及减轻心脏病或中风引发的组织缺血损伤等[66]。但是,坏死过程中与膜结合的死亡执行因子(如MLKL、焦孔素(gasdermins)、脂质过氧化物(lipid peroxides))浓度过高时,细胞的修复机制不堪重负,也会导致膜破裂和“死亡”。Liu 等[68]认为负调控依赖于ESCRT-Ⅲ的膜修复功能促进细胞的非凋亡性死亡,这在一定程度上能够提高抗癌剂对肿瘤细胞“死亡”的敏感性,可作为治疗肿瘤的潜在靶点。
ESCRT 系统的膜修复功能为治疗阿尔茨海默病(Alzheimer’s disease,AD)提供了新的可能。β 淀粉样蛋白(β-amyloid protein,Aβ)异常沉积是AD发病的关键,与神经细胞的氧化损伤、突触功能紊乱、细胞内钙离子失调及神经细胞凋亡等有关[69]。所以,降低Aβ含量及减弱其神经毒性作用是延缓AD 进程、减轻AD 症状的关键。ESCRT 系统通过胞外出芽和MVB 途径共同调控Aβ 毒性[67,70-71]。例如,Fruhmann 等[67]敲除Bro1 基因证实了ESCRT系统可通过增强膜修复功能下调Aβ毒性。此外,溶酶体膜、核膜等的修复也是由ESCRT 系统介导的。溶酶体膜修复时,ESCRT-ⅠⅠⅠ依赖TSG101 和ALⅠX 被招募至伤口处[72];核膜修复过程中,CHMP4B 被ESCRT-Ⅲ附属蛋白CHMP7 及核膜内层蛋白LEMD2 招募至损伤部位发挥作用[73]。
ESCRT 系统为肌肉损伤或肌营养不良患者提供了潜在的治疗靶点。当骨骼肌受到机械刺激,或因遗传性疾病(如肌营养不良)使肌纤维脆性增加时,膜损伤更容易发生。肌纤维修复主要依赖于胞内修复蛋白如dysferlin、annexins 和ESCRT 系统等,而再生则侧重依赖于ESCRT 系统和激活卫星细 胞(satellite cells,SCs) 增 殖 分 化 的EVs。Scheffer等[6]已证实,在肌细胞质膜大面积局灶性损伤中,ESCRT 系统发挥了重要作用,若其功能丧失将会抑制受损质膜出芽形成EVs,最终影响修复完成。Le Bihan 等[74]认为,EVs 不仅可以作为监测先天性肌病进展的生物标志物,而且能够有效协调细胞内和细胞间的信号交流,增强修复效应,改善先天性肌病。Koutsoulidou 等[75]研究表明,EVs 在1 型肌强直性营养不良(myotonic dystrophy type 1,DM1)中发挥作用。ESCRT系统对EVs的产生和调控是至关重要的,因此,在未来有关EVs引起的疾病可考虑以ESCRT 系统为落脚点,可能会实现新的突破。
4 总结与展望
ESCRT 系统是PMR 近年来的研究热点。深入探究ESCRT 系统的修复机制,能够为有效干预细胞膜损伤修复提供帮助。以ESCRT 系统为靶点完善或加速PMR 过程,可为机械损伤或化学应激引起的细胞膜损伤修复提供新方法。例如,ESCRT系统的PMR 机制为运动骨骼肌的加速恢复提供了潜在可能。如何加速骨骼肌在延迟性肌肉酸痛(delayed onset muscle damage,DOMS)期的恢复是提高运动训练效率的重要问题,通过加速细胞膜“伤口”的封印,将有效防止肌细胞胞内成分的外流和胞外大量离子、氧化剂进入,从源头加快骨骼肌损伤修复和运动疲劳的消除。ESCRT 系统可能在运动或遗传性缺陷引起的肌肉损伤修复和再生中发挥重要作用。因此,外源性ESCRT 重组蛋白手段干预促进ESCRT 系统修复可能成为骨骼肌、血管内皮及神经元损伤修复的治疗靶点之一。
与其他膜修复蛋白相比,ESCRT 系统的修复过程更为复杂,其机制远未明了。例如:胞外出芽和MVB 形成两种修复方式的触发顺序、时程特点尚未完全清晰;ALⅠX如何激活ESCRT-Ⅲ也未见报道;Vps4十二聚体是如何撬动ESCRT-ⅠⅠⅠ亚复合体以实现解聚反应目前难以阐明;ESCRT 可调控信号转导,其介导PMR的信号转导机制还有待探讨。PMR精密且复杂,“修补匠们”各司其职共同完成修复,ESCRT 与其他膜修复蛋白是如何协同工作的,是否相互影响?在膜修复不同模型中其又有哪些特点?如“修复帽”模型中ESCRT 系统是否参与?这些都是今后研究ESCRT 膜修复中需要解决的问题。
