生物钟Bmal1基因与慢性代谢性疾病及其运动干预研究进展*
2022-03-31狄凌云田振军
狄凌云 田振军
(陕西师范大学体育学院暨运动生物学研究所运动与心血管健康研究室,西安710119)
生物钟又称为昼夜节律,是机体内以24 h为周期的行为、生理和分子的周期变化[1]。脑和肌肉芳香烃受体核转运样蛋白1 基因(brain and muscle arnt-like 1,Bmal1)作为生物钟的核心基因,与时钟节律调节因子(circadian locomotor output cycles kaput,Clock)、周期基因(period,Per1、Per2、Per3) 和 隐 花 色 素 基 因(cryptochrome,Cry1、Cry2)等时钟基因组成反馈环路调控机体昼夜节律[2]。机体诸多生理活动均受到生物钟的调节,如睡眠-觉醒周期、葡萄糖代谢、胰岛素分泌、学习记忆等[3]。昼夜节律紊乱和睡眠障碍已成为慢性代谢性疾病患病率显著升高的新危险因素,并均伴随Bmal1的异常表达[4-5]。研究证实,Bmal1与多种慢性代谢性疾病关系密切,如心肌梗死[6]、动脉粥样硬化[7]、糖尿病[8]和骨关节炎[9]等。
2017 年Tahara等[10]报道,运动可参与调节昼夜节律紊乱。2018年国际运动生物化学大会之后,运动科学领域对昼夜节律调控研究呈高度关注。Esser 等报道,运动可通过调节生物钟基因改善骨骼肌代谢[11-12],以降低慢性代谢性疾病的患病风险。因此,运动可能通过上调Bmal1表达调节昼夜节律及机体生理过程,进而改善昼夜节律紊乱及其诱发的多种慢性代谢性疾病。本文梳理生物钟Bmal1基因与慢性代谢性疾病的关系及其运动干预研究进展,旨在为运动防治慢性代谢性疾病提供新思路。
1 Bmal1生物学特征与昼夜节律调控
1.1 Bmal1的生物学特征
早在1997 年,已有研究发现脑和肌肉中的Bmal1(又称为aryl hydrocarbon receptor nuclear translocator-like protein 1,Arntl或Mop3)是哺乳动物体内分子生物钟的核心基因[13-16]。Bmal1位于11号染色体短臂,由20 个外显子组成,属于bHLHPAS(basic helix-loop-helix-per-arnt-sim)结构域转录因子家族,在大脑、心脏、肝脏、肾脏等多器官表达,参与昼夜节律的调控[17-18],在生物钟调控中发挥关键作用。
1.2 Bmal1与昼夜节律调控
在昼夜节律的反馈环路中,BMAL1 是哺乳动物CLOCK的分子伴侣,两者共同作为活化因子调控 昼 夜 节 律[19]。 具 有bHLH-PAS 结 构 域 的BMAL1、CLOCK蛋白结合形成异源二聚体,作为反馈环路的正性调控元件,从E 盒位点来激活Per和Cry并 诱 导Per、Cry进 行 转 录 翻 译[19]。而 后PER/CRY 复合物在细胞质积聚后进入细胞核,抑制CLOCK 与BMAL1 二聚体的转录活性,进而抑制自身的转录翻译[20],由此形成一条以24 h 为周期的“转录-翻译-翻译后反馈抑制”的负反馈环路(transcriptional-translational feedback loop,TTFL)[21]。同时,启动子上具有E 盒位点的其他生物钟靶基因,在BMAL1/CLOCK 的调控下可进行转录且呈一定节律性表达,这些基因被称为时钟控制基因(clock controlled genes,CCGs)[22]。此外,视黄酸相关孤儿受体α(retinoic acid-related orphan receptor α,RORα)和核受体亚家族1D 组成 员1 (nuclear receptor subfamily 1 group D member 1,NRⅠD1或REV-ERBα)等蛋白质构成的反馈环路,可结合到BMAL1启动子区的视黄酸相关孤儿受体反应元件(retinoic acid-related orphan receptor response element,RORE)上来分别增加和抑制BMAL1 表达,参与昼夜节律的调控[23-24](图1)。Bmal1除了在生物钟基因转录过程中发挥关键作用外,也是连接生物钟及哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路的翻译因子,参与调节蛋白质的合成[25]。因此,Bmal1在昼夜节律调控中发挥重要作用。Bmal1不仅受到来自下丘脑的视交叉上核中央时钟的调控(神经-体液网络方式),还参与调节位于心、肺、肝等组织器官的外周时钟[26]。综上,Bmal1可通过自身表达及其所在的正负反馈通路调节昼夜节律,最终使器官、组织和细胞水平的生命活动高度有序协同。
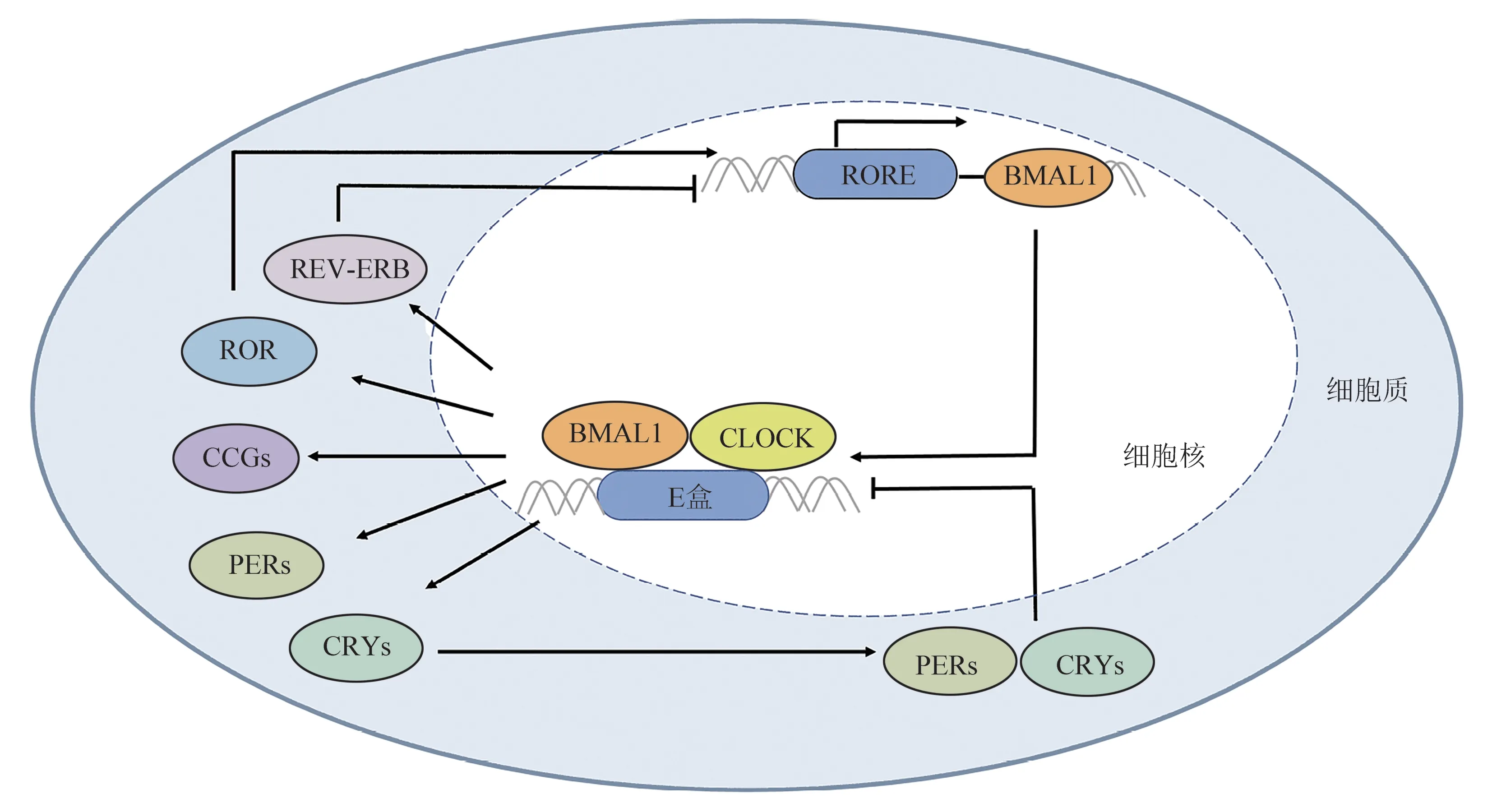
Fig.1 Circadian clock transcription-translation feedback regulation[18-23]图1 生物钟的转录-翻译反馈环路[18-23]
2 Bmal1与慢性代谢性疾病
核心时钟基因Bmal1与心血管疾病、肌骨代谢异常、肝病、糖脂代谢紊乱,以及神经退行性疾病关系密切,Bmal1缺失或过表达后可导致不同器官组织的病理变化(表1)。
2.1 Bmal1与心血管疾病
Bmal1在心脏和血管中广泛表达。心血管系统通过生物钟来感知昼夜节律的变化,进而调节血压、心率、内皮功能等[27-28]。多数心血管疾病的发生都伴随着昼夜节律紊乱[29],同时昼夜节律的改变也可能增加心血管疾病的患病风险[30-31]。因此,Bmal1在维持心血管系统的正常功能上及预防与减缓心血管疾病发病进程中均发挥重要作用。
Bmal1与高血压关系密切。高血压作为临床常见的心血管疾病,是影响全球疾病负担的首要危险因素[32]。Woon 等[33]研究发现,Bmal1与高血压、2 型糖尿病的易感性有关。Bmal1敲除小鼠(Bmal1-/-)血压不再呈昼夜性变化[34]。自发性高血压大鼠(spontaneous hypertensive rats,SHR)中肝脏Bmal1和Reverb表达减弱,同时伴随腓肠肌中过氧化物酶体增殖激活受体γ 共激活剂1α(peroxisome proliferator-activated receptor-γ coactivator 1α,PGC-1α)表达降低,Clock和肌肉特异性时钟控制基因(myogenic differentiation 1,Myod1)也不再参与维持其昼夜节律[35]。另有研究发现,SHR 大鼠肾上腺生物钟节律异常,与正常WT鼠相比,其Bmal1、Per2和Cry1等时钟基因的表达节律较为提前[36]。SHR 大鼠中的Bmal1、Clock和Per1等时钟基因还可能通过沉默信息调节因 子1 (silent information regulator 1,Sirt1) 和Rev-erb等基因调节脂质代谢,进一步影响SHR 大鼠24 h 的脂质代谢水平[37]。因此,Bmal1及其调控的昼夜节律在高血压发病进程中可能起到关键作用。
Bmal1在动脉粥样硬化研究领域已得到广泛关注。动脉粥样硬化是一种由于动脉出现脂质沉积,同时伴随肌细胞和纤维基质增殖,从而逐渐形成动脉粥样硬化斑块的慢性心血管疾病。在该病发病进程中,炎症反应起到重要作用[38]。而昼夜节律参与控制炎症反应与新陈代谢,可能会影响动脉硬化和血栓形成的病理变化过程[39]。研究发现,Bmal1可抑制氧化低密度脂蛋白(oxidized low density lipoprotein,oxLDL) 所诱导的细胞内活性氧(reactive oxygen species,ROS)积累及内皮-间充质转换,当Bmal1缺乏时会加重内皮-间充质转换,从而促进动脉粥样硬化斑块的形成[7]。动脉粥样硬化小鼠模型中,miR-155 通过靶向抑制Bmal1的表达诱导内皮细胞凋亡和炎症反应,削弱主动脉舒张功能,加速动脉粥样硬化发病进程;而当Bmal1表达增加时,可阻碍miR-155 对疾病的促进作用[40]。Bmal1-/-小鼠主动脉表现出内皮功能障碍,同时伴随Akt/eNOS 信号通路显著被抑制,导致血管功能受损[41]。这些研究提示,Bmal1可能是治疗动脉粥样硬化、维持血管稳态的新靶点。
Bmal1与 心 肌 梗 死(myocardial infarction,MⅠ)密切相关。MⅠ属于严重的缺血性心脏病,心肌表现为持续供血不足,进而激发炎症反应、纤维化等病理过程,引发心肌细胞的凋亡或坏死,最终导致心室重构、心力衰竭和死亡[42]。MⅠ和心脏病猝死多发生于凌晨,具有明显的时间依赖性[43],这可能是由于交感神经(sympathetic nervous system,SNS)活性较高和相关体液因素所致。急性左冠状动脉结扎14 d 后,大鼠心肌中Bmal1和Npas2表达的昼夜振荡显著增强[44]。心脏Bmal1-/-小鼠心肌成纤维细胞和巨噬细胞中p21、S100钙结合 蛋 白A4 (S100 calcium binding protein A4,S100A4)和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达均显著增加,纤维化程度显著增高;另外,陈旧性MⅠ患者的心肌成纤维细胞中Bmal1表达减少,p21、S100A4 和TNF-α 升高[45]。Skrlec等[6]对431例MⅠ住院患者和626名健康对照者进行MⅠ与3 种生物钟基因(Bmal1、Clock和Per2) 和单核苷酸多态性(single nucleotide polymorphisms,SNPs)的关系研究,发现Clock和Bmal1中的基因多态性可能与MⅠ密切相关。此外,昼夜节律紊乱可通过激活SNS影响MⅠ大鼠的心室重构,加重心肌纤维化和心功能障碍[46]。BMAL1、CLOCK 和CRY 等时钟蛋白也可通过影响p65磷酸化进而作用于核因子κB(nuclear factorκB,NF-κB)炎症通路[47],参与介导MⅠ病理进程中的炎症反应。综上认为,核心时钟基因Bmal1参与调控MⅠ的病理变化过程。
Bmal1参与介导心肌病的发病进程。心肌病通常是由不同病因引起的心脏机械和电活动异常,其主要特点为心室异常肥厚或扩张,严重时会引发进展性心力衰竭,乃至心源性猝死[48]。扩张性心肌病(dilated cardiomyopathy,DCM)作为一种原发性心肌病,是导致心力衰竭的重要因素之一,通常伴随心肌收缩功能障碍[49]。Bmal1-/-小鼠随着年龄的增长易患扩张性心肌病,主要表现为心肌壁变薄、左心室扩张和心功能下降[50]。心肌细胞Bmal1-/-(cardiomyocyte-specificBmal1knockout,CBK)小鼠心室舒张功能异常,促炎因子表达增多,心脏趋向早衰[51]。在经历16周慢性的光/暗周期循环后,CBK 小鼠表现出心肌肥大,其分子标记物mcip1 表达增加[52]。糖尿病心肌病属于继发性心肌病,其主要发病原因是高血糖诱导心肌细胞受损[53]。研究表明,Bmal1可通过抑制mTOR 活性,进而抑制高糖诱导的自噬效应及心肌细胞损伤以减缓发病进程[54]。综上推测,Bmal1可能是预防心肌病变及维持心功能的潜在靶点。
2.2 Bmal1与肌骨代谢异常
骨骼肌是全身最大的器官之一,约占全身质量的40%。骨骼肌内有2 300 多个以昼夜节律模式表达的基因参与骨骼肌的生成、转录与代谢[55]。生物钟紊乱易引发骨骼肌功能及代谢障碍。Bmal1-/-小鼠表现出渐进性肌萎缩,并伴有早衰现象[16]。Bmal1-/-小鼠和昼夜紊乱模型ClockΔ19小鼠骨骼肌收缩力显著降低,同时伴随肌肉的线粒体体积减小[56]。小鼠肌细胞缺失Bmal1可阻断其对葡萄糖代谢通路的转录控制,激活脂肪酸氧化,促进肝脂肪变性[57-58]。故认为,Bmal1在维持骨骼肌功能和新陈代谢方面发挥重要作用。
研究发现,Bmal1和Clock可通过Sirt1 调节肌肉胰岛素敏感性[59]。12 周运动训练可增加受试者骨骼肌BMAL1 和PER2 蛋白的表达,改善胰岛素敏感性并提高最大摄氧量,从而防治肥胖与糖尿病的发展[60]。此外,生肌调节因子家族(myogenic determination gene,MyoD)是昼夜时钟转录因子Bmal1与Clock的 靶 向 目 标[61]。Bmal1也 可 通 过Wnt 信号通路调节肌生成分化[62]。激活骨骼肌中的卫星细胞有利于肌纤维再生和修复;Bmal1通过扩增卫星细胞的数目来促进再生[63]。同时,在骨骼肌修复过程中Bmal1是促进肌生成的关键因子,可用于防治肌萎缩[63]。骨骼肌Bmal1-/-小鼠的睡眠量较正常小鼠增多,表明骨骼肌中的Bmal1对睡眠也具有调节作用[64]。由上述得知,Bmal1参与调控、维持骨骼肌正常功能及代谢。
骨骼中也存在多数节律性表达的基因,参与骨骼形成、重塑与骨代谢等过程[65]。昼夜节律参与维持骨质平衡[66]。Bmal1表达异常易引发骨关节炎、骨质疏松症等骨代谢疾病[67]。Bmal1的缺失不仅会抑制骨和软骨的发育,导致骨量低下、骨密度降低,还可促进骨吸收增加患病风险[68-69]。故认为,Bmal1通过生物钟参与调控机体的骨代谢。
骨关节炎是一种骨科常见的退行性病变,主要伴随着软骨退行性病变、滑膜炎等病理特征[70]。昼夜节律紊乱是诱发软骨关节炎的重要因素,与正常软骨相比,具有关节炎的软骨中NR1D1 和BMAL1表达显著降低[71]。小鼠缺失Bmal1后可显著抑制其生长板中软骨细胞增殖,促进细胞凋亡;同时下调软骨细胞中血管内皮生长因子(vascular endothelial growth factor,VEGF)和缺氧诱导因子1α(hypoxia inducible factor 1α,HⅠF-1α)表达,促进骨关节炎等疾病的发展[9]。Bmal1过表达可抑制白介素-6(interleukin-6,ⅠL-6)及细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)磷酸化,进而阻碍骨关节炎发展[72]。此外,Bmal1可通过抑制NF-κB 通路恢复间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的 正 常代谢功能,延缓骨质疏松进程[73]。研究表明,Cry2不仅在上游受STAT3/miR-7-5p 抑制表达,还参与激活CLOCK/BMAL1/P300 通路促进成骨细胞分化,这可能是治疗骨质疏松的潜在分子机制[74]。另有文献报道,生物钟Bmal1、Pers和Rev-erbs等基因可能是防治骨代谢异常的新靶点[75]。因此,生物钟核心基因Bmal1对骨代谢平衡的维持至关重要。
2.3 Bmal1与肝病、糖脂代谢紊乱
代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD),又称为非酒精性脂肪肝病,其发病进程与昼夜紊乱之间存在潜在联系。肝细胞中甘油三酯的大量积聚,容易引发MAFLD[76]。Zhang等[77]首次证明了Bmal1不仅可促进肝脏中的脂质合成酶表达,且可通过维持细胞中mTORC2-Akt的活性来调节脂肪生成。而糖异生是维持肝脏葡萄糖稳态的主要机制之一,Bmal1可与组蛋白去乙酰酶5 (histone deacetylase,HDAC5)相互作用促进肝脏糖异生[78]。此外,Bmal1与酒精性肝病(alcohol liver disease,ALD)也密切相关。研究发现,乙醇喂养肝脏Bmal1-/-小鼠,会导致其出现严重的肝脂肪变性和损伤[79]。因此表明,肝细胞中的时钟蛋白BMAL1对保护小鼠免受ALD也具有重要作用。由上述得知,Bmal1参与维持肝脏稳态。
糖脂代谢紊乱通常也伴随着Bmal1的异常表达。Bmal1不仅是生物钟的核心基因,还是调节脂肪生成的重要因子[80]。研究发现,利用环境照明中断小鼠的昼夜节律进行6个月干预后,会引起小鼠脂肪细胞肥大及脂肪组织的炎症与纤维化[81],这可能与昼夜紊乱及小鼠胰岛素信号受损有关。此外,Bmal1在葡萄糖代谢及胰岛素分泌过程中也发挥关键作用。2型糖尿病的发病进程中,通常伴随着胰腺β 细胞的功能障碍[82]。Ye 等[83]研究发现,Bmal1的缺失可能通过影响线粒体信号通路导致胰腺β 细胞功能受损,进而加速糖尿病的发病进程。相反,增加β细胞中Bmal1的表达,则有利于抵御肥胖诱导的葡萄糖不耐受,以免β细胞出现功能障碍[84]。由此得知,β细胞发挥正常细胞功能维持葡萄糖稳态,可能是依赖于Bmal1的表达与调节。胰岛中也存在着由时钟转录因子Clock和Bmal1等组成的自主外周时钟[85]。Bmal1突变小鼠中胰岛基因振荡延迟且胰岛素分泌减少,可导致胰腺时钟功能异常进而增加糖尿病患病风险[8]。CBK 小鼠在Bmal1缺失下,不仅心功能下降,还会出现全身性胰岛素抵抗[86]。由此推测,Bmal1参与调控、维持糖脂的正常代谢过程。
2.4 Bmal1与神经退行性疾病
机体生物钟紊乱是衰老及阿尔茨海默病(Alzheimer’s disease,AD)、帕金森病(Parkinson’s disease,PD)等神经退行性疾病中的常见症状[87]。
AD 的典型病理性改变是β 淀粉样蛋白(amyloid β protein,Aβ)沉积形成的神经炎性斑块和Tau 蛋白过度磷酸化形成的神经纤维缠结(neurofibrillary tangles,NFTs)[88]。β 淀粉样蛋白的累积不仅可使细胞内ROS 增加,还会引起昼夜节律的紊乱[89]。向大鼠侧脑室注射β 淀粉样蛋白构建AD模型,会导致时钟基因的每日节律发生相移变化,这可能是通过影响BMAL1∶CLOCK 异二聚体的形成,进而影响生物钟所介导的抗氧化酶转录调节,以参与调控大鼠海马脑区的氧化应激状态[89]。另有文献报道,静脉注射β 淀粉样蛋白可使大鼠颞叶皮层Bmal1和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)的每日表达节律发生相移[90],影响AD 患者的学习与记忆能力。同时AD的病理变化与大脑ANK1、BⅠN1等位点DNA 甲基化的早期变化密切相关[91]。Cronin 等[92]研究发现,DNA 甲基化可调节Bmal1的表达节律,当甲基化出现异常变化时,Bmal1的表达与昼夜节律便会随之改变,加速AD 发病进程。此外,Bmal1还可协同调节星形胶质细胞增生,当星形胶质细胞Bmal1-/-时,会引发星形胶质细胞活化和炎性因子表达导致体外神经元发生死亡,从而促进神经退行性疾病的发展[93]。由此得知,Bmal1与阿尔茨海默病的发病进程关系密切。
PD 作为一种常见的神经退行性疾病,其患者通常具有睡眠障碍的症状[94]。多巴胺的稳态失调是导致PD患者睡眠质量低下的主要原因[95]。研究发现,BMAL1-CLOCK 系统的紊乱可破坏多巴胺的昼夜振荡[96],提示PD中的多巴胺失调与昼夜节律密切相关。同时,PD 与昼夜节律紊乱和氧化应激之间存在重要联系[87,97]。当昼夜节律失调,可通过Sirt1降低Bmal1乙酰化,使PD患者出现抗氧化功能障碍[98]。另有文献报道,Bmal1缺失可加剧小鼠体内外的炎症反应、多巴胺递质减少及PD运动障碍[99],表明Bmal1可能参与调节小胶质细胞介导的脑内神经炎症以及维持多巴胺的正常功能。此外,Bmal1水平与PD 严重程度呈正相关[100],为监控疾病进展提供了一定的依据。综上,Bmal1可能在预防与治疗神经退行性疾病方面具有重要意义。
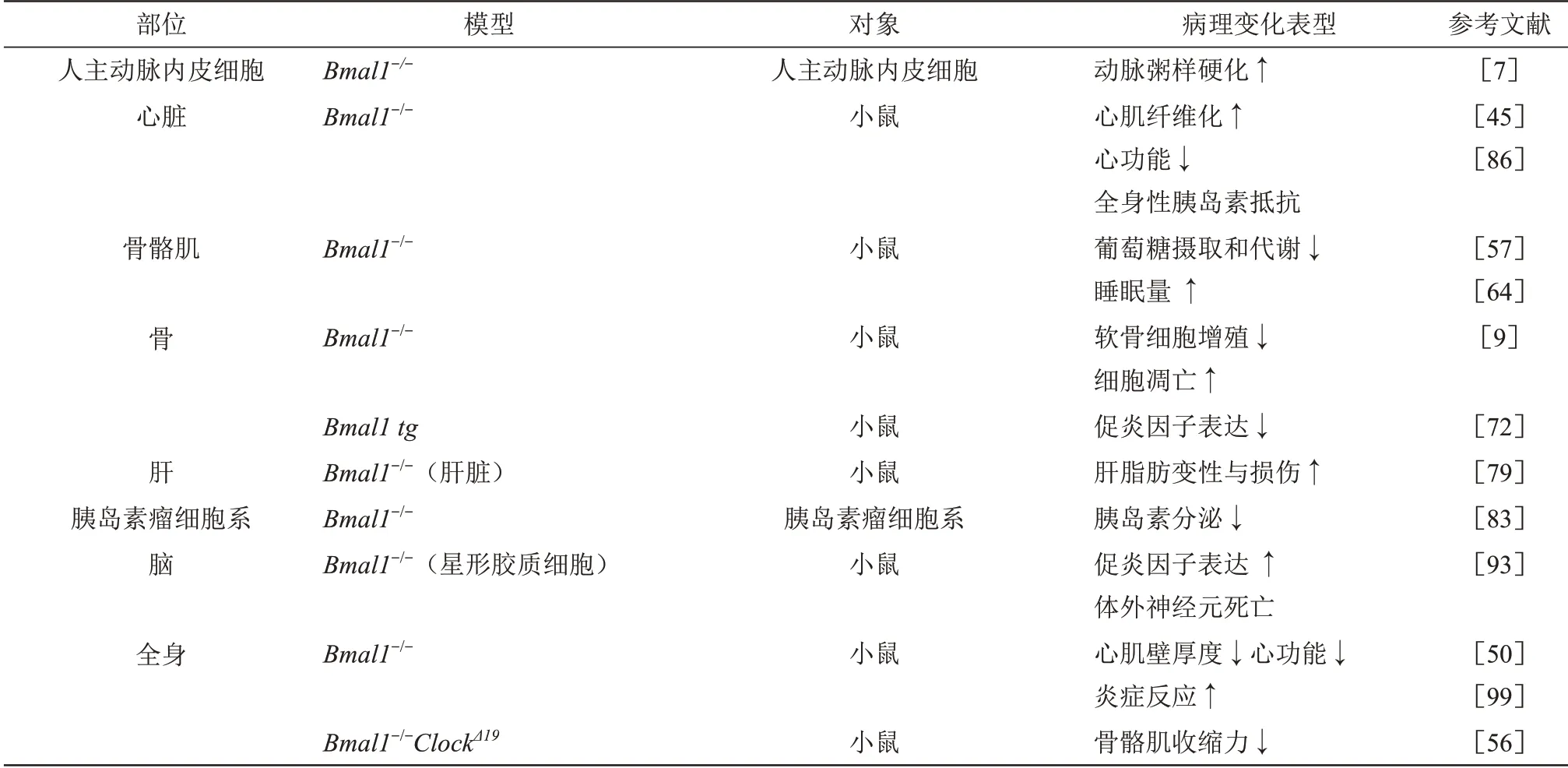
Table 1 Phenotypes of different organs and tissues function changes after the core clock gene Bmal1 deletion/overexpression表1 核心时钟基因Bmal1缺失/过表达后不同器官组织的病理变化表型
3 Bmal1与运动干预研究进展
Bmal1作为生物钟的核心基因,可通过在多器官组织中发挥生物学效应,参与调节机体的生理活动[17]。由上述可知,Bmal1与多种慢性代谢性疾病密切相关。运动作为一种非药物治疗手段可调控机体昼夜节律以调节各系统的生理活动,从而预防与减缓多种代谢性疾病的发病进程[101]。在此通过梳理文献,对Bmal1表达与运动方式、运动负荷之间的关系进行阐述,并提出Bmal1在运动改善慢性代谢性疾病中的可能分子机制。
3.1 不同运动方式对Bmal1表达的影响
临床研究发现,采用12 周跑台运动后肥胖成年人股外侧肌中BMAL1蛋白表达增加,进而可改善胰岛素敏感性,延缓糖尿病等疾病的发展[60]。成年男性在70%VO2max强度的自行车运动70 min后4 h和8 h,其股外侧肌Bmal1基因的mRNA表达明显上调,Per基因的mRNA 表达则显著下降[102]。Zambon 等[103]研究显示,受试者经45 min 单腿抗阻运动后6 h 和18 h,股四头肌内Bmal1、Cry1、Per2基因的mRNA 水平显著升高,同时糖代谢相关基因表达改变。由此表明,有氧运动与抗阻运动均可直接调节人体骨骼肌Bmal1表达。
动物实验发现,小鼠进行4周转轮运动后肝脏中Bmal1基因表达节律提前,其mRNA水平呈阶段性显著升高,参与调控肝脂代谢;骨骼肌中的Per1、Per2基因的峰值表达水平显著升高[104]。高脂喂养的小鼠进行自主转轮运动后骨骼肌中BMAL1 和CLOCK 的蛋白质含量增加,通过参与维持其能量代谢稳态,减缓小鼠肥胖发展[105]。另有研究报道,与年轻雌性小鼠相比,老年雌性小鼠肾脏中Bmal1基因mRNA水平较低;经2周自主转轮运动后老年雌性小鼠肾脏中Bmal1基因mRNA表达显著增加,有助于改善衰老进程中外周组织生物钟的紊乱,提高肾功能,延缓衰老进程[106]。
由此得知,有氧运动和抗阻运动均可上调不同组织器官Bmal1表达(表2)。
3.2 不同运动负荷对Bmal1表达的影响
不同运动强度会影响Bmal1表达。研究发现,以80% 1RM(one-repetition maximum)进行急性抗阻运动30~45 min 后,成人受试者骨骼肌中Bmal1表达显著上升[103]。但以67% 1RM 进行1 h急性抗阻运动后,成人受试者骨骼肌Bmal1前后表达无显著变化[107]。由此表明,以同一种运动方式干预,采用适宜的运动强度,才可上调Bmal1表达。

Table 2 Effects of different exercise modes on Bmal1 expression in different organs and tissues表2 不同运动方式对不同器官组织Bmal1表达的影响
此外,在不同的时间进行运动干预,对Bmal1的表达影响不同。成年男性以60%VO2max在上、下午各进行1 h 功率自行车运动,其血液中Bmal1表达水平均增加,且上午运动后Bmal1表达峰值期提前,下午运动使其延后[108]。动物实验发现,小鼠在黑暗条件下进行一次急性跑台运动后,其骨骼肌中Bmal1和Clock的表达节律减弱;而在光照条件下进行跑台运动,Bmal1和Clock的表达节律增强[109]。小鼠经7 周跑台运动干预后增加海马神经生成及突触可塑性相关蛋白质的表达,提高了短期记忆与空间学习能力,同时发现小鼠在白天或晚上锻炼后的效果较凌晨好[110],而海马发挥正常记忆功能依赖于Bmal1[111],推测运动对小鼠记忆力的改善效果可能与Bmal1等时钟基因的表达变化有关。因此,不同时间段的运动干预可造成Bmal1表达的差异性变化。
3.3 Bmal1在运动改善慢性代谢性疾病中的潜在机制
适宜的有氧运动可显著上调Bmal1表达,调节昼夜节律紊乱,减缓慢性代谢性疾病发病进程;抗阻运动对Bmal1表达的影响目前研究较少。但有关运动通过上调Bmal1的表达,改善代谢性疾病的分子机制尚不明确。通过文献梳理,旨在为深入探讨Bmal1在运动干预改善慢性代谢性疾病中的作用及其潜在机制提供新思路。
Bmal1通过减轻炎症和氧化应激改善代谢性疾病。昼夜节律紊乱可导致代谢性疾病的发生,且通常伴随炎性因子的表达增加[112]。研究表明,Bmal1具有一定的抗炎作用[113]。Bmal1可直接与启动子E 盒结合来控制核因子E2 相关因子2(nuclear factor-erythroid 2-reated factor 2, Nrf2)mRNA 的表达,以抑制白介素-1β(interleukin-1β,ⅠL-1β)和ⅠL-6 等炎性因子表达、促进抗氧化[114]。BMAL1/CLOCK 为代表组成的生物钟反馈环路失调可降低NAD 水平和Sirt1 脱乙酰酶活性,激活NF-κB,加重炎症并诱导线粒体损伤[115]。昼夜紊乱会导致Bmal1-/-小鼠心脏、肾脏等器官中ROS水平增加,并加速衰老进程[116]。Bmal1下调可促进Clock基因释放,使p65 磷酸化,进一步增强NF-κB 信号通路,促进氧化应激[117]。由此推测,运动通过上调Bmal1的表达减轻炎症反应,并抑制氧化应激,这可能是运动通过Bmal1改善慢性代谢性疾病的潜在机制之一。
Bmal1通过调控自噬改善代谢性疾病。自噬是一个循环利用细胞中细胞质成分进行组织重塑,并清除相应非功能性细胞器的过程。代谢性疾病的发生发展过程中通常伴随昼夜节律紊乱,机体可通过调节自噬发挥保护效应,维持正常生理活动[118]。研究表明,Bma1可通过抑制mTORC1活性来诱导自噬,以免高血糖条件下的心肌细胞受损[54]。糖尿病大鼠心肌缺血/再灌注后自噬显著减弱,可通过抑制心肌中HDAC3 表达或激活SⅠRT1 表达来上调BMAL1蛋白水平,以增强自噬进而减轻心肌细胞损伤[119]。此外,抑制HDAC3 和REV-ERBα 两者的表达,可协同上调Bmal1表达来增加线粒体自噬以缓解高糖诱导的心肌损伤[120]。另有研究发现,抑制HDAC3 表达可能通过上调Bmal1减轻氧化应激与细胞凋亡,增强自噬,进而缓解脑缺血损伤[121]。由此得知,运动可能通过上调Bmal1表达来调控自噬以改善慢性代谢性疾病。
Bmal1通过维持线粒体质量与正常功能改善代谢性疾病。Bmal1敲除可直接降低促凋亡调节蛋白3(BCL2/adenovirus E1B 19kDa interacting protein 3,BNⅠP3)蛋白水平,导致线粒体自噬受损及功能障碍、心肌细胞功能异常[122]。心脏Bmal1-/-小鼠的心脏线粒体会出现形态和功能的异常变化,且随着年龄的增长可发展为渐进性心力衰竭,PGC-1α、线粒体融合蛋白1(mitofusin-1,Mfn1)、视神经萎缩蛋白1(optic atrophy protein-1,OPA1)等控制线粒体生物发生与质量的基因表达显著减少[123]。PGC-1α 不仅是哺乳动物生物钟和能量代谢的关键基因,在肝脏和骨骼肌中有节律性地表达,还可通过激活RORα 可刺激BMAL1 和REVERBα表达[124]。肝脏Bmal1-/-小鼠的线粒体会出现肿胀,并伴有氧化应激损伤和胰岛素抵抗[125]。而在糖尿病发病过程中,β 细胞中Bmal1缺失可降低Mfn1 和Mfn2 表达,增加线粒体分裂蛋白1(fission 1,Fis1)的表达,导致线粒体出现功能障碍而增加患病风险[83]。此外,耐力训练可提高ClockΔ19小鼠骨骼肌的PGC-1α蛋白表达和线粒体含量,提高其运动耐力并促进骨骼肌线粒体生成[126]。由此得知,运动可能通过上调Bmal1表达参与调控维持线粒体质量与正常功能,以改善慢性代谢性疾病。
Bmal1通过刺激多器官分泌细胞因子,包括成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)、胰岛素样生长因子1(insulin-like growth factor 1,ⅠGF-1)、BDNF 等,参与改善代谢性疾病。运动刺激多器官分泌细胞因子,经循环系统发挥远隔器官保护效应[127],这些细胞因子统称为运动因子(exerkine)。黄连素通过上调Bmal1刺激脂肪组织中FGF21 的表达,以减缓饮食诱导的肥胖与 糖 尿 病 发 展[128]。ⅠGF-1 作 为 一 种 授 时 因 子(zeitgeber),可直接影响下丘脑Bmal1的表达[129]。研究表明,ⅠGF-1 可通过PⅠ3K/GSK-3β 信号通路激活并增强下丘脑细胞Bmal1启动子活性[130]。而Bmal1缺失会导致生长激素轴的中断,从而影响血清和肝脏ⅠGF-1 的正常表达[131]。上述研究提示,Bmal1与ⅠGF-1 之间存在反馈调节。此外,茶多酚作为一种抗氧化剂,通过介导Bmal1的表达可显著抑制神经元细胞的氧化应激改善线粒体损伤,同时Bmal1还参与茶多酚所刺激的Nrf2/ARE/HO-1 和AKT/CREB/BDNF 信号通路,进而缓解神经退行性疾病[132]。由此推测,运动可能通过上调Bmal1表达刺激多器官分泌运动因子,改善代谢性疾病。
Bmal1受到miRNAs 调控改善慢性代谢性疾病。研究显示,miRNAs 是生物钟重要的调节器[133]。miR-142-3p 可直接靶向抑制Bmal1表达,其自身表达又受到CLOCK/BMAL1 异源二聚体的正向调控[134],推测miRNAs 可能和生物钟基因形成潜在负反馈环。miR-155 通过靶向抑制Bmal1的表达,促进动脉粥样硬化发病进程;增加Bmal1的表达则可阻碍该过程[40]。由此推测,运动可能通过miRNAs调节Bmal1的表达,从而延缓代谢性疾病发病进程。
综上表明,运动激活内源性Bmal1表达,通过刺激多器官细胞因子的分泌及miRNAs表达、减轻炎症和氧化应激、调控细胞及线粒体自噬,以及维持线粒体质量与正常功能等潜在机制,从而改善慢性代谢性疾病(图2)。

Fig.2 Potential mechanism of Bmal1-mediated exercise in improving chronic metabolic diseases图2 Bmal1在运动改善慢性代谢性疾病中的潜在机制
4 结 语
Bmal1作为生物钟的核心基因,对机体生理活动调节起着关键作用,参与机体生长、发育和代谢等过程,并与多种慢性代谢性疾病密切相关。近年来,利用生物钟防治慢性代谢性疾病已得到广泛关注。运动训练、膳食和生物钟相结合的综合干预对机体代谢调节产生积极作用,但单因素的运动干预对生物钟核心基因Bmal1的影响研究尚少,且运动干预对外周器官组织生物钟调控的分子机制尚未明确。运动作为疾病防治的非药物性手段,可调节Bmal1表达,两者的有机结合有望成为防治与改善慢性代谢性疾病的新靶点,其作用机制仍有待进一步的探讨。
