响应面法优化油橄榄叶总酚溶剂浸提工艺
2022-03-30王碧霞黄婷钰周君林
王碧霞,黄婷钰,周君林
(西华师范大学 环境科学与工程学院,四川 南充 637009)
油橄榄(Oleaeuropaea)又名洋橄榄、齐墩果,为木犀科(Oleaceae)常绿乔木,与油茶、油棕、椰子并称为世界四大木本油料植物,其鲜果含油率为30%左右,素有“食用植物油皇后”的美称[1]。油橄榄因具有油果两用而被全世界广泛栽培,中国于1964年开始引种,目前已分布在四川、甘肃、贵州、云南等12个省市,面积约8×104hm2[2]。随着我国油橄榄产业的快速发展,产生大量油橄榄叶,每年修枝剪叶累积的叶子多达6×105t[3-4],因缺乏油橄榄叶的利用渠道,叶子被直接丢弃或焚烧,造成巨大的资源浪费,引发严重的环境污染和生态恶化[5]。
油橄榄叶在地中海地区用于民间医药已有数千年历史,能直接用于治疗退烧、疟疾、痛风、动脉粥样硬化、风湿病、瘫痪、腹部绞痛和糖尿病等疾病,被写入《欧洲药典》[6-7]。油橄榄叶潜在的药理作用引起了学者的极大关注,如Romani等[8]发现油橄榄叶中含有丰富的酚类化合物,主要为黄酮类、酚醇类、酚酸类、裂环烯醚萜类等;还有研究发现,油橄榄叶富含多酚、黄酮、萜类、有机酸、蛋白质、矿物质等诸多对人和动物有益的活性物质,比橄榄油高出100倍[9],但大多数研究都将油橄榄叶的健康益处归因于其主要含有的酚类成分[6,8,10]。国外对油橄榄叶的研究已较深入,研究区域主要集中在欧洲和地中海地区等主产国,而国内相对滞后,仅关注在橄榄油加工、良种选育和集约栽培等方面[11-12],对油橄榄叶提取加工的关注甚少。
目前,国内利用油橄榄叶进行活性成分提取并制备提取物时,大多采用简单水提或醇提后直接喷雾干燥,其提取物中酚类活性成分含量低[13]。每种植物材料都具有其独特的特性,提取得率能否提高不仅受热稳定性、pH、溶剂类型等参数的影响,还与温度和萃取时间等因素有关[14]。有资料显示,油橄榄叶提取时料液比通常浮动在10%~50%干重(DW)范围内,增加固液比获得的油橄榄叶总酚(TP)得率更高[15]。还有研究为缩短提取过程,专注于减少提取时间(从24 h到15 min),探讨了使用功率超声改善橄榄叶酚类提取的可行性,发现减少时间并不改变提取物成分[16]。我国在提取和纯化方面尚缺乏高效率、低成本的技术工艺,大量提取、工厂化生产、产业化发展还存在技术瓶颈。响应面优化(RSM)自从Box and Wilson[17]第一次成功运用后,已普遍应用于许多植物化学物质的优化提取,Box-Behnken Design (BBD)设计因其因素水平少、试验次数少的优点近年来在食品工业中得到较大关注[18]。本研究为提高油橄榄叶TP得率,运用环保、高效及操作简便的溶剂浸提技术,在单因素基础上采用BBD模型设计优化提取参数,建立最佳提取工艺条件。
1 材料与方法
1.1 材料与试剂
油橄榄叶于2019年9月采自四川凉山州西昌市北河油橄榄种植基地,品种为白橄榄。蒸馏水冲洗,干燥,粉碎后,4 ℃冰箱保存备用。没食子酸标准品购于上海硕光科技公司,无水乙醇、碳酸钠和福林酚试剂均为分析纯,购于成都科龙化学试剂有限公司。
1.2 试验方法
1.2.1 油橄榄叶中TP的提取
准确称取油橄榄叶粉末1 g,加乙醇溶剂浸提,4 000 r·min-1离心10 min,收集上清液后定容。
1.2.2 油橄榄叶中TP的测定
采用福林酚显色法测定TP得率[19]。取油橄榄叶提取液0.1 mL于10 mL容量瓶,加0.25 mL福林酚试剂,再加入1 mL Na2CO3(7%),用去离子水(Milli-Q Plus System)定容至10 mL,摇匀避光,室温静置90 min,于760 nm检测吸光值。以分析纯没食子酸(98%)为标准品,x为没食子酸质量浓度(μg·mL-1),y为吸光度值,绘制标准曲线,所得回归方程为y=4.4449x-0.0889(R2=0.9979)。在没食子酸0.05~0.20 μg·mL-1浓度范围内,质量浓度与吸光度呈良好的线性关系。取一定量稀释后的油橄榄叶提取液,根据没食子酸标准方程计算出样品TP浓度,TP得率(Y)计算公式为:Y(%)=(C×V×N)/(n×1 000)×100,式中:W为样品液中TP质量浓度;V为样品液体积;N为稀释倍数;n为初始油橄榄叶质量。
1.2.3 单因素试验
以TP得率为指标,运用传统的溶剂浸提法,分别考察4个影响因素。提取温度:40、50、60、70、80 ℃(乙醇浓度80%,时间30 min,料液比1∶30 g·mL-1);乙醇浓度:50%、60%、70%、80%、90%(提取温度70 ℃,时间30 min,料液比1∶30);提取时间:20、30、40、50、60 min(提取温度70 ℃,乙醇浓度80%,料液比1∶30);料液比:1∶10、1∶20、1∶30、1∶40、1∶50(提取温度70 ℃,乙醇浓度80%,时间30 min)。
1.2.4 响应面优化试验
在单因素试验结果的基础上,采用Design-Expert 8.0软件设计试验条件,选用BBD模型,以油橄榄叶TP得率为响应值,提取温度、料液比、提取时间和乙醇浓度为自变量(表1)。

表1 影响因素水平编码表
1.2.5 模型的验证
分别对影响因素进行多元二次回归分析,获得TP的最佳提取条件。在最佳条件下,重复3次试验。分析实测值和模型预测值有无统计学差异。
1.3 数据处理
采用Microsoft Excel 2010和SPSS 19.0统计分析数据。所有试验均重复3次,数据以平均值±标准差表示。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 乙醇浓度对TP得率的影响
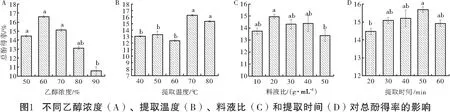
从图1A可知,在50%~60%乙醇浓度条件下,油橄榄叶TP得率随着乙醇浓度的升高而升高,在60%乙醇浓度时最大,超过60%得率逐渐降低。因此,选择乙醇浓度为50%、60%、70%进行响应面分析。
2.1.2 提取温度对TP得率的影响
从图1B可以看出,温度在40~60 ℃时,TP得率没有显著变化,当温度升高到70 ℃时,TP得率显著增加并达到最大值16.28%,当温度继续升高至80 ℃时,得率却下降为15.36%。这可能是因为提取温度升高,物质溶解度增加;同时,粘度和表面张力溶剂在较高温度下会降低,这有助于溶剂到达样品,提高提取得率。然而,许多酚类化合物易于水解和氧化,较长的萃取时间和高温会增加酚类物质的氧化并降低提取物中酚类物质的得率。因此,选择提取温度分别为60、70、80 ℃进行响应面分析。
2.1.3 料液比对TP得率的影响
从图1C可知,料液比从1∶10增加到1∶20时,TP得率升高,并达到最高值14.96%,但当增加到1∶30 和1∶40时,得率却逐渐下降。由于料液比在1∶10、1∶20、1∶30、1∶40时,TP得率没有显著差异,如果有机溶剂与水的比例过小为1∶10时,提取过程中液相浓度高,两相间的浓度差减少更快,不利于提取得率的稳定。因此,选择料液比1∶20、1∶30、1∶40进行响应面分析。
2.1.4 提取时间对TP得率的影响
从图1D可以看出,提取时间从20 min 延长到50 min时,TP得率持续上升,在50 min时达到最大值15.70%,当提取时间继续延长到60 min时,TP得率下降。这表明提取时间过长可能引起部分酚类成分降解,从而导致TP得率降低,且过长的浸提时间也会增加提取成本。因此,进行响应面分析时提取时间选择40、50、60 min。
2.2 响应面优化
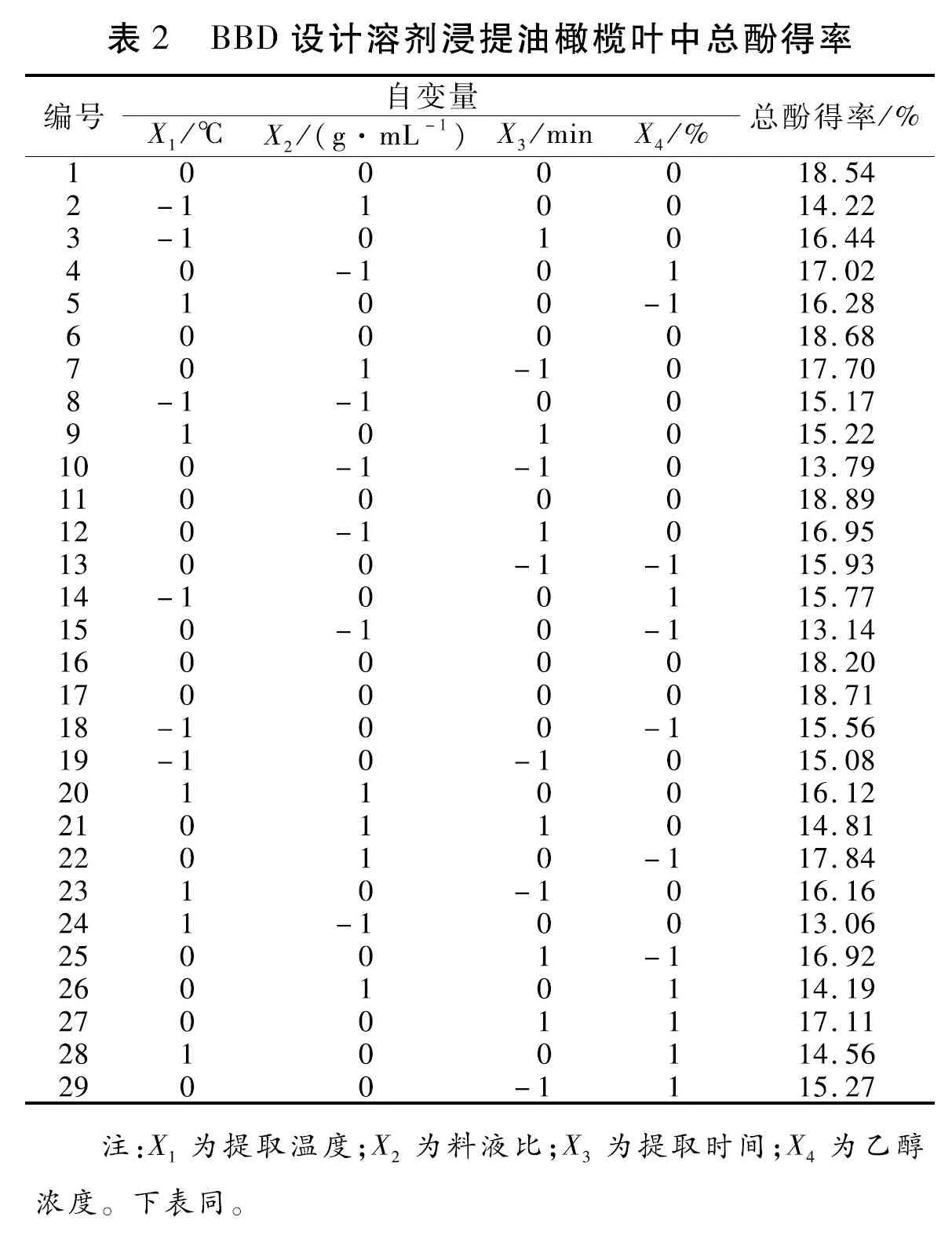
2.2.1 Box-Behnken设计试验结果
采用Design-Expert 10软件进行试验条件设计,根据BBD模型,测定了29种组合所对应的TP得率(表2)。对结果进行多元线性回归拟合,得到油橄榄叶TP得率(Y)对提取温度(X1)、料液比(X2)、提取时间(X3)、乙醇浓度(X4)的二次多项回归方程模型:Y=18.60-0.07X1+0.48X2+0.29X3-0.15X4+1.00X1X2-0.57X1X3-0.48X1X4-1.51X2X3-1.88X2X4+0.21X3X4-1.95X12-1.90X22-0.97X32-1.20X42。
2.2.2 响应面回归模型的方差分析
为了检验回归方程的有效性,以确定各因素对油橄榄叶TP得率的影响程度,对该模型进行了方差分析(表3)。该模型的P<0.0001,失拟项(P=0.1992)不显著,说明该模型的拟合度高。同时,模型的相关系数R2=0.9762(>0.75),说明模型准确性较高[20]。校正决定系数Adj.R2=0.9523,表明由提取温度(X1)、料液比(X2)、提取时间(X3)及乙醇浓度(X4)的变化引起响应值95.23%的变化;且PredR2表示回归模型在预测新观察值时的准确程度,Pred.R2为0.8767,表示该模型可预测87.67%的新观察值。在该模型中,变异系数为2.28%,这说明试验的精度高,可靠性强[21]。此外,信噪比为20.455,表示该回归模型具有较好的拟合度和稳定性。综上所述,该模型可以优化溶剂浸提油橄榄叶中TP得率。
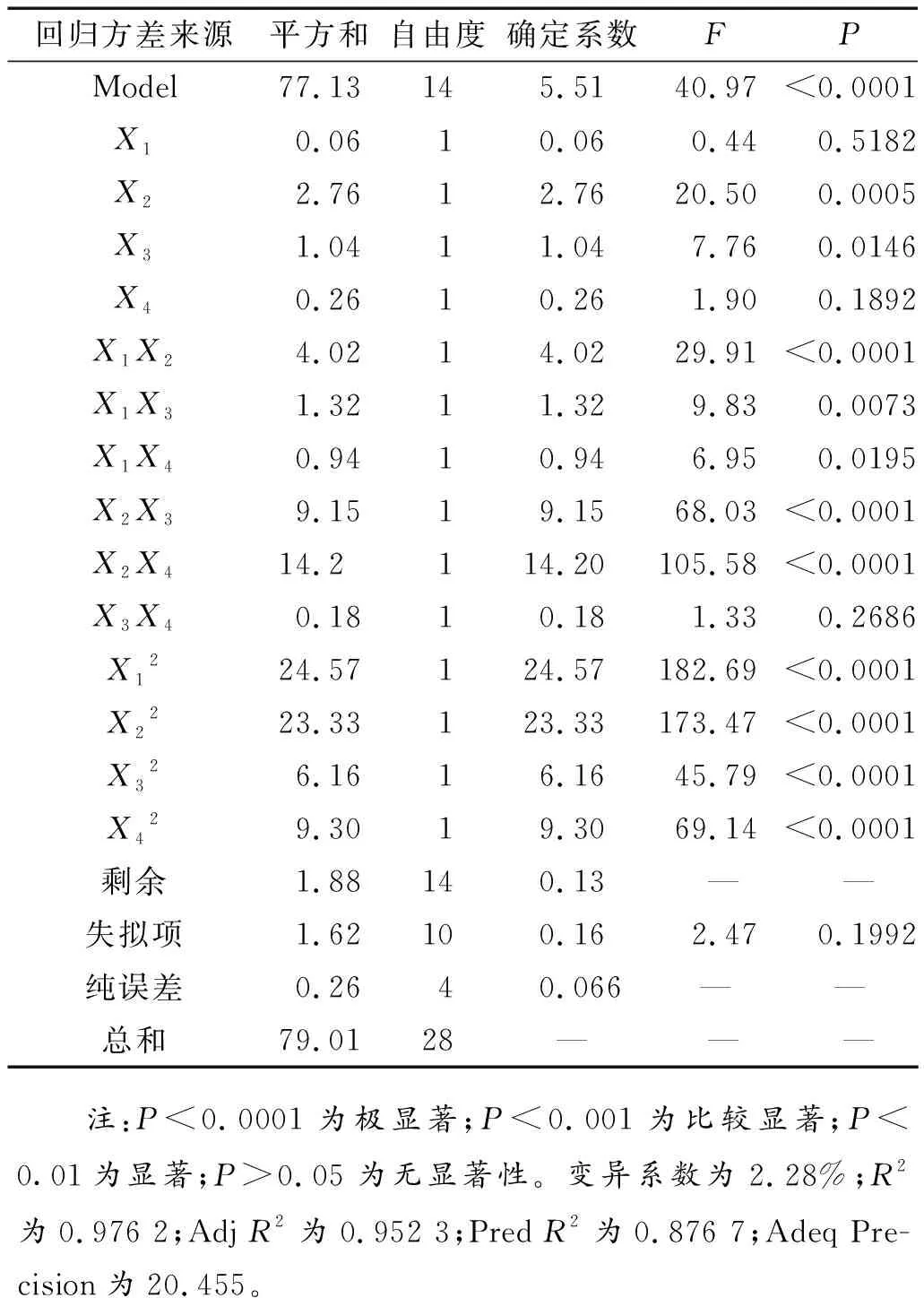
表3 溶剂浸提总酚得率响应面回归模型方差分析
另外,从表3可得,一次项X2较为显著(P<0.001),交互项X1X2、X2X3和X2X4均极显著(P<0.0001),二次项X12、X22、X32、X42也极为显著(P<0.0001),这些结果表明它们显著影响油橄榄叶TP得率。同时,一次项X3与交互项X1X3、X1X4显著(P<0.01)。但一次项X1、X4与交互项X3X4却不显著,这表明各影响因素与油橄榄叶TP得率之间的关系并非是简单的线性关系。这说明4个影响因素中,料液比(X2)对油橄榄叶TP得率影响最大,提取时间(X3)次之。
2.2.3 响应面分析
响应面的3D图和等高线图能够直观反应出响应值是否对该因素的变化反应敏感,越陡峭对响应值的影响越大,反之较小[22]。图2A直观反映了在提取时间为50 min和乙醇浓度为60%的固定条件下,提取温度和料液比(X1X2)对TP得率具有显著影响;当X1从60 ℃升高到70 ℃,X2从1∶20递增到1∶35时,TP得率从15.41%上升到16.16%。图2B和C也显示出随着提取温度的升高,提取时间在40~55 min和乙醇浓度在50%~70%内逐渐增加时,TP得率持续增加,而继续增加提取时间和乙醇浓度时,TP得率却没有显著增加。从图2D可以看出,料液比和提取时间(X2X3)从1∶20和40 min分别递增到1∶35和60 min时,TP得率从13.50%增加到17.07%。同样,图2E也反映出料液比和乙醇浓度(X2X4)的交互作用对TP的影响也极为显著。当料液比和乙醇浓度从1∶20和50%分别递增到1∶35和65%时,TP得率从13.43%增加到18.26%,并在1∶35 和70%乙醇浓度时,得率达到峰值。然而,提取时间和乙醇浓度(X3X4)交互作用时,却对TP得率没有显著影响(图2F)。这些分析结果也与方差分析结果相吻合(表3)。
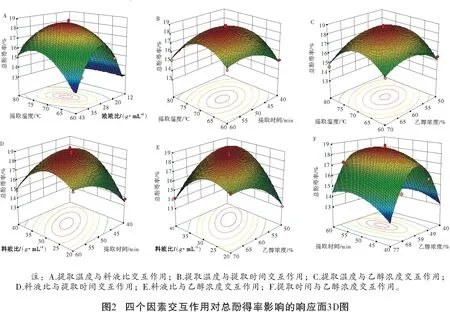
等高线图的形状有圆形和椭圆形,椭圆形表示两因素交互作用显著,圆形则不显著[23]。根据拟合函数,每两个影响因子对应的响应值画出等高线图(图3)。当提取温度在60~80 ℃范围时,分别与料液比、提取时间、乙醇浓度的交互作用对TP得率的影响见图3中A、B和C。同样,当料液比在1∶20~1∶35范围时,分别与提取时间、乙醇浓度的交互作用对TP得率的影响见图3D和E,其图形均呈现出明显的椭圆形,这表明X1X2、X2X3、X1X4、X2X3、X2X4的交互作用显著影响了TP得率。然而,提取时间与乙醇浓度(X3X4)的等高图为圆形(图3F),这表明二者的交互作用对TP得率没有显著影响。

2.2.4 模型验证
根据试验所建立的模型,预测提取油橄榄叶TP的最佳条件为:提取温度74.95 ℃,料液比1∶40 g·mL-1,乙醇浓度50%,提取时间41.19 min,此条件下TP得率为18.60%。为实际操作的可行性和方便性,将此优化的工艺条件调整为:提取温度75 ℃、乙醇浓度50%、料液比1∶40 g·mL-1、提取时间40 min,此条件下TP实际平均得率为18.98%±2.00%(n=3),与预测值的相对误差较小。这表明响应面法成功运用于优化油橄榄叶TP的溶剂浸提工艺,其提取条件较为可靠,具有一定的实用价值。
3 讨 论
溶剂浸提法在实际生产中是提取活性成分最传统的方法之一,因操作简单,其应用范围较为广泛[24-25]。该浸提方法利用相似相溶原理提取材料酚类成分,其提取效率受溶剂类型、固液两相的接触面积、相对运动、提取温度、pH等因素的影响。选择合适的溶剂会影响提取的酚类成分及其含量,乙醇是TP提取的一种良好溶剂,对人类健康较为安全[26-28]。在本研究中,由于油橄榄叶中酚类物质大都含有多个羟基,有很强的极性,乙醇极性也较强,是能与水互溶的有机溶剂,因此在选择溶剂时主要以亲水性溶剂乙醇作为提取试剂。
本研究运用溶剂浸提法从油橄榄叶中提取TP,在提取温度75 ℃、乙醇浓度50%、料液比1∶40 g·mL-1、提取时间40 min的最佳提取条件下,TP实际平均得率为18.98%。饶瑜等[25]采用乙醇溶剂浸提广元地区油橄榄叶多酚物质,其橄榄叶多酚得率为57.22 mg·g-1,其最佳工艺条件为乙醇浓度60%、浸提时间1.75 h、料液比1∶35 g·mL-1、浸提温度为55 ℃。与他相比,在单因素基础上,运用BBD模型设计试验时,在本工艺条件下提取效率更高,提取时间更短,乙醇浓度也更低。这表明溶剂浸提油橄榄叶TP工艺是可以根据实际生产的需要和具体条件加以运用的提取技术。
