焙烤对宁夏滩羊羊脂水分分布和关键性香气成分的影响
2022-03-30王永瑞罗瑞明王松磊
王永瑞,柏 霜,罗瑞明,王松磊
(1.宁夏大学农学院,宁夏 银川 750021;2.宁夏大学食品与葡萄酒学院,宁夏 银川 750021)
羊肉因其独特的风味、较高的蛋白质、氨基酸、钙、钾等含量以及较低的脂肪和胆固醇含量而倍受欢迎[1]。我国是羊肉生产大国,也是羊肉消费大国,羊肉在居民肉品消费中占据很大比例,因而具有较高的市场经济效益[2]。滩羊是宁夏特色养殖畜种,由于宁夏天然地理环境,造就了滩羊肉质佳、风味好的肉质,深受消费者喜爱[3]。
羊脂作为羊肉的副产物之一,价格明显低于羊肉,但其对羊肉的风味起主要贡献作用。热加工过程可以促进肉类风味物质的形成,目前已鉴定出1 000多种挥发性化合物[4]。肌肉组织在加热时产生肉类共有风味,而脂肪则反应生成特殊风味,因而有研究表明如果从肉中去除脂肪,仅根据肉的感官属性很难区分肉的种类[5]。在热加工过程中,脂质氧化、美拉德反应、Strecker降解反应、脂质与美拉德反应的交互作用以及硫胺素降解等是肉类风味物质产生的主要途径[6]。脂质主要通过其自身的氧化降解生成低分子的醛类、醇类、酮类和酸类等挥发性化合物[7]。这些物质风味阈值极低,一方面对于羊肉风味的呈现具有重要作用;另一方面,脂肪氧化所生成的醛类、酮类和羧酸等含羰基的化合物,在反应过程中作为羊肉风味的前体物质与美拉德反应中间体存在竞争机制,改变原有美拉德反应产物形成途径,从而改善并控制理想风味物质的产生[8]。低场-核磁共振(low fieldnuclear magnetic resonance,LF-NMR)技术具有快速、准确、无损、无侵入等特点[9],广泛应用于食品、农业、石油能源、地质岩矿等领域的研究,可对样品中的水分分布信息和水分迁移规律进行分析[10-15]。
鉴于此,本实验以宁夏滩羊这一宁夏优势物种作为研究对象,运用LF-NMR技术对羊脂烤制过程中水分分布迁移规律进行探究,采用气相色谱-质谱(gaschromatographic mass-spectrometry,GC-MS)结合电子鼻对不同烤制时间的滩羊羊脂挥发性成分进行定性、定量分析,通过主成分分析(principal component analysis,PCA)对肉品挥发性成分的电子鼻传感器响应进行区分,以期为宁夏滩羊羊脂在烤制过程中水分分布及迁移规律提供一定理论基础,也为宁夏滩羊羊脂香气再利用奠定一定基础。
1 材料与方法
1.1 材料与试剂
实验用于烤制的羊脂来源于9 月龄、体质量(30±1)kg盐池公羊羊尾 宁夏鑫海食品有限公司;1,2-二氯苯(邻二氯苯)、C6~C26正构烷烃 美国Sigma-Aldrich公司;甲醇 赛默飞世尔科技有限公司。
1.2 仪器与设备
Qp2010ultra型GC-MS联用仪 日本Shimadzu公司;PK157330-U型手动固相微萃取(solid phase microextraction,SPME)进样器、50/30 µm DVB/CAR/PDMS萃取头 美国Supelco公司;DB-WAX毛细管柱(30 m×0.25 mm,0.25 μm) 美国Agilent公司;PEN 3.5电子鼻 德国Airsence公司;WNB22型精密数显恒温水浴槽 上海树立仪器仪表有限公司;LT202E型电子天平 常熟天量仪器有限责任公司;XW-80A旋涡混合仪 上海嘉鹏科技有限公司;HQ-405型电烤箱 青岛汉尚电器有限公司;NMI20型NMR成像仪 上海纽迈电子有限公司。
1.3 方法
1.3.1 烤羊脂样品的制备
将羊尾洗净,切成1.5 cm×1.5 cm×1.0 cm的小块,放置在垫有锡箔纸的烤盘上,四周保持5 cm间距,然后放入已预热10 min,上、下烤制温度250 ℃的烤箱中烤制。取烤制2、4、6、8、10、12、14、16、18 min和20 min的烤羊脂样品进行分析。
1.3.2 色泽的测定
使用色差计测定亮度值(L*)、红度值(a*)和黄度值(b*),分析烤制过程中羊脂色泽的变化。
1.3.3 NMR波谱的测定
参照Li Xin等[16]的方法,横向弛豫时间(T2)采用CPMG脉冲序列测定:质子共振频率18 MHz;偏移频率382.241 65 kHz;90°和180°脉冲时间分别为16 μs和33 μs;采样点数143 140;重复间隔时间1 500 ms;累加次数16;回波数2 000。扫描束后进行信号反演获得T2反演谱。
1.3.4 烤羊脂样品挥发性成分分析
1.3.4.1 SPME提取挥发性成分
在使用萃取头萃取挥发性物质前,先将50/30 μm DVB/CAR/PDMS SPME萃取头老化。称取(2±0.01)g烤羊脂样品置于15 mL顶空瓶中,向每个样品中加入内标1,2-二氯苯(4 μL、6.42 μg/mL),使用涡旋仪混匀,用聚四氟乙烯隔膜将顶空瓶口密封,于55 ℃水浴20 min后将老化后的萃取头插入密封萃取瓶中吸附,保持30 min,然后立即转移到GC进样口,250 ℃解吸5 min。
1.3.4.2 GC-MS条件
GC条件:DB-WAX毛细管柱(30 m×0.25 mm,0.25 μm);程序升温:起始温度40 ℃,保持3 min,然后以5 ℃/min速率升温至90 ℃,再以8 ℃/min速率升温至230 ℃,保持10 min;载气He;恒定流速1.8 mL/min,进样口温度250 ℃。
MS条件:电子电离源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;质量扫描范围m/z20~350;全扫描方式;溶剂延迟3 min。
1.3.4.3 定性与定量分析
挥发性物质经色谱柱分离后,化合物由NIST质谱数据库对比鉴定。根据已知质量浓度的1,2-二氯苯的峰面积,按下式计算样品中各挥发性物含量:

式中:Ax和Ai分别为目标化合物和内标化合物的峰面积;ρi为内标化合物质量浓度/(μg/mL);4为加入内标溶液体积/μL;2为加入样品质量/g;Cx为目标化合物含量/(μg/kg)。
1.3.4.4 电子鼻检测
准确称取2.00 g样品于50 mL电子鼻进样瓶内,用聚四氟乙烯隔膜将瓶口密封。放置于50 ℃水浴锅内保温30 min,然后放置室温平衡30 min。所有样品在12 h内完成检测,以最大程度降低样品之间的其他差异。每个样品平行3 次。电子鼻测定参数:样品准备5 s;检测时间100 s;测量计数1 s;自动调零时间10 s;清洗时间300 s;内部流量400 mL/min;进样流量400 mL/min。
1.4 数据处理
2 结果与分析
2.1 烤制过程中羊脂色泽的变化
如图1所示,羊脂L*随着烤制时间的延长而下降,a*、b*随着烤制时间的延长呈上升趋势,这主要与脂质化合物因高温发生降解反应以及脂质降解产物参与美拉德反应有关。脂质在受热时首先会分解为饱和及不饱和脂肪酸,其中不饱和脂肪酸双键通过自动氧化、光氧化或酶氧化3 种方式生成氢过氧化物,氢过氧化物继续分解产生醛、酮、醇、烃、羧酸、酯、呋喃及内酯等一系列小分子化合物。酮和醛等化合物进一步发生氧化、聚合、焦化等反应也可导致羊肉颜色变深[17]。

图1 不同烤制时间下羊脂色泽的变化Fig. 1 Effect of roasting time on color parameters of mutton tallow
2.2 羊脂烤制过程中水分迁移规律分析
2.2.1 羊脂各组分水分含量的变化
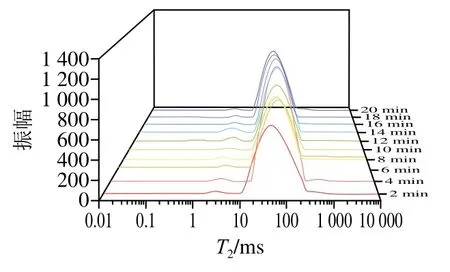
图2 烤制过程中羊脂水分T2分布Fig. 2 Effect of roasting time on T2 distribution of mutton tallow
通过弛豫过程达到平衡状态的时间分别用纵向弛豫时间(T1)和T2表示[18],T2的变化以及对应的峰面积可以用来衡量羊脂中水分的分布和区分不同状态水之间的化学渗透交换[19-20]。如图2所示,羊脂中的水分分为结合水(强结合水和弱结合水)、自由水和不易流动水3 种状态,其中,T21和T22峰(0.01~10 ms)分别代表与脂质、蛋白质等大分子物质结合的强结合水和弱结合水;T23峰(10~100 ms)代表肌原纤维内截留的不易流动水;T24峰(100~1 000 ms)代表肌细胞间存在的自由水[21]。
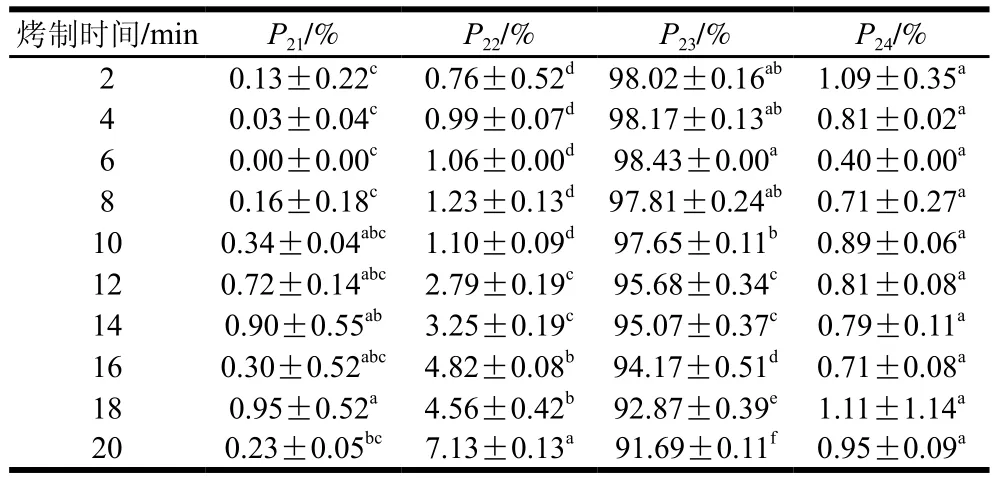
表1 烤制过程中羊脂弛豫特征中不同状态水分含量的变化Table 1 Effect of roasting time on percentages of different moisture states in mutton tallow
利用T2反演图谱中各峰面积积分分析不同状态水分的相对含量,由表1可知,随着烤制时间的延长,羊脂强结合水相对含量没有明显变化规律,而弱结合水相对含量呈增加趋势,这表明在烤制过程中羊脂具有良好的保水性[23]。随着烤制时间的延长,羊脂表层水分损失速率快,表面干燥,减缓羊脂内部水分损失。不易流动水相对含量呈下降趋势,可能是烤制过程中不易流动水转变为自由水。自由水相对含量也无明显变化规律,其原因可能是在烤制过程中,不易流动水和结合水转化自由水的过程与羊肉部分汁液损失互相弥补[24]。
2.2.2 羊脂水分迁移变化分析
T2表征不同状态的水分流动性,T2越大,与大分子结合力越小,水分自由度越大,流动性越强[25]。如表2所示,随着烤制时间的延长,T21和T22变化无明显规律,而T23呈减小趋势,但差异不显著,说明烤制过程中水分子与大分子物质结合更紧密。T24整体呈无规律变化趋势,表明羊脂中水分子的流动性与烤制时间无关。

表2 羊脂T2随烤制时间的变化Table 2 Effect of roasting time on T2 parameters of mutton tallow
2.3 烤制过程中羊脂中挥发性化合物变化
如表3和图3所示,在不同烤制时间的10 份烤羊脂样品中共检出78 种挥发性成分,其中醛类12 种、醇类11 种、酮类9 种、烯烃类4 种、酸类10 种、酯类12 种、杂环类12 种、其他物质8 种。羊脂烤制过程中风味物质复杂。随烤制时间的延长,醛类、醇类、酮类物质总含量呈先增加后降低再增加的趋势,且均在烤制第20分钟时达到最大值。烯烃类物质主要在烤制中期含量较高,酸类物质含量变化无明显规律;酯类物质除2-羟基丙酸甲酯外普遍存在于烤制初期,杂环类化合物则主要存在于烤制末期。其他类物质在烤制末期(18~20 min)总含量明显增加,其中N,N-二甲基乙醇胺和甲苯是其他类物质总含量的主要贡献者。

表3 不同烤制时间羊脂中的挥发性风味化合物Table 3 Volatile flavor compounds in mutton tallow roasted for different periods μg/kg

续表3 μg/kg
醛类物质普遍阈值较低,对气味总体特征具有重要贡献。烤羊脂挥发性物质中,醛类物质主要以己醛、壬醛、癸醛、(E)-2-辛烯醛、辛醛、苯甲醛等含量较高,这些C6~C9醛类物质多数呈脂肪味、水果味和青草味[26-27]。脂肪的氧化、降解及Strecker氨基酸反应是这些醛类物质的主要来源。己醛、辛醛、(E)-2-辛烯醛均来源于亚油酸或亚麻酸的降解产物,主要呈青草味、油脂味[28]。壬醛是油酸氧化产物,具有水果香气。庚醛、2-十一醛、(E,E)-2,4-癸二烯醛以及呋喃醛主要存在于羊脂烤制后期,呈油脂味、苦杏仁味以及烤肉味,主要来源于亚油酸、亚麻酸以及2-呋喃甲醇的氧化裂解。苯甲醛可能来源于苯丙氨酸的降解[29],呈果香、苦杏仁味,能够赋予浓厚的脂香。(E,E)-2,4-庚二烯醛主要呈油脂味,其前体是二十碳五烯酸;(Z)-2-庚烯醛呈烤肉味,是油酸、亚油酸的降解产物。
醇类物质主要来源于脂肪氧化,在烤羊脂样品中检测到的醇类物质多为饱和醇,如戊醇、庚醇、己醇、辛醇。饱和醇的嗅觉阈值较高,因而对烤羊脂的整体风味贡献较小,主要呈清新的花草香气[30]。己醇来源于棕榈酸和油酸的氧化裂解,呈青草味;庚醇是油酸的氧化产物,呈坚果味;戊醇来源于亚油酸的氧化,呈青草味;辛醇来源于油酸的氧化,呈青草味;1-辛烯-3-醇属于不饱和醇,其对烤羊脂的香气贡献较大,可通过15-脂氧合酶催化二十碳五烯酸和12-脂氧合酶催化花生四烯酸形成,主要呈令人愉悦的蘑菇味和青草香[31]。2-呋喃甲醇以及5-甲基-2-(1-甲基乙基)-1-己醇主要存在于羊脂烤制后期,其来源较为复杂,可能为高温条件下酮和醛等化合物聚合生成。
酮类化合物不仅是美拉德反应的产物,也可能是脂肪氧化的结果。赖氨酸、精氨酸、亮氨酸、甲硫氨酸与葡萄糖或果糖的美拉德反应是酮类化合物生成的主要途径。烤羊脂中主要的酮类风味物质有3-羟基-2-丁酮、1-辛烯-3-酮、2,3-辛二酮。3-羟基-2-丁酮可能来自糖原降解[32],也可能是2-乙基乳酸脱羧反应的副产物[33];1-辛烯-3-酮主要来源于1-辛烯-3-醇的氧化;其他酮类物质,如2-甲基-2-环己烯-1-酮、二羟基-5-甲基-2(3H)-呋喃酮、四羟基-2H-吡喃-2-酮、2-吡咯酮以及2-十三烷酮主要存在于羊脂烤制后期,可能通过长时间高温条件下脂肪裂解产物发生聚合、焦化等反应产生。酮类物质具有一定的气味,但酮类物质的嗅觉阈值较醛类物质高,因而对烤羊脂的整体风味贡献较小,主要表现为谷香味、杏仁味以及奶香味。
酸类物质是由脂肪氧化裂解或脂肪水解为低级脂肪酸产生[34],酸类物质由于含量较低,嗅觉阈值相对较高,对烤羊脂整体风味贡献较小。烤羊脂中的酯类物质除2-羟基丙酸甲酯外,其他酯类物质如苯乙酸甲酯、庚酸甲酯、己酸甲酯、4-甲基辛酸甲酯、辛酸甲酯、癸酸甲酯以及苯甲酸甲酯主要存在于烤制初期,蛋白质水解、糖酵解、脂肪氧化以及内源酶作用是酯类化合物形成的重要途径[35]。
烤羊脂中的杂环类化合物分为氮杂环类和氧杂环类化合物,主要来源于美拉德反应、氨基酸和硫胺素的热降解[36]。其中氮杂环化合物主要为吡嗪类、吡咯类以及嘧啶类,主要存在于烤制后期,具有明显的烤香味以及焦糊味。氧杂环类化合物只检测出2-戊基呋喃,具有水果香气,而呋喃类化合物大都具有很强的肉香味,主要由硫胺素降解、焦糖化和碳水化合物降解产生[37-38]。
烷烃类化合物以十二烷和十四烷含量高,但其对烤肉整体风味贡献较小。N,N-二甲基乙醇胺以及丙酰胺主要存在于烤制后期,可能来源于氨基酸降解;甲苯作为一种有害物质主要呈芳香味。
2.4 烤制过程中羊脂中挥发性化合物的电子鼻分析
2.4.1 电子鼻传感器响应信号分析
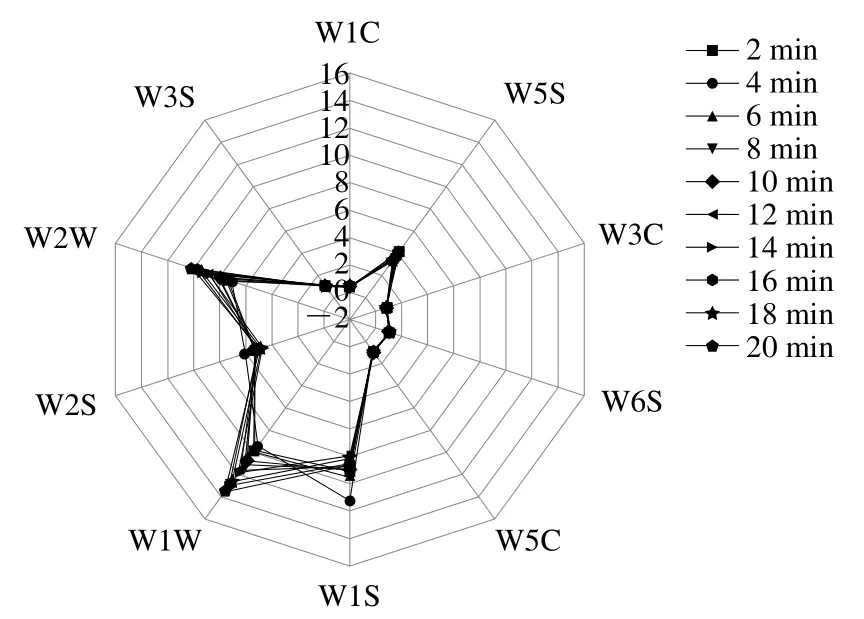
图4 电子鼻对烤羊脂样品响应雷达图Fig. 4 Radar plots of the responses of E-nose sensors to roasted mutton tallow
由图4可知,传感器W5C、W6S、W3C、W5S、W1C和W3S的响应值随着烤制时间的延长几乎无变化,说明烷烃类化合物、氨类化合物以及大部分芳香族化合物含量较低且变化较小。W6S传感器对由脂质氧化产生的氢过氧化物敏感,表明烤羊脂样品中没有氢过氧化物[39]。W5S传感器对氮氧化合物敏感,特别是硝基类化合物,表明烤羊脂样品中的氮氧化合物含量随着烤制时间的延长变化不大。W1W和W2W传感器均对硫化物敏感,随着烤制时间的延长,烤羊脂样品的传感器响应值增大,表明样品中含硫化合物含量呈增加趋势。W1S和W2S的响应值的变化表明醇类化合物随着烤制时间的延长呈降低趋势。
2.4.2 电子鼻数据的PCA
PC贡献率越高,对原始多指标信息反映越好[40]。对烤羊脂电子鼻数据进行PCA,PC1解释总方差的76.00%,PC2解释总方差的14.60%。前2 个PC的累计方差贡献率超过90%,说明前2 个PC覆盖了样品绝大多数气味信息[41]。如图5A所示,在烤制初期(2~8 min)烤羊脂的电子鼻数据PCA二维空间投影主要分布在第2、3象限;烤制后期(12~20 min)烤羊脂主要分布在第1、4象限。表明随着烤制时间的延长,羊脂香气呈现规律过渡。从图5B可以看出,W6S、W3S、W2S以及W1S与烤制4、6 min烤羊脂样品相关,W1C与烤制12 min样品相关,W5C、W3C与烤制16、18 min样品相关,W5S、W2W、W1W与烤制20 min样品相关。结果表明,不同烤制加工阶段对羊脂的氮氧化物、芳香族化合物和有机硫化合物、醇类化合物的影响具有明显差异,对烷烃、氢化物和氨类化合物影响差异不明显。

图5 烤羊脂样品PCA二维得分图(A)和载荷图(B)Fig. 5 PCA score plot (A) and loading plot (B) of roasted mutton tallow
3 结 论
随着烤制时间的延长,羊脂L*下降,a*、b*上升。烤制过程中羊脂弱结合水相对含量呈增加趋势,而不易流动水相对含量呈下降趋势,T23呈明显减小趋势,说明随着烤制进行水分子与大分子物质结合更加紧密。
在不同烤制时间的10 份烤羊脂样品中共检出78 种挥发性成分,其中己醛、壬醛、1-辛烯-3-醇、3-羟基-2-丁酮、月桂烯和甲苯普遍含量较高。酯类物质主要存在于羊脂烤制初期,而杂环类化合物特别是吡嗪类化合物主要存在于烤制后期。电子鼻数据PCA结果表明,不同烤制加工阶段对羊脂的氮氧化物、芳香族化合物和有机硫化合物、醇类硫成分影响显著,对烷烃、氢化物和氨类化合物影响不显著。
