沙门氏菌感染肠上皮细胞外泌体宿主蛋白质组学分析
2022-03-30路娟娥韩文英刘素可阮海华
张 彪,路娟娥,韩文英,刘素可,武 陶,阮海华
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
近年来,随着新型食品生产工艺的应用、人们饮食习惯的改变以及卫生环境的恶化等,食源性疾病的发生率明显增加,食源性疾病已成为影响食品安全的主要问题之一[1]。沙门氏菌属肠杆菌科,革兰氏阴性杆菌,是导致食源性疾病发生的重要致病菌之一[2]。沙门氏菌通过不洁食物或者水源进入人体胃肠道后,可黏附于肠黏膜上皮细胞并迅速增殖,侵入肠道固有层细胞,引起机炎症性腹泻甚至败血症[3]。据统计,法国每年发生的食源性感染病例中,几乎一半是由沙门氏菌引起;在美国,沙门氏菌每年导致约120万 种疾病发生、23 000 例住院治疗和450 例死亡[4]。因此,为维护公共健康和提高食品安全性,研究沙门氏菌感染机制对于降低沙门氏菌危害性及预防沙门氏菌感染至关重要。
外泌体是细胞向外分泌的小型囊泡,几乎能被所有的细胞分泌,尺寸在30~150 nm之间,具有稳定的双层膜结构[5],其内含有多种类型的生物活性成分,如蛋白质、脂质和核酸等[6]。大量研究表明,当外泌体分泌至细胞外环境后,外泌体可通过质膜融合的方式,将其内所含供体细胞内容物传递至受体细胞,在供体细胞与受体细胞间搭建起信号交流的桥梁,进而影响受体细胞的基因表达和生理功能[7-9]。近期研究发现,外泌体在细菌感染过程中也发挥着重要作用。一方面,宿主细胞可通过水解病原菌,产生多类病原体相关分子模式(pathogenassociated molecular patterns,PAMPs)分子;后者可通过外泌体与受体细胞toll样受体发生特异性结合,刺激细胞表达一系列促炎分子[10]。例如,Beatty等[11]发现被结核分枝杆菌感染的巨噬细胞所释放外泌体中含有结核分枝杆菌PAMPs(LAM和PIM),被感染外泌体可被未感染的巨噬细胞吞噬,引起后者白介素(interleukin,IL)-6、IL-8、IL-10、γ-干扰素和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)的分泌增加[12]。另一方面,被感染的宿主细胞所分泌的外泌体内含有特异性的病原分子[10]。例如,Singh等[13]发现结核病患者血清外泌体内含有5 种分枝杆菌RNA(包括Rv2976和Rv1369c),这些RNA可抑制宿主细胞分泌促炎因子或释放抗炎因子,从而抑制或诱导免疫细胞的凋亡。
蛋白质是外泌体的重要内含物,其组成与来源细胞的生理状态密切相关,蛋白质组成的差异赋予了外泌体不同的生物学特性及功能。例如,沙门氏菌感染巨噬细胞外蛋白质组学分析表明,巨噬细胞外泌体内OTU去泛素化酶1的含量显著增高,当其作用于未感染巨噬细胞后,可引起TNF-α、调节的活化正常T细胞表达和分泌、白细胞介素1受体拮抗剂、巨噬细胞炎症蛋白1、趋化因子配体1等细胞因子的释放[14]。此外,利用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法观察经结核分枝杆菌感染的J774细胞释放外泌体的蛋白质表达,共鉴定出41 种分枝杆菌蛋白,及一些宿主结核特异性膜蛋白和脂蛋白,这些特异性蛋白可刺激激活树突状细胞并促进其抗原提呈[15-17]。
本实验采用Label free蛋白质组学分析方法,对沙门氏菌感染的外泌体宿主来源蛋白质组成及其含量的变化进行了系统分析。外泌体作为细胞间信号交流的重要途径之一,阐明经沙门氏菌感染后宿主细胞所释放外泌体内宿主蛋白质的变化情况,可揭示沙门氏菌感染期间病理细胞与正常细胞间进行信号交流的内容,从而为进一步的沙门氏菌感染及扩散机制研究提供新的科学依据和素材。此外,本研究以外泌体的角度解释机体细胞对沙门氏菌感染所产生生理变化的原因,对沙门氏菌感染机制研究提供了新的方向,旨在对预防沙门氏菌或其他食源性治病菌的感染提供新的思路。
1 材料与方法
1.1 材料、培养基与试剂
人肠上皮细胞Henle-407购于美国模式培养物集存库(ATCC);野生型鼠伤寒沙门氏菌(Salmonella typhimurium)LT2由西南大学李洪涛教授惠赠;DMEM(Dulbecco’s modified eagle medium)高糖培养基美国Corning公司;Gibco胎牛血清、胰蛋白酶、酵母提取物 美国Thermo公司;热休克蛋白(heat shock protein,HSP)70抗体(鼠源)、四跨膜蛋白(cluster of differentiation,CD)9抗体(鼠源)、CD63抗体(鼠源)、辣根过氧化物酶(horseradish peroxidase,HRP)偶联二抗 美国System Biosciences公司;外泌体提取试剂盒(exoRNeasy Serum/Plasma Maxi Kit)德国QIAGEN公司;庆大霉素、聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)蛋白浓度测定试剂盒北京索莱宝科技有限公司;化学发光试剂盒(ClarityTMWestern ECL Substrate) 美国Bio-Rad公司;其他化学试剂均为国产分析纯。
1.2 仪器与设备
细胞培养皿等细胞培养耗材 美国Corning公司;HERACELL 150i CO2培养箱、RC-3BP+大容量低速冷冻离心机 美国Thermo公司;SpectraMax M5多功能读板机 美国Molecular Device公司;TransBlot SD半干转印槽 美国Bio-Rad公司;Tanon-5200Multi化学发光凝胶成像系统 上海天能公司;Allegra 64R台式高速冷冻离心机 美国Beckman Coulter公司;高速离心机 日本Hitachi公司;0.8 μm滤膜 德国Sartorius公司;Tecnai Spirit T12透射电子显微镜 美国FEI公司;粒径分析仪 厦门福流生物科技有限公司。
1.3 方法
1.3.1 细胞培养与感染
人肠上皮细胞Henle-407培养于含10%胎牛血清的高糖DMEM培养基中,并置于37 ℃、5% CO2饱和湿度的培养箱中,以0.25%胰蛋白酶消化传代。当单层细胞融合度达到70%~80%时更换为无血清高糖DMEM培养基饥饿2 h,后续进行沙门氏菌感染实验。将活化后的鼠伤寒沙门氏菌于液体LB培养基中培养至对数生长期收集菌体,以感染复数(multiplicity of infection,MOI)为30加入Henle-407细胞内为实验组(EXP),同时,以未感染沙门氏菌的Henle-407细胞为对照组(CK)。感染30 min后,吸去细胞培养基上清液,用预热的磷酸盐缓冲液润洗细胞2 次,用含有100 μg/mL庆大霉素的高糖DMEM培养细胞30 min以杀死培养皿中残留的细胞外沙门氏菌。最后用预热的磷酸盐缓冲液润洗细胞2 次后,吸去细胞培养基上清液更换为含1 μg/mL庆大霉素的DMEM培养Henle-407细胞至8 h,收集细胞培养基上清液。
1.3.2 外泌体分离
将所收集细胞培养基上清液于2 000×g、4 ℃离心20 min以去除死细胞及细胞碎片,将离心后的上清液通过0.8 μm滤膜后,使用exoRNeasy Serum/Plasma Maxi Kit试剂盒提取外泌体。
1.3.3 蛋白免疫印迹分析
采用蛋白质免疫印迹法对外泌体样本标志性蛋白进行检测,包括HSP70、CD9和CD63。即取50 μL外泌体样本制备成样品,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)后转膜,用5%脱脂乳粉封闭。将一抗按照体积比1∶1 000稀释后于4 ℃孵育过夜。以等渗Tris-HCl缓冲盐溶液(tris buffered saline with 0.1%Tween-20,TBST)洗涤3 次后加入体积比1∶2 000稀释的二抗,室温孵育2 h,用TBST溶液洗涤3 次,加入增强型化学发光试剂(enhanced chemiluminescence,ECL)显色,使用Tanon 5200全自动化学发光图像分析系统成像。
1.3.4 外泌体的透射电镜分析
取10 μL外泌体样本滴加至铜网上,室温下静置5 min后用滤纸吸去浮液,再用超纯水清洗3 次,待其风干之后滴加10 μL磷钨酸于铜网上,静置染色2 min之后用无尘滤纸吸去浮液,室温静置风干,制成电镜样本,上机观察。
1.3.5 蛋白质提取及肽段酶解
外泌体样本采用SDT(4 g/100 mL SDS,100 mmol/L pH 7.6 Tris-HCl,0.1 mol/L二硫苏糖醇)裂解法提取蛋白质,然后采用BCA法进行蛋白质定量。每个样品取适量蛋白质采用过滤辅助样品制备(filter-aided sample preparation,FASP )方法进行胰蛋白酶酶解[18],采用C18Cartridge对肽段进行脱盐,肽段冻干后加入40 μL 0.1%甲酸溶液复溶,肽段定量。
1.3.6 LC-MS/MS 数据采集
每份样本采用纳升流速的HPLC液相系统Easy nLC进行分离。缓冲液A液为0.1%甲酸溶液,B液为0.1%甲酸-乙腈溶液(乙腈为84%)。色谱柱以95%的A液平衡,样品由自动进样器上样到上样柱(Thermo Scientific Acclaim PepMap100,100 μm×2 cm,nanoViper C18),经过分析柱(Thermo scientific EASY column,10 cm×75 μm,3 μm,C18-A2)分离,流速为300 nL/min。样品经色谱分离后用Q-Exactive质谱仪进行质谱分析。检测方式为正离子,母离子扫描范围m/z300~1 800,一级质谱分辨率为70 000,m/z为200,自动增益控制为1×106,ITmax为50 ms,动态排除时间为60.0 s。多肽和多肽碎片的质量电荷比按照下列方法采集:每次全扫描后采集20 个碎片图谱(MS2scan),MS2Activation Type为HCD,Isolation window为m/z2,二级质谱分辨率17 500,m/z为200,Normalized Collision Energy为30 eV,Underfil为0.1%。
1.3.7 生物信息学分析
利用BLAST2GO对目标蛋白质集合进行基因本体论(Gene Ontology,GO)注释,过程大致可以归纳为序列比对(BLAST)、GO条目提取、GO注释和 InterProScan补充注释4 个步骤。利用KAAS(京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)Automatic Annotation Server)软件,对目标蛋白质集合进行KEGG通路注释,采用Fisher精确检验,比较各个GO分类或KEGG通路在目标蛋白质集合和总体蛋白质集合中的分布情况,对目标蛋白质集合进行GO注释或KEGG通路注释的富集分析。
1.4 数据统计及图表绘制
对沙门氏菌感染及未感染的Hen-407细胞所分泌外泌体各提取3 次,记为3 组平行以进行蛋白质组学分析。采用SPSS V18.0软件进行单因素方差分析,同时通过Student’st检验进行组间比较,P<0.05,差异显著,P<0.01,差异极显著,所有实验至少重复3 次。本实验图表均采用Origin及Adobe illustrator软件绘制。
2 结果与分析
2.1 外泌体的鉴定和表征
以经沙门氏菌感染的Henle-407细胞所分泌外泌体为EXP组,同时以未感染的Henle-407细胞所分泌外泌体为CK组。为了对外泌体质量进行表征,本研究采用电镜、蛋白质免疫印迹和纳米粒子追踪分析3 种方法对沙门氏菌感染或未感染的宿主细胞所释放外泌体进行鉴定和分析。外泌体电镜结果如图1a所示,所提取外泌体直径约100 nm,呈椭圆形茶杯状囊泡结构,与文献报道的外泌体形态特征一致[19]。为了分析所获得外泌体的特异性,根据文献[20],选取CD9、CD63及HSP70作为外泌体标志蛋白进行免疫印迹分析,同时以Henle-407细胞全蛋白(C)、细胞培养基上清液(M)、过试剂盒后细胞培养基上清液(S)作为对照,结果如图1b所示,在EXP组和CK组外泌体中均成功检测到这3 种外泌体特异标志物的表达,而在细胞培养基上清液和过试剂盒后的培养基上清液中这3 种蛋白的表达量明显偏低或没有,表明本研究所提样本明确包含有外泌体。接着,为了进一步表征EXP组与CK组外泌体样本中外泌体的纯度与质量,采用纳米粒子追踪分析法对外泌体样本进行粒径分布分析,结果如图1c所示,两组外泌体样本粒径范围均分布于30~150 nm之间,其中CK组峰值为79.75 nm,平均粒径90.35 nm,浓度为5.06×109particles/mL;EXP组峰值为76.75 nm,平均粒径81.38 nm,浓度为7.78×109particles/mL,均符合外泌体的粒径范围,表明本次实验所提取样本外泌体纯度良好。综上所述,从形态特征、标志蛋白表达和粒径分布3 个方面的数据可知,本研究所提取外泌体样本纯度良好,质量较高。最后,为了对所提外泌体样本的蛋白质水平进行平行性检测,利用SDS-PAGE对3 次所提取外泌体进行分析,结果如图1d所示。各个平行样品的SDS-PAGE图条带分布正常,样品之间平行性较好,且蛋白提取样本量足够,样品纯度良好,适于进行后续蛋白质组学实验。

图1 外泌体的鉴定及表征Fig. 1 Identification and characterization of exosomes
2.2 差异表达蛋白的筛选及聚类分析
采用Label free相对定量蛋白质组学方法对两组外泌体样本进行比较分析。经质谱分析和蛋白质理论数据库比对后,如图2a所示,共鉴定到2 490 种蛋白质,包括CK组蛋白2 151 种,EXP组蛋白质1 615 种,两组共有蛋白1 276 种。共有蛋白中采取以倍数变化大于2.0 倍(上调大于2 倍或下调小于0.5 倍)且P<0.05的标准筛选差异表达蛋白。如图2b所示,EXP组与CK组外泌体中共有的差异表达蛋白有7 种,包括3 种表达上调蛋白和4 种表达下调蛋白(表1)。发现上述7 种蛋白中有4 种蛋白与细胞增殖有关,分别为上调蛋白GOLM1、BTF3与下调蛋白EBNA1BP2、U2AF1L5。

图2 沙门氏菌感染与未感染宿主细胞外泌体差异蛋白Venn(a)及火山图(b)Fig. 2 Venn (a) and volcano maps (b) of DEPs in host cell exosomes infected and not infected with S. typhimurium

表1 EXP组与CK组共有的差异表达蛋白Table 1 Shared DEPs between infected and non-infected groups
沙门氏菌感染与肠上皮细胞的增殖和凋亡具有拮抗作用。一方面,沙门氏菌可通过激活宿主细胞AKT/mTOR信号通路抑制因细菌入侵介导的细胞凋亡,为沙门氏菌在细胞内的存活提供条件[21]。GOLM1是AKT/mTOR信号通路的正向调控因子,使用siRNA沉默GOLM1的内源性表达后,前列腺癌细胞的增殖被抑制,细胞凋亡增加,而高表达GOLM1的肿瘤细胞增值和迁移更快,细胞凋亡减少[22-23]。GOLM1主要参与内质网蛋白质的合成后修饰并协助高尔基体完成对蛋白质的转运及分泌[24],促进细胞的生长和增殖。基于此,推测沙门氏菌可能通过对外泌体中GOLM1蛋白的上调调控并抑制临近细胞的凋亡,从而促进细胞内沙门氏菌的繁殖。此外,JAK2/STAT3信号通路在调节细胞增殖、凋亡中也起到关键作用,STAT3的激活会促进细胞间充质转化并保护细胞免于凋亡[25]。BTF3是一种转录调控因子,其可通过激活JAK2/STAT3信号通路参与胃癌上皮细胞间充质转化、刺激细胞增殖[26]。同样,推测BTF3蛋白于EXP组外泌体内的表达量增高会起到与GOLM1蛋白类似的作用,即通过调控受体细胞JAK2/STAT3信号通路,促进细胞增殖,减缓宿主细胞凋亡速率,从而为沙门氏菌的繁殖提供合适的宿主环境。
而另一方面,被感染的肠上皮细胞可通过启动自身程序性死亡以清除其内含沙门氏菌,进而抑制沙门氏菌的繁殖[27]。蛋白质组学数据显示,与rRNA、mRNA成熟过程相关的核仁蛋白EBNA1BP2和U2AF1L5在EXP组外泌体内分别下调至0.15 倍和0.45 倍。EBNA1BP2可通过对pre-rRNA的加工参与核糖体40S和60S亚单位的合成,若将该基因沉默,细胞增殖将受到严重抑制[28-29]。U2AF1L5是一种RNA剪接体复合物蛋白,参与pre-mRNA至成熟mRNA的剪接过程[30],下调U2AF1L5的蛋白表达可损害细胞有丝分裂进程,诱导G2/M期阻滞,降低细胞增殖速率[31]。由此,推测经沙门氏菌感染的宿主细胞可通过外泌体降低邻近细胞的增殖速率,为接下来细胞的程序性死亡提供前期引导,以达到抑制沙门氏菌感染的作用。
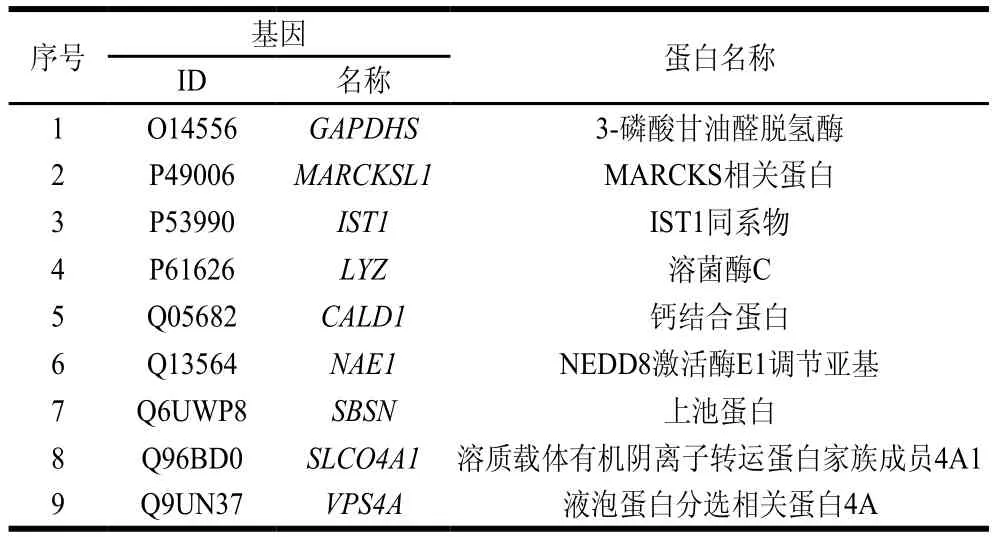
表2 EXP组外泌体中特异性存在的蛋白Table 2 Specific proteins in exosomes from the infected group
尤为重要的是,在筛选差异表达蛋白的过程中发现,以EXP组(或CK组)样品3 次平行中2 次以上不为空值;CK组(或EXP组)样品中3 次平行均为空值的条件筛选差异表达蛋白,称其为非共有蛋白,共得到314 种蛋白质。其中,与CK组外泌体相比,在EXP组外泌体中特异性存在的蛋白有9 种(表2),而缺失的蛋白却多达305 种(未表出)。在特异性存在的9 种蛋白中,与细胞骨架动力学相关的2 种蛋白(CALD1与MARCKSL1)尤为重要。在感染初期,沙门氏菌可通过其T3SS分泌的效应蛋白刺激宿主细胞骨架重排,使细菌内化进入细胞[32],而肌动蛋白是其作用的重要靶点。CALD1蛋白在其C端具有钙调蛋白、原肌球蛋白和肌动蛋白的结合区[33],其可通过刺激肌动蛋白而促使细胞骨架重排[34]。同样,MARCKSL1也是一种肌动蛋白结合蛋白,主要在未成熟脑中表达[35],MARCKSL1蛋白在广泛的癌症类型中被上调,但其在沙门氏菌感染后于宿主细胞所分泌外泌体中特异性表达属首次发现。MARCKSL1蛋白可与肌动蛋白结合调节肌动蛋白束,使细胞骨架重排,促进细胞迁移[36]。调控宿主细胞骨架重排是沙门氏菌能否被成功内化的关键。以上2 个蛋白在被沙门氏菌感染的外泌体中特异性表达,推测沙门氏菌感染极有可能特异性激活宿主细胞CALD1与MARCKSL1的表达,并使其通过外泌体调节临近细胞的细胞骨架,进而帮助沙门氏菌在肠上皮细胞中的感染和扩散。
2.3 差异蛋白质GO功能富集分析
为进一步了解肠上皮细胞在沙门氏菌感染后所释放外泌体内差异表达蛋白的生物学功能,采用BLAST2Go软件对本研究鉴定的所有差异表达蛋白质(共321 种差异表达蛋白,包括7 种共有蛋白和314 种非共有蛋白)进行GO功能注释,然后通过Fisher精确检验方法对差异表达蛋白质进行GO功能富集分析。从生物过程、细胞组成和分子功能3 个分类进行富集分析,如图3所示,外泌体内宿主来源差异表达蛋白主要参与代谢、生物调节、细胞成分组织或生物发生和定位等生物过程,主要为细胞、细胞器、细胞膜和蛋白质复合物的组成成分,具有结合、催化、转运、转录调控等分子功能。
GO分析表明,其中一部分宿主来源差异表达蛋白参与生物调节、细胞成分组织和定位3 种生物过程,位于细胞器、细胞膜和蛋白质复合物3 种细胞组分分类,可发挥结合、转运、分子结构等分子功能,如四跨膜蛋白超家族(CD9、CD63、CD81和CD82)、HSP、核糖体蛋白等。猜测此类蛋白极大可能与细胞内外泌体的产生及外泌体内含蛋白的筛选有关,而剩余其他蛋白(如肌动蛋白、高尔基体膜蛋白、黏附蛋白等)可能与沙门氏菌感染特异性相关。结合EXP组与CK组外泌体内蛋白质的数量差异(存在314 个非共有蛋白)与所提样本外泌体浓度的差异(EXP组7.78×109particles/mL明显大于未EXP组5.06×109particles/mL),猜测沙门氏菌感染一方面抑制宿主细胞蛋白向外泌体的转运,另一方面刺激被感染细胞释放更多特异性外泌体,进而帮助沙门氏菌在肠上皮细胞中感染和扩散。
2.4 差异表达蛋白质KEGG通路富集分析
在生物体中,蛋白质并不独立行使其功能,而是不同蛋白质相互协调完成一系列生化反应以行使其生物学功能。为进一步了解宿主细胞外泌体受到沙门氏菌感染时其代谢通路的具体信息,本研究对上述321 种外泌体宿主来源的蛋白质进行了KEGG通路分析。在P<0.05的范围内,有113 种蛋白与17 条KEGG通路相关。如图4所示,最显著的5 条途径分别为脂肪酸降解、产热、蛋白质合成、精氨酸及脯氨酸代谢和三羧酸循环。参与其途径的差异表达蛋白分别为10、19、7、7、8 种,富集因子分别为0.4、0.26、0.41、0.37和0.33。KEGG通路富集数据显示,参与这5 条通路的相关差异表达蛋白均为EXP组缺失蛋白,由此,推测在沙门氏菌感染期间宿主细胞中此5 种代谢途径均受到严重抑制。从沙门氏菌角度讲,侵入宿主细胞内的沙门氏菌的生长和繁殖所需营养物质均需从宿主细胞内获得,因此,抑制宿主细胞相关代谢途径有利于沙门氏菌对营养物质如脂肪酸、葡萄糖和氨基酸等物质的占据和掠夺。研究表明,在侵入宿主细胞后沙门氏菌体内对精氨酸的合成量显著降低[37],结合本研究KEGG数据(精氨酸及脯氨酸代谢通路被抑制),推测沙门氏菌在宿主细胞内通过抑制宿主细胞对精氨酸的代谢达到对细胞内精氨酸的占有及利用,以补充自身的合成空缺。同样,脂肪酸降解、产热、蛋白质合成和三羧酸循环途径均为宿主细胞利用自身营养物质的过程,此4 条代谢通路受到抑制可使宿主细胞对营养物质的利用显著降低进而有利于沙门氏菌的生长和繁殖。从宿主细胞角度讲,三羧酸循环途径与蛋白质合成途径是细胞生长增殖所需能量和蛋白的直接来源,此2 条途径同时受阻无疑会严重抑制细胞生长。此外,研究表明脂肪酸降解途径受阻将直接抑制细胞的生长和增殖[38]。由此,推测沙门氏菌感染会导致肠上皮细胞增殖减缓,此结果与文献[39]报道基本一致。

图3 差异蛋白质GO分类图Fig. 3 GO classification of DEPs

图4 差异表达蛋白质KEGG通路富集分析图Fig. 4 KEGG pathway enrichment analysis of DEPs
2.5 蛋白质组学数据准确性验证
Western bloting技术是验证蛋白质组学数据准确性的最佳方法。本实验利用Western bloting技术以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为对照,挑选上调蛋白GOLM1(5.5 倍)、下调蛋白EBP2(0.15 倍)和EXP组外泌体特异性表达蛋白GAPDHS以验证蛋白质组学数据的可靠性。如图5所示,在EXP组外泌体中此3 个蛋白表达情况与蛋白质组学数据基本一致,表明本研究蛋白质组学结果真实可靠。

图5 沙门氏菌感染与未感染外泌体内关键差异蛋白Western bloting验证结果Fig. 5 Western blotting validation of key DEPs in exosomes infected and not infected with S. typhimurium
3 讨 论
利用Label free相对定量蛋白质组学方法系统分析了沙门氏菌感染后宿主细胞外泌体内宿主来源蛋白质的变化。本研究发现,EXP组与CK组外泌体共有蛋白中有7 种蛋白质的含量变化在2.0 倍以上;相比于CK组,EXP组外泌体中特异性增加了9 种蛋白质,而缺失的蛋白质却多达305 种。GO分析表明差异蛋白主要参与细胞过程、代谢过程和生物调节过程,与结合、催化和转运等分子功能有关。KEGG分析表明差异蛋白主要富集在17 种代谢通路中。其中,与脂肪酸降解、产热、精氨酸与脯氨酸代谢、蛋白质合成和三羧酸循环途径有关的蛋白质均为EXP组缺失蛋白。由此可见,沙门氏菌感染对宿主细胞外泌体内的蛋白组成具有直接调控作用。
在沙门氏菌感染过程中,沙门氏菌与宿主细胞之间存在互相对抗,而宿主细胞所产生外泌体是沙门氏菌与宿主细胞所共同调控的结构。从沙门氏菌角度讲,本研究推测在沙门氏菌感染过程中,被感染宿主细胞所释放的外泌外可作为沙门氏菌侵染的先锋军。在邻近细胞被沙门氏菌侵染前,EXP组外泌体可提前被邻近细胞所吸收,其内含特异性存在的CALD1与MARCKSL1蛋白可通过肌动蛋白促进邻近细胞骨架重排,有利于接下来沙门氏菌的侵染。之后,共有蛋白中表达上调的GOLM1和BTF3蛋白可通过调节邻近细胞AKT/mTOR、JAK2/STAT3与FOXM1信号通路,促进细胞增殖,抑制细胞凋亡,为接下来的沙门氏菌在细胞内的繁殖创造条件。此外,结果显示,沙门氏菌感染宿主细胞后,宿主细胞所释放外泌体内宿主来源蛋白质相比于CK组缺失达305个,并且结合上述GO分析结果。本研究推测,在沙门氏菌感染过程中,沙门氏菌极有可能抑制了宿主细胞外泌体对宿主来源来源蛋白的摄取,以阻碍感染细胞与正常细胞间的正常信息传递从而为沙门氏菌感染创造条件。KEGG分析结果——脂肪酸降解、产热、精氨酸与脯氨酸代谢、蛋白质合成和三羧酸循环途径有关差异表达蛋白均为EXP组缺失蛋白也证明了这一推论。
从宿主细胞角度讲,被感染宿主细胞所释放外泌体也可作为其向邻近细胞传递信号的载体。例如,共有蛋白中表达下调的EBNA1BP2和U2AF1L5蛋白可通过调节mRNA的成熟抑制邻近及宿主细胞的增殖,以增强宿主细胞程序性死亡清除沙门氏菌的作用。但此作用能否成功发挥,需要进一步实验验证,因为作为沙门氏菌感染后宿主细胞向细胞外释放的信息载体,外泌体所包含的信息内容十分丰富,既存在有利于沙门氏菌存活的部分,也存在有利于宿主细胞清除沙门氏菌的部分,体现了沙门氏菌与宿主细胞间的拮抗作用。此外,本研究推测,包含有沙门氏菌特异性蛋白质组的外泌体被巨噬细胞吞噬后,极有可能刺激巨噬细胞发生免疫应答,以增强机体对沙门氏菌的清除作用。类似现象已于结核分枝杆菌感染过程中发现,被结核分枝杆菌感染的巨噬细胞所释放外泌体可诱导CD4/CD8T细胞产生THI型免疫应答,增强机体对结核分枝杆菌的清除作用[40]。
沙门氏菌作为全球主要的食源性病原菌之一,对人类健康和食品安全具有严重影响,然而,有效抑制沙门氏菌疾病的方法仍然有限,研发用于预防及治疗沙门氏菌感染的有效药剂仍是食品相关行业的重中之重。本实验应用蛋白质组学对沙门氏菌感染期间宿主细胞产生外泌体中所含宿主来源的蛋白质进行了系统研究,全面了解宿主细胞对细菌感染的反应以及细胞间通讯的内容,提供了沙门氏菌-宿主细胞-其他靶细胞相互作用的新思路与新靶点。外泌体作为一种双层膜囊泡结构,其可作为传递药物的天然载体,了解其内部构成,可为挖掘外泌体的药物载体功能,开发抗感染药物或保健食品提供坚实的理论基础。
