18F-NaF PET/CT、18F-FDG PET/CT及MRI对鼻咽癌患者颅底骨质受侵及骨转移的评估价值比较*
2022-03-30张伟
张 伟
辽宁中医药大学附属医院医学影像中心(辽宁 沈阳 110032)
鼻咽癌颅底骨质侵犯及骨转移均为影响患者预后及放射治疗选择的重要因素[1],故尽早确诊鼻咽癌颅底骨质受侵及骨转移对指导治疗及改善患者预后有重要的临床意义。CT、MRI均为鼻咽癌侵犯途径的有效方式,其中CT扫描时间短,检查费用低廉,组织分辨率高,可清晰显示鼻咽腔、咽旁间隙入等深部软组织侵犯;MRI可实现多参数、多方位成像,软组织分辨率,明确鼻咽癌原发灶侵犯范围,对咽后淋巴结、鼻窦、口咽部、颅底骨质等侵犯检出率优于CT[2]。报道发现,MRI对鼻咽癌分期准确率优于CT[3]。但两者皆以显示组织解剖结构为主,对直径低于1cm淋巴结定性困难,易漏诊远处转移灶[4]。正电子发射计算机断层显像/电子计算机X射线断层扫描技术(PET/CT)是将形态学与代谢影像相结合的分子影像技术,可提供肿瘤定性、分期、治疗反应及代谢特征等信息,但传统18氟-脱氧葡萄糖(18F-FDG)示踪剂对骨质受侵评估能力差,对成骨性转移灶检出能力一般[5]。18氟-氟化钠(18F-NaF)示踪剂则为用于探测骨骼病变的高敏感度亲骨性示踪剂,注入体内后氟原子18F可与放射γ光信号生成反映骨骼代谢的影像资料,目前已被证实对乳腺癌骨转移有较高的诊断效能[6]。但国内外尚缺乏对18F-NaF PET/CT、18F-FDG PET/CT与普通MRI显像诊断鼻咽癌颅底骨质侵犯及骨转移效能对比的评估。故本研究对18F-NaF PET/CT、18F-FDG PET/CT及MRI诊断鼻咽癌颅底骨质受侵及骨转移价值进行评估,旨在为鼻咽癌颅底骨质受侵及骨转移筛查提供临床参照。
1 资料与方法
1.1 临床资料 回顾性收集2016年2月至2018年4月医院收治的48例经病理证实为鼻咽癌患者的临床资料。其中男32例,女16例;年龄32~73岁,平均年龄(48.9±10.7)岁;体重45~89kg,平均体重(71.5±15.6)kg;临床分期:Ⅱ期7例,Ⅲ期20例,Ⅳ期21例。
纳入标准:年龄>18岁;入院2周内完成18F-NaF PET/CT、18F-FDG PET/CT、MRI检查,PET/CT与MRI检查时间间隔不超过2周,期间未接受治疗者;经病理活检证实者;初诊病例者;无其他恶性肿瘤者;无其他颅底病变者;肝肾功能基本正常者;骨质侵犯及骨转移均经随访证实者;临床及随访资料完善者。排除标准:病理未明确者;已接受放化疗者;急慢性感染者;无法控制内科疾病者;存在可能影响检测结果骨病者;对显影剂过敏者;不能配合检查者;心肝肾肺器质性障碍者;合并腹水、胸水、慢性腹泻、中枢神经系统异常或精神异常等影响显像剂代谢疾病者;有免疫抑制剂长期应用史者;合并其他恶性肿瘤者;孕期或哺乳期女性;无法获取完整临床及随访资料者。
1.2 方法 PET/CT检查:安静、整洁、暗室内进行,采用荷兰Philips公司Gemini TF/16型PET/CT扫描仪,德国西门子公司Eclipse HD回旋加速器自行制备18F-NaF示踪剂,注射剂量4.07MBq/kg;18F-FDG示踪剂由北京派特生物技术公司专用18F-FDG自动化学合成系统制备(放化纯>98%),18F-FDG PET/CT检查前禁食6h以上,示踪剂注射剂量5.5mBq/kg,注射完毕后静坐休息1.5~2.0h,先行CT扫描,自颅顶扫描至足底,电流80~250mA,电压120kV,螺距0.81,层厚5.0mm,旋转时间0.5s;完毕后立即采集PET,颅顶扫描至足底,每床位采集60~70s,有序子集最大期望值法(OSEM)重建,迭代3次,子集数33,矩阵512×512,CT衰减校正获取冠状面、矢状面、横断面及最大密度投影图像。
MRI检查:采用荷兰Philips公司Achieva 3.0T MR扫描仪,头颈部联合线圈,进行T1、T2加权成像及增强扫描,自鞍上区扫描至第7颈椎椎体下缘,横断位自旋回波T1WI(TR 400~670ms,TE 18ms)、T2WI平扫(TR 2500~3500ms,TE 90ms)及T2WI抑脂序列(TR 1500~2500ms,TE 60ms)扫描与冠状位T2WI抑脂序列扫描,横断位层厚5.0mm,层间距1.0mm,冠状位、矢状位层厚均为4.0mm,层间距0.5mm;增强扫描静脉注射马根维显(钆-二乙烯五胺乙酸)造影剂0.1mmol/kg,行横断位T1WI增强扫描。图像传输至后处理软件。
1.3 图像分析 选择2名有核医学、放射资格证高资历医师进行双盲阅片,2人意见不统一时协商得出结论,记录每位患者颅底骨质受侵及骨转移灶数量。
1.4 鼻咽癌颅底骨质受侵及骨转移标准 (1)PET/CT[7]:依据病灶局部摄取示踪剂标准摄取值(SUV)判断,PET见颅底骨示踪剂缺损或聚集(18F-NaF PET:SUVmax>颅骨SUVmax;18F-FDG PET:SUVmax>纵隔血池SUVmax)或CT见骨质密度增高。骨转移:18F-NaF PET:SUVmax>对侧正常骨骼SUVmax或椎体SUVmax>正常SUVmax;18F-FDG PET:SUVmax>纵隔血池SUVmax;CT:成骨性转移,见局部结节状、不对称密度增高,位于枢椎及以上平面;溶骨性转移,局部骨质破坏伴或不伴软组织肿块,排除感染、手术、外伤史。良性:示踪剂浓聚但CT病变位于骨骼边缘呈骨赘样生长,病灶边缘硬化,随访无明显改变;转移灶:随访发现病灶增大或溶骨、混合性病灶经放化疗后转化成骨性病变。(2)MRI[8]:颅底骨质信号缺失或正常骨髓T1WI被低信号替代,增强扫描强化视为颅底骨质受侵;骨骼内T1WI抑脂序列呈低信号或T2WI抑脂序列呈高或混杂高信号,增强扫描见不规则强化。
1.5 统计学方法 采用SPSS 20.0软件分析实验数据,计数数据用%表示,进行χ2检验或Fisher确切概率分析,P<0.05为差异有统计学意义。
2 结 果
2.118F-NaF PET/CT、18F-FDG PET/CT、MRI诊断鼻咽癌颅底骨质受侵效能对比 48例鼻咽癌随访6个月影像学确诊颅底骨质受侵26例(54.17%),未侵犯22例(45.83%)。18F-NaF PET/CT、18F-FDG PET/CT、MRI对鼻咽癌颅底骨质受侵检出情况见表1,诊断效能见表2。18F-NaF PET/CT、MRI诊断鼻咽癌颅底骨质受侵效能优于18F-FDG PET/CT(P=0.041、0.043,均<0.05)。确诊26例骨质侵犯中,未见明显骨质破坏5例,其中18F-NaF PET/CT阳性4例,18F-FDG PET/CT阳性3例,MRI阳性4例,其中3例PET/CT浓聚灶与MRI异常信号分布吻合(图1);成骨性改变或硬化10例,3种影像学征象分布一致6例,MRI漏诊1例;溶骨性骨质破坏6例,其中4例3种影像学检查结果分布完全吻合;混合型骨质破坏5例,2例3种影像学表现一致。病灶分布:18F-NaF PET/CT、18F-FDG PET/CT、MRI检出颅底骨质受侵部位以枕骨斜坡受侵为主,检出率分别为84.62%(22/26)、69.23%(18/26)、80.77%(21/26)。
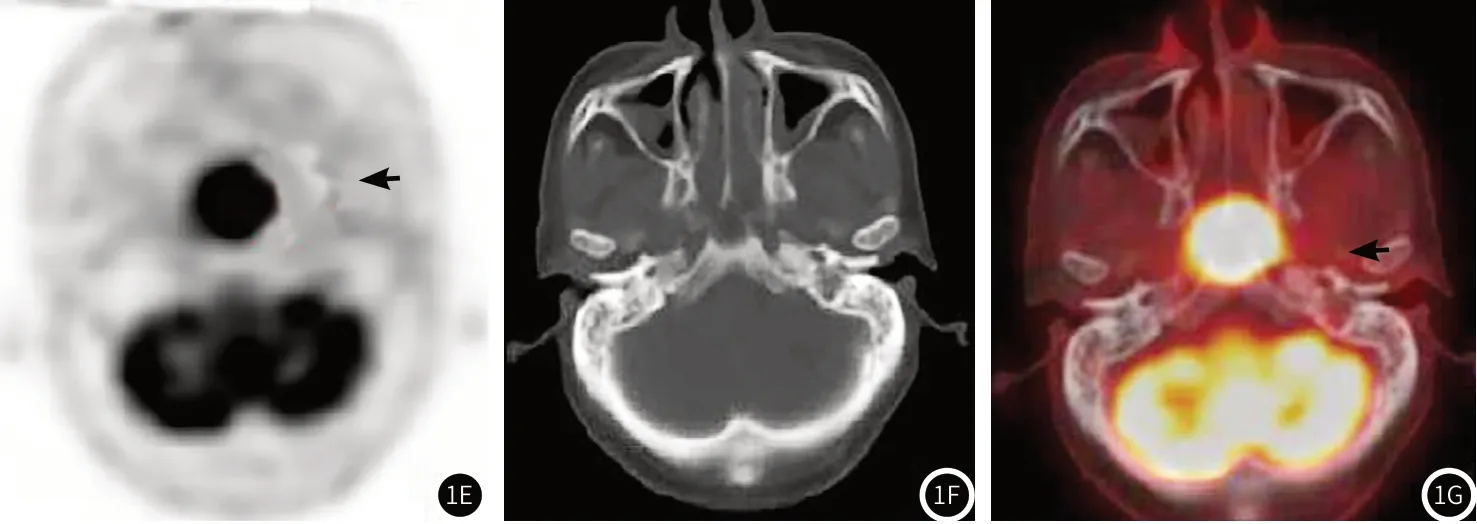
图1 男,65岁,鼻咽非角化性癌,1周内行18F-NaF PET/CT、MRI、18F-FDG PET/CT检查,18F-NaF PET/CT示颅底骨质代谢异常(箭头示),骨密度分布无异常。图1A、图1B、图1C分别为横断面PET、CT及PET/CT融合图像;MRI检查示颅底骨质信号异常(箭头示,图1D);18F-FDG PET/CT鼻咽壁增厚伴葡萄糖高代谢,见示踪剂放射性浓聚,但受脑组织代谢干扰,18F-FDG PET/CT横断面PET、CT、PET/CT融合图分别为图1E、图1F、图1G。

表1 18F-NaF PET/CT、18F-FDG PET/CT、MRI诊断鼻咽癌颅底骨质受侵效能对比(例)

表2 18F-NaF PET/CT、18F-FDG PET/CT、MRI诊断鼻咽癌颅底骨质受侵效能对比(%)
2.218F-NaF PET/CT、18F-FDG PET/CT、MRI诊断鼻咽癌骨转移效能对比 随访证实46例鼻咽癌最终病灶数220个,其中骨转移病灶数为183个,良性病灶数37个;18F-NaF PET/CT确诊转移灶数目179个,良性灶27个;18F-FDG PET/CT确诊转移灶数82个,良性灶31个;MRI确诊转移灶数目为175个,良性灶24个,18F-NaF PET/CT、MRI诊断鼻咽癌骨转移效能优于18F-FDG PET/CT(P<0.001),见表3~4。18F-NaF PET/CT、18F-FDG PET/CT、MRI检出骨转移灶分布见表5。

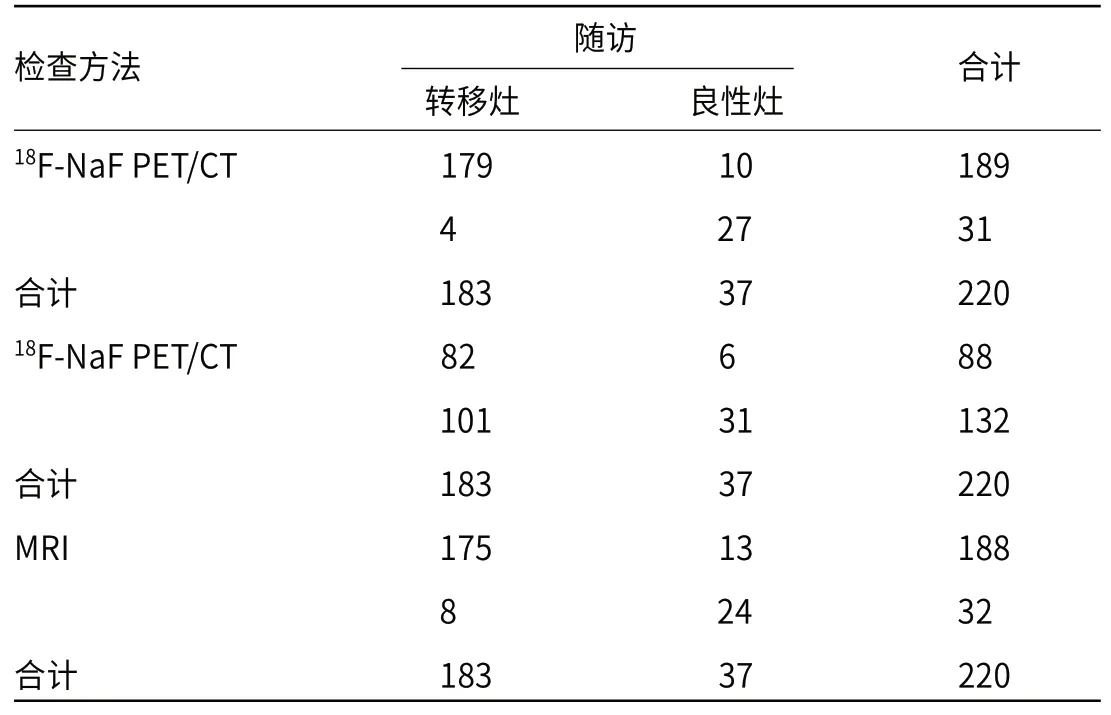
表3 18F-NaF PET/CT、18F-FDG PET/CT、MRI诊断鼻咽癌骨转移效能对比(个)

表4 18F-NaF PET/CT、18F-FDG PET/CT、MRI诊断鼻咽癌骨转移效能对比(%)
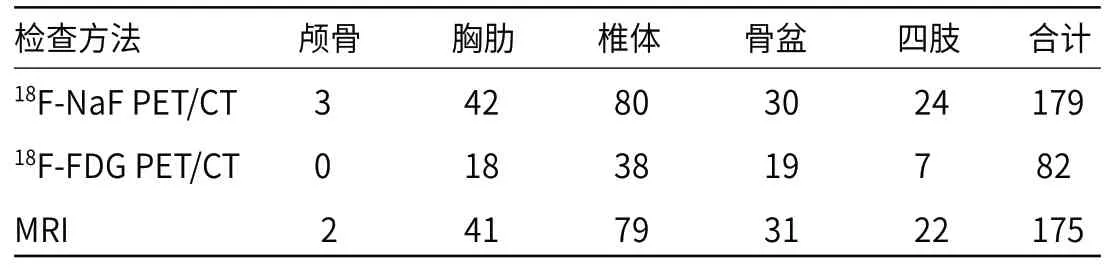
表5 18F-NaF PET/CT、18F-FDG PET/CT、MRI检出骨转移灶分布(个)
3 讨 论
鼻咽癌系起源于鼻咽部黏膜的头颈部恶性肿瘤,有显著地区分布差异,我国南方地区发病率达15%~18%[9-10],男性常见[11],好发于鼻咽腔顶后壁、咽隐窝,上方为颅底结构,癌细胞生长活跃、呈浸润性生长,易向上侵犯颅底骨质,导致脑转移[12]。根据大样本数据统计,鼻咽癌颅底受侵发生率超过65%[13]。文献报道,鼻咽癌远处转移中骨骼是常见受累部位,比例高达75%[14]。而明确鼻咽癌转移特点给予针对性治疗则可改善患者预后。鼻咽癌部位存在特殊性,目前多通过影像学手段筛查肿瘤侵犯范围,包括X线平片、CT、MRI、骨扫描及PET/CT等,前三者皆为局部筛查,X线平片多用于评估鼻咽癌是否发生肺转移,但组织分辨率低,受伪影干扰大;诊断性CT可明确颅底骨质受侵、脏器官及淋巴结转移状况,但CT剂量大,辐射损伤大,全身扫描存在局限性,且易漏诊微小转移灶[15];骨扫描对骨转移灵敏度高,但欠缺特异性[16]。
PET/CT、MRI两者均可用于全身扫描,但目前对两者用于鼻咽癌骨质侵犯及骨转移诊断的价值尚存在争议。Hong等[17]认为,MRI对骨质破坏灵敏度高,可在骨质出现明显破坏前检出病变。也有研究显示,PET/CT对早期鼻咽癌定性诊断价值优于MRI[18]。文献报道,18F-FDG PET/CT相较MRI对颅底病变显示无明显优势,易受脑组织代谢影响[19]。有学者提出,将PET/CT示踪剂改为亲骨性18F-NaF可提升PET/CT对骨质破坏诊断的灵敏度[20]。但目前国内外鲜有三者在鼻咽癌骨质受侵及骨转移中的诊断价值对比研究。本研究对48例已接受18F-NaF PET/CT、18F-FDG PET/CT、MRI检查的鼻咽癌患者的影像学资料展开回顾性分析,发现三项检查手段中,18F-FDG PET/CT对鼻咽癌颅底骨质受侵方面诊断准确率最低,不及18F-NaF PET/CT与MRI,考虑与18F-FDG PET/CT主要通过细胞葡萄糖代谢反映病变情况,受脑组织及肿瘤代谢干扰大,影响颅底受侵判断有关。而18F-NaF PET/CT应用非肿瘤特异性示踪剂,主要反映血流与骨骼重建状况,在成骨与溶骨性病变中通过摄取反映局部血流及骨转换特点,摄取机制与亚甲基二磷酸盐类似,但前者药代动力学更优,血流清除速度快,骨组织摄取浓度高,检查时间更短,对骨病变扫描更敏感[21]。本研究中18F-NaF PET/CT较18F-FDG PET/CT检出更多骨质侵犯,考虑与病灶血流改变尚未引起葡萄糖代谢变化有关。而18F-NaF PET/CT与MRI对鼻咽癌颅底骨质受侵诊断效能类似,随访6个月符合率分别为93.75%、91.67%,与吴娜静等[22]结论相符,提示两者对鼻咽癌颅底骨质受侵均有较高的诊断价值。此外,随访证实,鼻咽癌颅底骨质受侵患者枕骨斜坡受侵好发,18F-NaF PET/CT与MRI对斜坡受侵检出率均超过80%,与周敏等[23]统计结果相同。
在鼻咽癌骨转移方面,本研究发现骨转移灶多分布于椎体、胸肋骨区,与罗丽等[24]研究结果相似。但18F-NaF PET/CT检出骨转移灶总数较18F-FDG PET/CT多,且灵敏度、准确性均优于18F-FDG PET/CT,但18F-NaF PET/CT假阳性出现情况相对较高,特异性仅72.97%,分析原因为:损伤及炎症非肿瘤机制所引起骨组织代谢活跃也可导致18F-NaF浓聚。而MRI检查特异性略低,考虑与MRI受主观判断影响大,图像质量、医师诊断水平、信号干扰等均对检查结果产生影响。此外,肿瘤体积较大、形态非规则、结构紊乱等均影响最终结果判断。
总之,18F-NaF PET/CT、18F-FDG PET/CT、MRI三者中以18F-NaF PET/CT、MRI对鼻咽癌颅底骨质侵犯及骨转移诊断效能高,18F-NaF PET/CT受软组织代谢干扰小,显像快,可快速进行全身骨显像,确定骨质侵犯与骨转移,为病情评估提供更多参考信息。但目前MRI仍为鼻咽癌主要影像学筛查手段,可颅底骨质及周围软组织侵犯,无辐射干扰,而将MRI与18F-NaF PET/CT结合可为鼻咽癌患者临床诊断提供更多的参考信息,进一步指导其临床诊治。
