阿帕替尼对卵巢癌术后复发铂类耐药的影响
2022-03-30郭军刘登湘王娜孙雅薇何莉莉朱晓燕郭治王利飞
郭军,刘登湘,王娜,孙雅薇,何莉莉,朱晓燕,郭治,王利飞
作者单位:邢台市人民医院,a肿瘤内科,b妇科,河北 邢台054031
临床上卵巢癌是女性常见的生殖系统恶性肿瘤之一,是女性肿瘤中死亡率最高的恶性肿瘤,多数病人发现时已晚期甚至发生扩散。目前卵巢癌的标准治疗方案是以铂类为基础的化疗方案,多数病人对该化疗方案较为敏感,但有75.0%的复发率,且存在较高的铂类耐药情况[1]。目前对于卵巢癌术后复发铂类耐药病人尚无公认的化疗方案,随着医学的发展,癌细胞的靶向治疗得到人们关注。阿帕替尼可以抑制肿瘤的血管生成,因此可以作为靶向药物起到抗肿瘤效果[2]。为此,本研究分析阿帕替尼治疗卵巢癌术后复发铂类耐药的临床价值,为术后复发铂类耐药卵巢癌治疗的研究提供可参考依据。
1 资料与方法
1.1 一般资料选择2017 年10 月至2019 年3 月期间邢台市人民医院66 例卵巢癌后复发铂类耐药的病人作为研究对象,年龄(52.34±4.32)岁,范围为35~70岁。
纳入标准:卵巢癌诊断符合《卵巢恶性肿瘤诊断与治疗指南(第四版)》[3],且病理确诊;至少2 种含铂类标准化疗治疗后复发间隔时间短于6 个月,卵巢再次出现影像学可见的肿瘤病灶;预计生存时间超过3个月;体力状况ECOG评分0~2分。
排除标准:明确其他部位恶性肿瘤、严重心肺功能不全、精神异常或认知功能障碍等。
1.2 分组及给药方法采用随机数字表法分为阿帕替尼联合化疗组(以下简称“联合组”)、化疗组及阿帕替尼单药组(以下简称“单药组”),各22例。纳入本研究开始服药即开始随访。病人或其近亲属知情同意,本研究符合《世界医学协会赫尔辛基宣言》相关要求。
给药方案:(1)联合组:阿帕替尼(500 mg,口服,每日1 次,商品名:艾坦,江苏恒瑞医药股份有限公司,批号H20140105,0.25 克/片)+多西他赛(60~75 mg/m2,静脉点滴,每3 周1 次,4 周为1 个周期,商品名:艾素,江苏恒瑞医药股份有限公司,批号H20020543,20 毫克/支)或吉西他滨(1 000 mg/m2,静脉点滴,每周1次,连续3周,4周为1个周期,商品名:泽菲,江苏豪森药业股份有限公司,批号H20030104,200 毫克/支)。连续2 个周期进行疗效评价。4个周期后阿帕替尼单药维持,每2个月进行疗效评价。(2)化疗组:多西他赛或吉西他滨(同联合化疗组化疗方案)。连续2个周期进行疗效评价,4个周期后每2个月进行疗效评价。(3)单药组:单独给予阿帕替尼治疗(同联合化疗组阿帕替尼方案)。前2个周期每3周行疗效评价,之后每2个月进行疗效评价。
1.3 评价指标(1)疗效评价应用实体瘤疗效评价标准(RECIST)1.1 评估,即完全反应(CR):病变消失;部分反应(PR):病变直径之和减少>30%;进展性疾病(PD):病变直径之和增加>20%,1 个或多个新病变的出现也被视为进展;稳定疾病(SD):病变直径之和减少未到达PR 要求,且直径之和增加未满足PD 要求。CR+PR=客观缓解率(ORR),CR+PR+SD=疾病控制率(DCR)。(2)无进展生存期(PFS):入组开始到发生任何事件的时间,包括死亡、疾病进展、改换化疗方案、改为化疗、加用其他治疗、发生致死性或不能耐受的副作用等事件。总生存期(OS):本研究定义为病人从开始治疗至死亡。(3)不良反应采用肿瘤常见不良反应分级标准(CTCAE)4.0版评价:手足症候群、白细胞减少、血小板减低、贫血、高血压等,每种分为1~3级。
1.4 统计学方法数据采用SPSS 22.0 软件处理。采用±s表示正态分布且方差齐的计量资料,两组间比较行成组t检验;多组间比较采用单因素方差分析。采用百分数表示计数资料,行χ2检验比较。生存分析采用Kaplan-Meier 分析。P<0.05 为差异有统计学意义。
2 结果
2.1 三组病人基线资料比较三组病人治疗前性别、年龄等基线资料比较差异无统计学意义(P>0.05),见表1。
表1 三组卵巢癌术后复发铂类耐药病人基线资料比较
2.2 三组病人临床疗效比较三组病人ORR 及DCR 比较差异有统计学意义(P<0.05);两两比较:联合组ORR 及DCR 均高于化疗组与单药组(P<0.05);单药组DCR 高于化疗组(P<0.05);单药组ORR 与化疗组比较差异无统计学意义(P>0.05)。见表2。
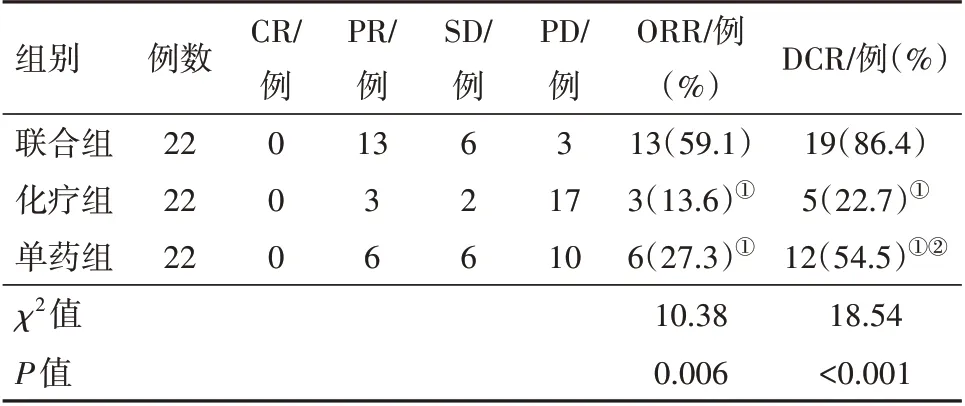
表2 三组卵巢癌术后复发铂类耐药病人临床疗效比较
2.3 三组病人PFS 及OS 比较中位PFS 联合组为8.8(7.9~9.6)个月,化疗组为5.9(5.1~6.8)个月,单药组为7.1(6.7~7.6)个月,联合组疾病进展风险显著低于化疗组及单药组(P<0.05),单药组疾病进展风险显著低于化疗组(P<0.05)。中位OS 联合组为9.0(8.6~9.3)个月,化疗组为6.0(4.3~7.6)个月,单药组为7.0(6.2~7.7)个月,联合组疾病死亡风险显著低于化疗组及单药组(P<0.05),单药组疾病死亡风险显著低于化疗组(P<0.05)。
2.4 三组病人不良反应比较三组不良反应发生情况详见表3,联合组、化疗组及单药组总发生率比较差异无统计学意义[86.4%(19/22)比86.4%(19/22)比77.3%(17/22),χ2=0.87,P=0.646]。
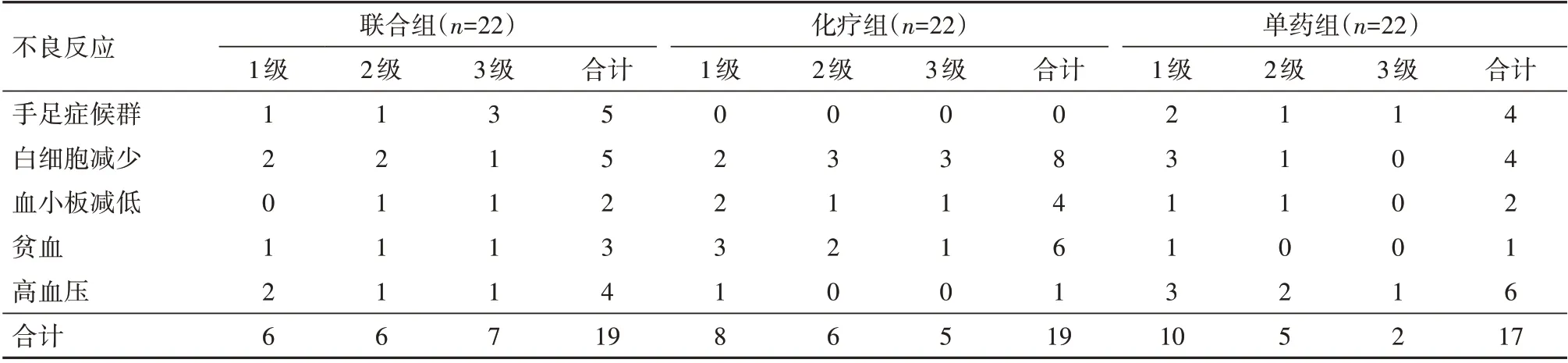
表3 三组卵巢癌术后复发铂类耐药病人不良反应发生情况/例
3 讨论
每年全球约有22万女性死于卵巢癌,我国目前卵巢癌确诊人数为5.21 万,每年约有2.25 万女性死于卵巢癌[4-5]。虽然医学发展使更多的卵巢癌女性得到治疗,但死亡率并未下降,且即使经过标准规范化疗治疗,仍有75.0%的病人复发。
目前越来越多的研究表明,与传统化疗治疗相比,靶向治疗不仅可以改善病人的耐药情况,抑制癌细胞发生转移,提高病人的生存时间,且其临床副作用小,耐受性较好,已成为临床治疗恶性肿瘤的研究热点[6-9]。研究发现,血管新生是恶性肿瘤发生及转移的关键步骤,恶性肿瘤的新生血管可以为肿瘤细胞提供充足的血液供应,同时肿瘤细胞可以通过新生血管转移到其他器官[10-11]。因此通过抑制血管内皮细胞增殖进而抑制肿瘤新生血管的生成可以起到抑制肿瘤的作用。
阿帕替尼是一种小分子血管内皮生长因子(VEGF)受体酪氨酸激酶抑制剂,通过与蛋白酪氨酸受体的ATP 位点结合可以抑制酪氨酸激酶活性,进而阻断VEGF的信号转导,抑制血管生成[12-14]。本研究分析发现单阿帕替尼组DCR 高于化疗组,而阿帕替尼联合化疗病人ORR 及DCR 均高于化疗组与单阿帕替尼组。可见阿帕替尼较常规化疗治疗,明显提高了病人的DCR,降低了死亡风险;而阿帕替尼联合化疗后不仅DCR 更高,且提高了ORR,延缓了卵巢癌的进展风险。
本研究进一步分析病人生存情况发现联合组中位PFS及中位OS均大于化疗组及单药组,而单药组中位PFS 及中位OS 均大于化疗组。陈蜜等[15]研究发现,阿帕替尼组中位PFS为8.0(5.0~10.5)个月,吉西他滨组中位PFS 为5.0(3.0~8.8)个月(P<0.05);阿帕替尼组未达到中位OS,吉西他滨组中位OS 为6.0(3.8~12.0)个月(P<0.05)。可见单药组疾病进展风险及死亡风险均低于化疗组,而联合组疾病进展风险及死亡风险更低。
目前关于阿帕替尼不良反应的机制尚不明确。阿帕替尼是一种全身性药物,在抑制肿瘤组织血管生成的同时可能改变皮下微血管结构,进而导致手足综合征;血压升高可能与阿帕替尼抑制肿瘤新生血管生成同时,抑制了血管平滑肌扩血管物质的分泌,进而导致血管收缩引起血压升高[16]。本研究分析不良反应发生情况发现,阿帕替尼的主要不良反应为手足症候群、白细胞减少及高血压,化疗组的主要不良反应为白细胞减少、血小板减低、贫血。三组不良反应总发生率比较差异无统计学意义,且所有不良反应对症处理后均好转,未出现危及生命的副作用。可见阿帕替尼联合化疗治疗并未增加相互的不良反应发生风险,有较好的耐受性及安全性。
综上所述,本研究显示,阿帕替尼联合化疗治疗卵巢癌术后复发铂类耐药明显提高了ORR 及DCR,明显延长病人生存时间,且未增加不良反应程度,病人可耐受,对卵巢癌术后复发铂类耐药治疗有重要临床意义。
