微小RNA-138-5p通过调控Kelch重复蛋白影响缺氧/复氧心肌细胞增殖与凋亡
2022-03-30杜虹张志远谷小卫董自超
杜虹,张志远,谷小卫,董自超
作者单位:1中国人民解放军联勤保障部队第988医院心胸外科,河南 焦作454003;
2武汉亚洲心脏病医院心脏外科,湖北 武汉430000
冠心病是全球人类死亡或残疾的主要原因之一,其治疗的主要方法为心肌的再灌注溶栓治疗[2]。但是,心肌再灌注过程可引起进一步的心肌细胞的再灌注损伤,造成心肌细胞死亡[3]。心肌细胞缺氧/复氧(H/R)是心肌缺血再灌注损伤的体外模拟[4]。因此,本研究于2018 年5 月至2019 年12 月以缺氧/复氧心肌细胞为研究对象,探究微小RNA(microR‑NA,miRNA/miR)-138-5p 和Kelch 重复蛋白(Kelch repeat protein,KLHDC10)在缺氧复氧心肌细胞中的调控功能及二者之间的作用关系。
1 材料与方法
1.1 材料心肌细胞H9C2购自上海中国科学院细胞库;培养基DMEM 购自上海慧颖生物科技有限公司;pYr-MirTarget载体购自长沙赢润生物技术公司;反转录试剂盒购自上海华舜生物工程有限公司;实时荧光定量逆转录聚合酶链反应(qRT-PCR)试剂盒购自上海古朵生物公司;细胞计数试剂盒(CCK-8)购自日本同仁化学研究所;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)双染凋亡检测试剂盒购自南京诺唯赞生物科技有限公司;Multi‑scan MK3 全自动多功能酶标仪购自上海优浦科学仪器有限公司;EPICS-PRO-FILEⅡ流式细胞仪购自美国Coulter。
1.2 方法
1.2.1细胞的培养与分组 将H9C2 细胞用混有10%胎牛血清和1%双抗的DMEM 培养基在37 ℃、5%二氧化碳的恒温细胞培养箱中进行培养、传代。参考刘洋等[5]的方法建立H/R H9C2细胞模型,标记为H/R 组。正常培养的H9C2 细胞标记为对照组。用3~5 倍DNA 或质粒量的脂质体将以下各组细胞转染至H/R 组细胞:H/R+miRNA 阴性对照(miRcon)组(转染miR-con)、H/R+miR-138-5p 组[转染miR-138-5p 模拟物(miR-138-5p mimics)]、H/R+小干扰RNA 阴性对照(si-con)组(转染si-con)、H/R+KLHDC10小干扰RNA(si-KLHDC10)组(转染si-KL‑HDC10)、H/R+miR-138-5p+过表达空载体(pcDNAcon)组(共转染miR-138-5p mimics 和pcDNA-con)、H/R+miR-138-5p+KLHDC10 过表达载体(pcDNAKLHDC10)组(共转染miR-138-5p mimics 和pcDNAKLHDC10),转染4 h 后,补充新培养液继续培养至48 h,qRT-PCR 确认转染成功后进行标记,用于后续的实验研究。若未达到转染效率的要求,则更换质粒或DNA、改变转染条件等进行重新转染,直至达到转染要求为止,方可用于后续试验。
1.2.2 qRT-PCR 实验 用总RNA 抽提试剂盒提取需要检测的细胞总RNA,并用逆转录试剂盒在冰上将其合成互补DNA(cDNA),保存备用。用qRTPCR 试剂盒检测cDNA 中miR-138-5p 和KLHDC10的mRNA 表达水平。 miR-138-5p 正向引物ACACTCCAGCTGGGAGCTGGTGTTG,反向引物GT‑GCAGGGTCCGAGGT;U6 正向引物CTCGCTTCG‑GCAGCACA,反向引物AACGCTTCACGAATTTGC‑GT;甘油醛-3-磷酸脱氢酶(GAPDH)正向引物ACACCCACTCCTCCACCTTT, 反 向 引 物TTACTCCTTGGAGGCCATGT。KLHDC10 引物由上海吉玛生物公司设计合成。
1.2.3 蛋白质印迹法(Western blotting) 将需要检测的细胞用细胞总蛋白质提取液(1 mL/10 cm2)充分地裂解提取总蛋白。用蛋白变性后的上清液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDSPAGE),并加入等量的Marker。电泳结束后,切下目的蛋白条带,将胶上的蛋白用转膜仪转移至聚偏二氟乙烯(PVDF)膜上。再用2.5%的脱脂奶粉将膜进行封闭处理1 h,浸入各个一抗溶液(1∶500~1 500稀释)中低温孵育过夜(4 ℃),在浸入二抗(1∶1 000稀释)中37 ℃孵育2 h。用超敏发光试剂盒对膜进行显影曝光。结果以β-肌动蛋白(β-actin)为内参,凋亡相关蛋白细胞周期蛋白D1(cyclin D1)、活化胱天蛋白酶-3(cleaved-caspase-3)等目的蛋白灰度与内参蛋白灰度的比值表示蛋白表达水平。
1.2.4 CCK-8 实验 将需要检测的细胞104个/孔置于96 孔板中,再加入10µL的CCK-8溶液,在37 ℃、5%二氧化碳的培养箱中反应4 h,结束后在酶标仪上检测细胞的吸光度(A450)。细胞存活率(%)为(1-A450样品/A450对照)×100%。
1.2.5 流式细胞术实验 使用Annexin V-FITC/PI双染凋亡检测试剂盒检测细胞凋亡。将需要检测的细胞用预冷的磷酸缓冲盐溶液(PBS)洗涤3 遍。用结合缓冲液悬浮细胞,然后加入Annexin V-FITC和PI各5µL,避光反应结束后进行流式细胞仪检测分析细胞的凋亡。凋亡率为Annexin V-FITC阳性细胞比率与PI阳性细胞比率之和。
1.2.6 双荧光素酶报告基因检测实验 首先根据starbase预测到的miR-138-5p与KLHDC10之间存在的结合位点,设计miR-138-5p 应答的KLHDC10 3´非编码区(3´UTR)片段,将其克隆至载体pYr-Mir‑Target,构建荧光素酶报告基因载体。将H9C2 细胞培养至汇合度约50 %收集细胞。将miR-con、miR-138-5p 与野生型(WT)KLHDC10、突变型(MUT)KLHDC10分别共转染至H9C2细胞,标记为miR-con组WT 细胞、miR-con 组MUT 细胞、miR-138-5p 组WT 细胞、miR-138-5p组MUT 细胞。转染结束后,培养至对数生长期,收集细胞用报告基因细胞裂解液充分裂解,加入萤火虫荧光素酶检测液,测定荧光素酶活性,取出再加入海肾荧光素酶检测液,测定荧光素酶活性。结果以萤火虫荧光素酶的活性为内参,海肾荧光素酶的活性与萤火虫荧光素酶的活性比值表示样本目的基因的活性。
1.3 统计学方法使用PEMS3.2 进行统计学分析,GraphPad Prism 6.0 进行相关数据的图片绘制,计量资料用±s表示,两组数据比较采用两独立样本t检验,多组间数据比较采用单因素方差分析和SNKq检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 H/R H9C2 细胞中miR-138-5p 和KLHDC10的表达水平H/R 组于对照组,miR-138-5p 的mRNA 表达水平显著降低,KLHDC10 的mRNA 和蛋白表达水平均显著升高(均P<0.05),见表1。
表1 缺氧/复氧(H/R)H9C2细胞中miR-138-5p和Kelch重复蛋白(KLHDC10)的表达变化/± s
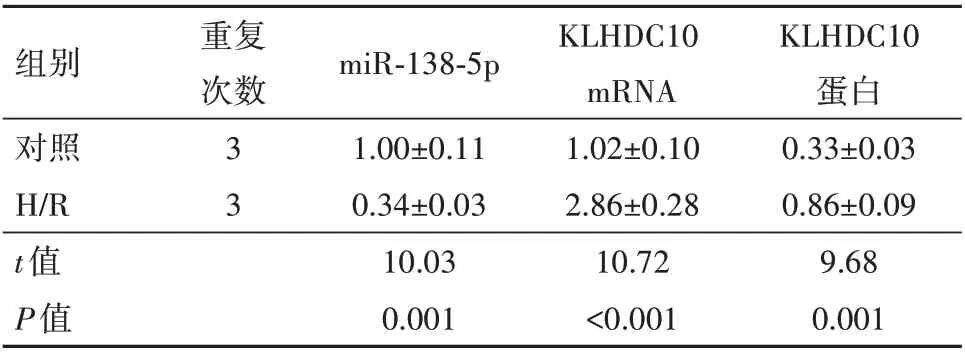
表1 缺氧/复氧(H/R)H9C2细胞中miR-138-5p和Kelch重复蛋白(KLHDC10)的表达变化/± s
组别对照H/R t值P值重复次数33 miR-138-5p 1.00±0.11 0.34±0.03 10.03 0.001 KLHDC10 mRNA 1.02±0.10 2.86±0.28 10.72<0.001 KLHDC10蛋白0.33±0.03 0.86±0.09 9.68 0.001
2.2 高表达miR-138-5p 对H/R 处理的H9C2 存活率、凋亡及相关蛋白表达的影响H/R 组于对照组,miR-138-5p mRNA 表达水平显著降低,cyclin D1 蛋白表达水平显著降低,cleaved-caspase-3蛋白表达水平显著升高,细胞存活率显著降低,细胞凋亡率显著升高;H/R+miR-138-5p 组于H/R+miR-con 组,miR-138-5p mRNA、cyclin D1 蛋白、细胞存活率均显著升高,cleaved-caspase-3 蛋白、细胞凋亡率均显著降低(均P<0.05)。见图1、表2。
表2 高表达miR-138-5p对缺氧/复氧(H/R)处理的H9C2细胞存活率、凋亡率、miR-138-5p、cyclin D1、cleaved-caspase-3蛋白表达的影响/± s
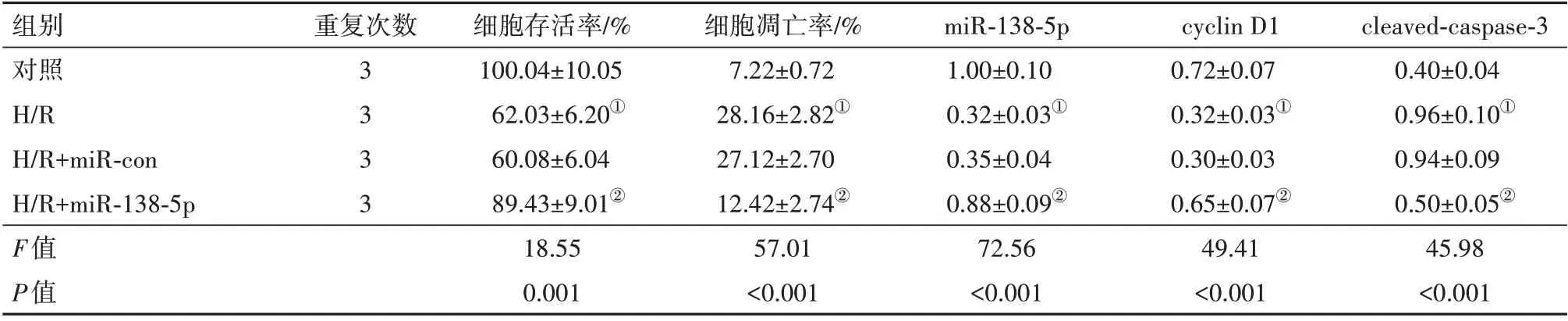
表2 高表达miR-138-5p对缺氧/复氧(H/R)处理的H9C2细胞存活率、凋亡率、miR-138-5p、cyclin D1、cleaved-caspase-3蛋白表达的影响/± s
注:cyclin D1为细胞周期蛋白D1,cleaved-caspase-3为活化胱天蛋白酶-3。①与对照组比较,P<0.05。②与H/R+miR-con组比较,P<0.05。
组别对照H/R H/R+miR-con H/R+miR-138-5p F值P值cleaved-caspase-3 0.40±0.04 0.96±0.10①0.94±0.09 0.50±0.05②45.98<0.001重复次数3333细胞存活率/%100.04±10.05 62.03±6.20①60.08±6.04 89.43±9.01②18.55 0.001细胞凋亡率/%7.22±0.72 28.16±2.82①27.12±2.70 12.42±2.74②57.01<0.001 miR-138-5p 1.00±0.10 0.32±0.03①0.35±0.04 0.88±0.09②72.56<0.001 cyclin D1 0.72±0.07 0.32±0.03①0.30±0.03 0.65±0.07②49.41<0.001
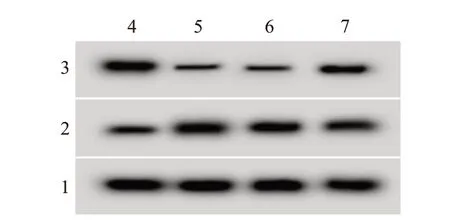
图1 蛋白质印迹法检测高表达miR-138-5p对缺氧/复氧(H/R)处理的H9C2细胞cyclin D1、cleaved-caspase-3蛋白表达的影响
2.3 低表达KLHDC10 对H/R 处理的H9C2 存活率、凋亡及相关蛋白表达的影响H/R+si-KLHDC组于H/R+si-con 组,细胞存活率显著升高[(83.45±8.35)%比(61.86±6.15)%](t=6.25,P<0.001),细胞凋亡率显著降低[(11.72±1.16)%比(28.01±2.81)%](t=16.07,P<0.001);KLHDC10 和cleaved-caspase-3蛋白表达显著降低,cyclin D1蛋白表达显著升高,见图2、表3。
表3 低表达KLHDC10对缺氧/复氧(H/R)处理的H9C2细胞中KLHDC10、cyclin D1、cleaved-caspase-3蛋白表达的影响/± s

表3 低表达KLHDC10对缺氧/复氧(H/R)处理的H9C2细胞中KLHDC10、cyclin D1、cleaved-caspase-3蛋白表达的影响/± s
注:KLHDC10为Kelch重复蛋白,cyclin D1为细胞周期蛋白D1,cleaved-caspase-3为活化胱天蛋白酶-3。
cleavedcaspase-3 0.95±0.10 0.52±0.05 6.66 0.003组别H/R+si-con H/R+si-KLHDC10 t值P值重复次数33 KLHDC10 0.84±0.08 0.42±0.04 8.13 0.001 cyclin D1 0.32±0.03 0.62±0.06 7.75 0.001

图2 蛋白质印迹法检测低表达KLHDC10对缺氧/复氧(H/R)处理的H9C2细胞中KLHDC10、cyclin D1、cleaved-caspase-3蛋白表达的影响
2.4 miR-138-5p 靶向KLHDC10,调控KLHDC10的表达通过生物信息学在线靶基因预测软件star‑base 预测miR-138-5p 和KLHDC10 的结合区域,见图3。miR-138-5p 组于miR-con 组,WT KLHDC10 的H9C2 细胞荧光素酶活性显著降低[(0.31±0.03)比(1.00±0.11)](t=10.48,P<0.001),MUT KLHDC10 的H9C2 细胞荧光素酶活性变化不大[(1.06±0.12)比(1.09±0.13)](t=0.29,P=0.784)。miR-138-5p 明显负向调控KLHDC10 蛋白表达水平,miR-138-5p 组KLHDC10 表达量(0.32±0.03)低于miR-con 组(0.84±0.09)(P<0.05),抗miR-138-5p(anti-miR-138-5p)组KLHDC10 表达量(1.14±0.11)高于阴性对照(antimiR-con)组(0.87±0.10)(P<0.05)(F=45.31,P<0.001)。

图3 在线靶基因预测软件starbase预测Kelch重复蛋白(KLHDC10)与miR-138-5p的结合区域
2.5 过表达KLHDC10 可逆转miR-138-5p 对H/R处理的H9C2 存活率、凋亡及相关蛋白表达的影响H/R+miR-138-5p+pcDNA-KLHDC10 组于H/R+miR-138-5p+pcDNA-con 组,细胞存活率显著降低[(65.13±6.51)% 比(89.43±9.01)%](t=3.79,P=0.019),细胞凋亡率显著升高[(34.20±3.42)%比(12.49±5.28)%](t=5.98,P=0.004);KLHDC10 和cleaved-caspase-3 蛋白表达水平显著升高,cyclin D1蛋白表达水平显著降低,见表4。
表4 高表达KLHDC10可以逆转miR-138-5p对缺氧/复氧(H/R)处理的H9C2细胞中KLHDC10、cyclin D1、cleaved-caspase-3蛋白的表达/± s
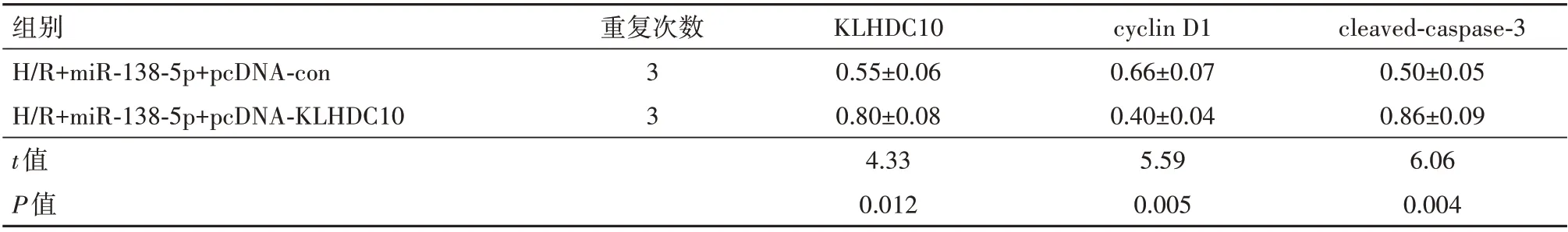
表4 高表达KLHDC10可以逆转miR-138-5p对缺氧/复氧(H/R)处理的H9C2细胞中KLHDC10、cyclin D1、cleaved-caspase-3蛋白的表达/± s
注:KLHDC10为Kelch重复蛋白,cyclin D1为细胞周期蛋白D1,cleaved-caspase-3为活化胱天蛋白酶-3。
组别H/R+miR-138-5p+pcDNA-con H/R+miR-138-5p+pcDNA-KLHDC10 t值P值cleaved-caspase-3 0.50±0.05 0.86±0.09 6.06 0.004重复次数33 KLHDC10 0.55±0.06 0.80±0.08 4.33 0.012 cyclin D1 0.66±0.07 0.40±0.04 5.59 0.005
3 讨论
miRNA 是一种非编码微小RNA分子,普遍与人类各种疾病有关,包括心肌的缺血再灌注损伤[6-8]。但是仍有部分新发现的miRNA 在心肌损伤中的作用尚未清楚。miR-138-5p 是近期在心肌缺血再灌注损伤中发现的一个新的功能miRNA[9]。miRNA在生物中普遍存在,并且其在进化上高度保守。迄今为止,在人类基因组中已鉴定出超过2 000 个miRNA,并且其中超过60%的蛋白质编码基因受miRNA的调控[10-11]。miRNA在多种疾病中发挥重要的病理生理作用[12]。 据报道,miR-138 的失调是心脏和心缺血/灌注损伤的关键因素[13]。Tang 等[9]在研究中报道,miR-138 在脑缺血再灌注细胞模型中和脑缺血再灌注大鼠模型中均具有调控作用,在体外miR-138 可为通过靶向脂蛋白2 促进缺血再灌注细胞的增殖,发挥保护作用。最近,Mao等[14]在研究中发现,miR-138-5p 可作为长链非编码RNAKLF3反义RNA1 的直接作用靶标,通过调节沉默信息调节因子1 参与缺氧诱导的心肌细胞的细胞焦亡过程。这说明,miR-138 在缺血再灌注脑损伤和心肌损伤中均具有重要的功能。这些研究所支持的观点与本研究的实验结果完全相吻合。本实验结果显示,miR-138-5p 在H/R H9C2 细胞中的表达水平异常降低,且过表达miR-138-5p 具有促进H/R H9C2 细胞增殖,抑制凋亡的保护作用。此外,生物信息学预测和双荧光素酶报告基因实验验证验证了miR-138-5p可靶向KLHDC10,这可能与miR-138-5p 的作用机制有关。miR-138-5p 在缺血再灌注心肌损伤中的潜在功能机制的深入探索将为心血管疾病的治疗提供新方向。
炎性因子在病原防御中起着重要的作用,过度的炎性细胞因子释放可能会对个体造成一定的损害,如炎症性肠病、心肌炎和脑梗死[15]。Kelch 家族蛋白在炎症引起的疾病中的作用十分重要[16]。KL‑HDC10 是Kelch 蛋白家族的一员,该家族成员在炎症过程中的作用得到研究的肯定[17],但是KLHDC10在心肌损伤中的作用及与miR-138-5p 之间的关系尚未清楚。Yamaguchi 等[18]报道,KLHDC10 在全身性炎症反应综合征(ystemic inflammatory response syndrome,SIRS)小鼠模型中表达异常升高,敲减KLHDC10 的SIRS 小鼠模型表现出较低的炎性因子释放,提示KLHDC10 是坏死性细胞类型的特定调节剂,可促进TNFα 诱导的SIRS 的发展。这说明KLHDC10 在机体的炎性反应中占据关键地位。于是,该研究假设KLHDC10 在缺氧/复氧心肌细胞的增殖和凋亡中具有调控作用。炎症在心肌缺血再灌注损伤中占有重要地位[19]。心肌缺血再灌注所造成的损伤主要是由炎症和氧化应激引起的心肌细胞的功能损伤。结果本研究的实验结果与假设完全相符合。KLHDC10在H/R H9C2细胞中的表达水平异常升高,且敲减KLHDC10 具有促进H/R H9C2 细胞增殖,抑制凋亡作用。除此之外,过表达KLHDC10还逆转了miR-138-5p在H/R H9C2细胞中的增殖和凋亡调控作用。
综上所述,miR-138-5p 促进缺氧复氧心肌细胞增殖和抑制凋亡,其机制与靶向KLHDC10 相关,为心肌损伤的治疗奠定理论基础。本研究的不足之处为实验结果并未在动物体内和临床中进行验证。
