产酱香芽孢杆菌在酱香大曲中的生产应用研究
2022-03-30邱声强文成兵唐维川赵金松
周 习,云 岭,邱声强,文成兵,唐维川,赵金松,3
(1.四川省川酒集团酱酒有限公司,四川 泸州 646500;2.四川轻化工大学生物工程学院,四川 宜宾 644000;3.四川省酒业集团有限责任公司,四川 成都 610000)
酱香大曲是酱香型白酒的糖化剂和发酵剂。原料为小麦,经碾碎后拌入母曲和水压制成型,放入曲房培养,培菌过程中,温度可达60 ℃以上,曲房培养40 余天后即可出房储存。大曲中主要有细菌、霉菌、酵母菌3 类微生物,其中细菌占绝对优势,长期含量在80 %以上,主要包括芽孢杆菌、乳酸菌和醋酸菌,耐高温细菌是产生酱香风味的重要因素之一,霉菌以根霉、毛霉和曲霉为主,主要参加淀粉的糖化、液化,同时产多种酶类,促进曲坯成熟,酵母菌主要起酒化和酯化的作用,由于酵母菌耐热性差,故酱香大曲中酵母菌含量较少。
微生物的代谢产物是大曲中风味组分的主要来源,小麦中的淀粉、蛋白质等物质经过一系列的代谢途径生成代谢产物,从而形成了大曲中复杂的风味成分。乙偶姻是酱香大曲中重要的中间体,本身具有令人愉快的奶香气,是四甲基吡嗪等健康因子的前体物质。为改善大曲品质,本实验利用酱香大曲中筛选出的产乙偶姻芽孢杆菌制备菌液并应用于大曲生产中,从而改善酱香大曲风味组分含量与多样性,改善大曲品质。
1 材料与方法
1.1 材料、试剂及仪器
菌株:由四川省某酱酒公司成品曲中筛选得到的产乙偶姻地衣芽孢杆菌。
耗材:小麦、母曲、稻草等原辅料都由四川省某酱酒公司提供。
仪器设备:PC-16A水分测定仪,上海浦春计量仪器有限公司;FA1204B 分析天平,上海佑科仪器仪表有限公司;7890A-5975B 气相色谱质谱联用仪,美国Agilent。
1.2 试验方法
1.2.1 酱香大曲生产流程
流程如下:

将润粮后的小麦投入生产设备中碾碎为梅花瓣状,使细粉为40%~60%,然后在小麦粉中加入5%~8%的母曲,实验组按照原料2.5%比例在小麦粉中加入菌液,空白组则不添加菌液,然后加水拌和,使曲坯水分维持在37%~38%,由机器压制成型,收汗后转入曲仓培菌发酵,中途翻3 次曲,培菌40~45 d后刮曲出仓。
1.2.2 强化曲与普通曲水分检测
在实验仓上中下层,每层各取5 块样品(四周和中间各1 块),粉碎后混匀,通过五分法取样,利用水分测定仪检测大曲水分。
1.2.3 强化曲与普通曲酸度检测
按照QB/T 4257—2011 酿酒大曲通用分析方法,称取10 g 绝干样品,放入500 mL 烧杯中,用蒸馏水浸泡0.5 h,每隔5 min 搅拌1 次,过滤后取样液20 mL 加入30 mL,利用NaOH 进行滴定,通过pH计检测,pH8.2 时停止滴定,记录消耗的NaOH 体积并计算酸度。
1.2.4 强化曲与普通曲糖化力检测
按照QB/T 4257—2011 方法,取10 g 绝干样品,与20 mL 乙酸-乙酸钠缓冲液混合加入250 mL烧杯中,加水定容至200 mL,置于35 ℃恒温水浴1 h,随后过滤,滤液为大曲样液,备用。
取25 mL 可溶性淀粉溶液,加入5 mL 大曲样液和1 mL 20%NaOH 溶液。取5 mL 为空白液,用葡萄糖滴定。用另一试管取25 mL 可溶性淀粉溶液,加入5 mL 大曲样液,35 ℃糖化1 h 后加入1 mL 20 % NaOH 终止反应,吸取糖化液通过斐林法滴定。
1.2.5 成品曲风味化合物检测
样品预处理:萃取头型号为50/30 μm DVB/CAR/PDMS,取0.5 g大曲加入样品瓶中,加入1.5 mL饱和NaCl,60 ℃恒温水浴吸附30 min,再插入进样口解吸5 min,解吸温度250 ℃。
色谱条件:DB-WAX 色谱柱(30 m×0.25 mm,0.25 μm);He 作为载气,流速控制为1 mL/min;采取程序升温方案:起始温度40 ℃,维持3 min,以5 ℃/min 速度 升至80 ℃,再 以10 ℃/min 升 至230 ℃/min 维持7 min;汽化室温度为250 ℃;不分流进样。
质谱条件:选择电子轰击电离离子源(EI),电子倍增器电压为350 V,电子能为70 eV,发射电流为200 μA,接口温度为250 ℃,离子源温度为200 ℃,质量范围控制在33~450 u。
定量方法:以2-辛酮作为内标(加入样品的终质量浓度为0.053 g/L),样品中鉴定的挥发性化合物以与2-辛酮质量浓度之比计算。
2 结果与分析
2.1 强化大曲与普通大曲水分含量比较
大曲中的水分在发酵过程中能够调节品温,吸收微生物生长代谢释放的热量,避免微生物细胞内温度骤然上升而被灼伤,同时为微生物的生长代谢、孢子的发芽提供了必要条件。除此,不同水分对不同微生物的繁殖能力和酶的生成量也有影响。通常,酱香大曲出房时的水分应低于14%。
如图1 所示,强化曲与普通曲出房水分均小于14 %,强化曲水分大约比普通曲水分高2.1%。发酵前期,微生物大量繁殖,生长代谢和产生的热量使得曲坯内的水分快速消耗,且水是微生物生长繁殖的营养物质,此时需要大量的水分。大曲发酵完成后,需保持内部微生物结构稳定,水分控制在14%以下,微生物很难继续生长发育。
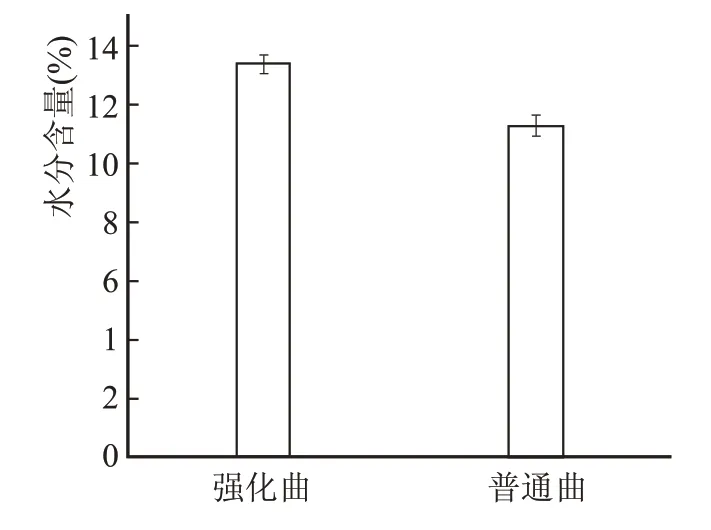
图1 不同大曲水分含量比较
2.2 强化大曲与普通大曲酸度比较
酸度是检测大曲内有机酸含量高低的指标,是评价大曲质量的重要指标之一。大曲中的有机酸主要来源于微生物代谢,淀粉、蛋白质及脂肪降解。通常要求成品曲酸度在1~3.5 mmol/10 g。
由图2 可以看出,强化曲酸度略高于普通曲0.3 mmol/10 g。酱香大曲微生物中细菌占比超过80%,又称细菌曲,细菌种类广、数量多是造成酱香大曲酸度高的原因之一。加入强化菌液后,直接增加了大曲中细菌数量,因此大曲酸度有小幅上升。
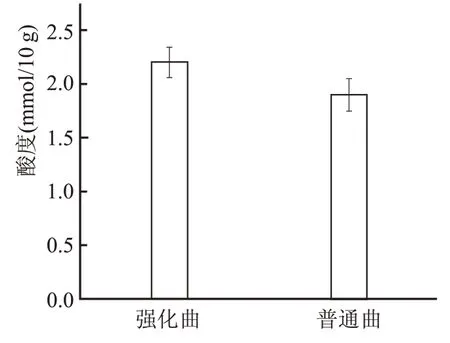
图2 不同大曲酸度比较
2.3 强化大曲与普通大曲糖化力比较
糖化力是判断曲对淀粉的糖化能力强弱的指标,酱香大曲糖化力通常在100~300 U。
如图3 所示,强化曲糖化力高于普通曲20 U,加入强化菌液后,大曲糖化力得到明显提升。
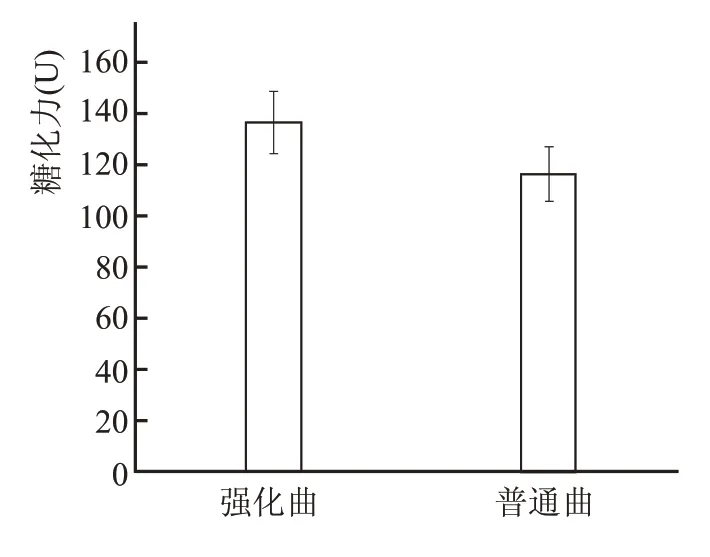
图3 不同大曲糖化力比较
2.4 强化大曲与普通大曲挥发性风味成分比较
气相色谱是一种能够快速完成信号采集、处理并制成图谱的技术,现已广泛应用于食品、医疗检验领域。通过顶空固相微萃取结合气相色谱质谱仪联用技术,对酱香大曲中挥发性风味成分进行检测,定量结果如表1所示,总离子流图见图4。
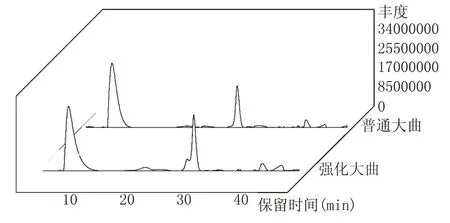
图4 普通大曲和强化大曲挥发性风味成分总离子流图
结合图4 与表1 分析,通过HS-SPME-GC/MS在酱香大曲中共检测到80 种挥发性风味化合物。普通大曲检测到50 种挥发性风味成分,其中醇类11 种、芳香类8 种、醛类2 种、酸类4 种、酮类3 种、烯类1 种、酯类11 种、其他类10 种。强化大曲检测到59 种挥发性风味成分,其中醇类14 种、芳香类3种、醛类8 种、酸类6 种、酮类4 种、烯类2 种、酯类14 种、其他类8 种。挥发性风味化合物含量占比及化合物种类数量如图5所示。
结合表1 与图5 可知,强化大曲挥发性风味成分多样性与含量皆高于普通大曲,强化曲挥发性风味成分含量约为6372.58 mg/L,普通曲含量为4874.27 mg/L。两类大曲中醇类与其他类化合物含量都相对较高,占38%~47%,随后是酯类、醛类、酸类、酮类、烯类等化合物含量均相对较低,为1%~2%,酯类、醇类种类较多,为11~14种。
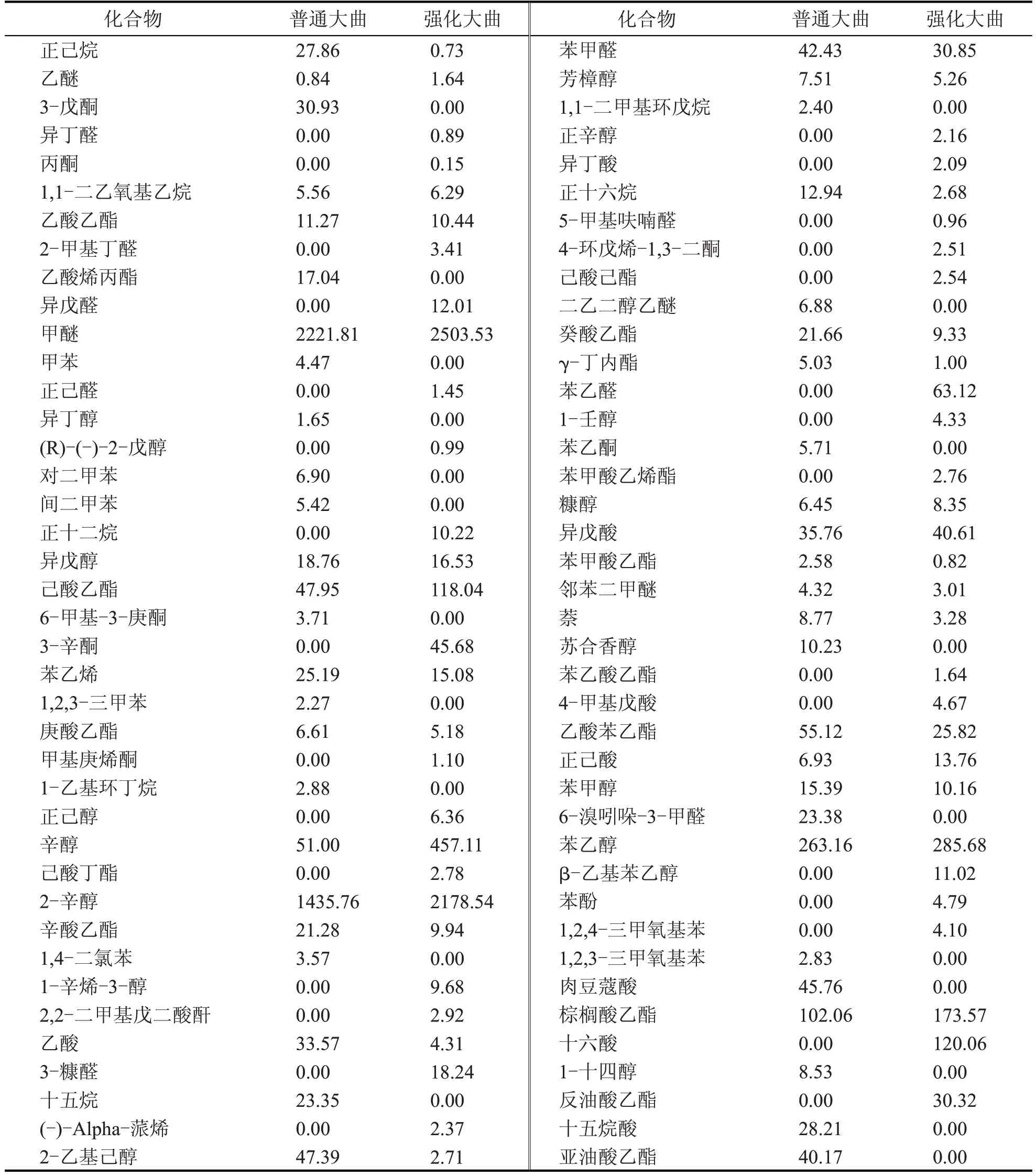
表1 普通大曲和强化大曲中挥发性风味成分 (mg/L)
3 结论
本研究通过添加产酱香芽孢杆菌制备强化酱香大曲,达到提高大曲品质的效果。实验结果表明,强化曲出房水分为13.6%,符合出房水分要求,酸度为2.2 mmol/10 g,相较于普通曲高出0.3 mmol/10 g,强化曲糖化力为136 U,相较于普通曲约提升17%。通过HS-SPME-GC/MS 对大曲挥发性风味成分进行定性定量检测,结果表明,强化曲挥发性风味成分达59 种,比普通曲多出9 种挥发性风味成分,风味成分含量也有较为明显提升,强化曲挥发性风味成分含量6372.58 mg/L,约比普通曲高1500 mg/L。添加强化菌液,强化曲在理化指标以及风味成分含量与多样性方面都得到了明显提升,能够有效改善大曲品质。
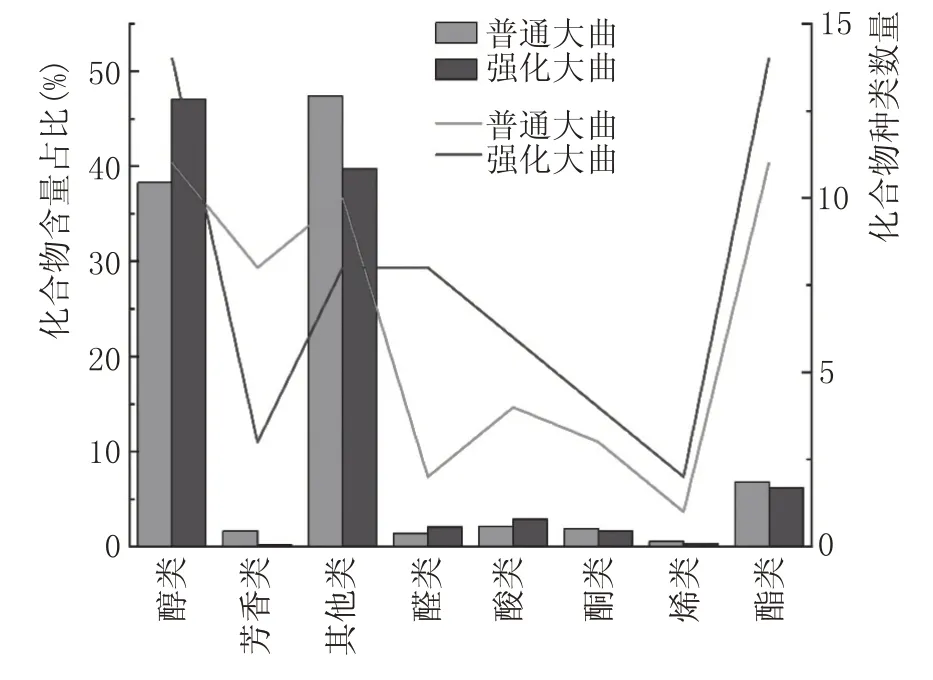
图5 挥发性风味成分含量比例及种类数量
