大麻二酚制备的研究进展
2022-03-30周静莹张伟
周静莹 张伟


【摘 要】 大麻二酚(Cannabidiol,CBD)是从大麻属植物中分离得到的单体,具有广泛的药理作用且没有成瘾性,越来越受药物学家的关注。文章就CBD的植物提取、化学合成、生物合成等制备研究进展进行概括和归纳,以便为CBD制备提供参考。CBD植物提取方法主要有热回流提取法、超临界流体萃取法、超声辅助溶剂法等。化学全合成主要是以2,4-二羟基-6-戊烷基苯甲酸甲酯为原料,在氢氧化钾催化下经过一系列化学反应,重结晶得到CBD;化学半合成主要是把大麻二酚酸(Cannabidiol Acid,CBD-A)脱羧后转变为CBD。生物合成主要是以己酰辅酶A(hexanoyl-CoA)及其他关键催化酶的作用下生成CBD。
【关键词】 大麻二酚;提取;分离纯化;合成
【中图分类号】R285 【文献标志码】 A 【文章编号】1007-8517(2022)02-0072-08
Research Progress in the Preparation of Cannabidiol
ZHOU Jingying1 ZHANG Wei2*
1.School of Pharmaceutical Science & Yunnan Key Laboratory of Pharmacology for
Natural Products, Kunming Medical University,Kunming 650500,Chian;
2.Kunming Longjin Pharmaceutical CO.,LTD, Kunming 650503,Chian
Abstract:Cannabidiol (CBD) is a monomer isolated from cannabis plants, which has been paid more and more attention by pharmacologists because of its wide range of pharmacological effects and no addiction. In this paper, the research progress of plant extraction, chemical synthesis and biosynthesis of CBD is summarized and summarized in order to provide a reference for CBD preparation. CBD plant extraction methods mainly include hot reflux extraction, supercritical fluid extraction, ultrasound-assisted solvent extraction and so on. The total synthesis of CBD is mainly based on the recrystallization of 2,4-dihydroxy-6-pentanyl methyl benzoate through a series of chemical reactions catalyzed by potassium hydroxide, and the semi-synthesis of CBD is mainly based on the decarboxylation of cannabidiol acid (CBD-A) to CBD. Biosynthesis is mainly to generate CBD by the action of hexanoyl-CoA and other key catalytic enzymes.
Key words:Cannabidiol;Extraction;Purification;Synthesis
大麻(Cannabis Sativa.L.)属一年生草本植物,其茎、花、叶和种子等均具有实用价值,用途十分广泛,大麻及其制品曾广泛应用于人们的生产生活当中[1]。工业大麻是指毒品活性成分四氢大麻酚(tetrahydrocannabinol,THC)干重含量<0.3%的大麻,THC干重含量>0.3%的则称为药用和毒品大麻 (marijuana & hashish)。相关法律规定,THC含量低于0.3%的大麻品种可以种植。目前,我国大麻的生产加工重点已经逐步转向从大麻植物中提取大麻素(CBD),对产品进行深加工,并將其综合开发利用[2]。
大麻二酚是从大麻属植物中分离得到的一种单体,它与四氢大麻酚是同分异构体。THC具有致幻成瘾性,故CBD在一定程度上能抑制这种致幻成瘾性,其结构如下:
研究[3]证实,CBD可治疗自身免疫性疾病、神经系统疾病、代谢综合征、神经精神疾病在内的一系列疾病。英国GW公司已研发出以CBD为主要成分的Sativex和Epidiolex药物,用于治疗癫痫和多发性硬化症(MS)[4]。同时,CBD具有镇静、改善睡眠质量、抗氧化、抗炎、抗痤疮等作用,其应用领域日益广泛,下游产品也不断增加。
1 提取工艺
1.1 酶法提取 酶具有水解作用,能将植物的细胞壁进行破碎,从而使物料中的活性成分、色素等更易被溶剂萃取出来。因此,酶辅助溶剂法可以明显提高工业大麻的提取率[5]。
吴俊锋等[5]人研究了酶辅助溶剂萃取法工艺,分析其前处理方式、酶的种类含量以及酶解时间、液料比、萃取时间等影响因素并改良实验条件,最终确定实验的最佳条件为:将大麻叶在100 ℃的烘箱中加热2 h;用复合植物水解酶(Viscozyme L)和酸性蛋白酶的复合物进行酶解,用量为物料的0.5%,酶解1 h后加入萃取剂正己烷,1000 r/min快速搅拌3 h,将上层的正己烷进行分离,置旋转蒸发仪中,蒸干后去除溶剂,得油状物。按1∶5加入甲醇,零下40 ℃放置1 h,零下6 ℃离心后取出上层清液,加入油状物 10% 的活性炭脱色30 min,过滤,滤液旋蒸后即得富含CBD的浸膏。此条件下浸膏得率达到5.40%,CBD的含量为56.11 mg/g。
赵平岭[6]将工业大麻叶干燥粉碎,按1∶10(g/mL)的比例加入纤维素酶和果胶酶混合液,加入的酶量为相对于工业大麻叶质量浓度的0.5%,摇床内水解后加入正己烷作为萃取剂,搅拌,萃取;取上层清液置旋转蒸发仪中,蒸干,得到油状物;在油状物中油状物/甲醇1∶5比例加入甲醇,于零下40 ℃条件下下静置1 h,静置完毕后离心取上清液,在上清液中加入相对油状物10%质量的活性炭脱色30 min,脱色后过滤,将所得滤液二次旋蒸,旋蒸后产物加入氯仿溶解,有机膜过滤后即可获得CBD溶液。
曹亮等[7]通过对纤维素酶、木质素降解酶、半纤维素酶混合含量和比例的实验及分析,得到较高的CBD的提取率。其工艺为:将工业大麻花叶部分于55~60 ℃ 条件下烘干,粉碎,过120~200目筛,得工业大麻粉。将工业大麻粉末的含水量调至18%~20%,在温度为65~75 ℃,螺杆转速80~120 r/min,膜孔孔径10~30 mm条件下进行挤压膨化,得膨化产物。加水溶解调节温度至35~45℃,pH2.5~4.5,加入纤维素酶、木质素降解酶、半纤维素酶混合酶解,其比例为5∶2∶(1-3),总添加量为0.1%~0.25%。向酶解液中加入石油醚、乙醚、正己烷中一种或多种混合物,浸提,用三相分离机分离得到水相、残渣及有机相。用超滤膜(0.001~0.01μm) 浓缩有机相,得到富含CBD的浸膏,CBD的提取率可达92.31%~96.96%。
张翼等[8]将火麻叶在100 ℃条件下烘干2 h,冷却,按1 mL/g加入纤维素酶、果胶酶、木聚糖酶中的一种或几种,摇床内水解1 h。向水解液中加入正己烷作为萃取剂,1000 r/min 搅拌均匀,分离,得上清液,蒸干得油状物。加入其体积量为油状物5倍的甲醇,-40 ℃静置1 h,-6 ℃进行离心。取上清液加入活性炭脱色 30 min,过滤,取滤液置旋转蒸发仪中,蒸干,即得富含CBD的浸膏。
姚德坤等[9]使用的是内、外切葡聚糖酶和纤维素酶。将新鲜大麻根部、茎部或叶子部位切成2~3 cm左右的小段,干燥1.5~2 h,将干燥后的小段研磨粉碎,过20~40目筛,按料液比1∶5加入酶浓度为0.5 ‰~1.5‰的内、外切葡聚糖酶和纤维素酶,其体积比为1∶1∶1,调节pH至4.5,在40~50 ℃条件下,酶解1~2 h。以75%~95%乙醇为溶剂,200~500 W 微波提取5~10 min,过滤,浓缩得CBD粗提物。加入60%乙醇(其比例为1∶3)于高压处理袋中,在400 MPa条件下,加压提取20~30 min。过滤,重复提取2次,将滤液浓缩,即得膏状物。将膏状物上硅胶层析柱,用乙酸乙酯:氯仿 =5∶1至7∶1洗脱,收集洗脱液真空干燥后得CBD,回收率达90%以上。
1.2 超临界流体提取法 超临界CO2是一种介于气体和液体中间状态的物质,它不仅具有液体的流动性,能萃取某些脂溶性物质;还具有与气体相似的扩散性,超临界CO2萃取技术就是利用这一特性发展而来。这种萃取方法通常需要使用专门的具有三个腔室的“闭环萃取器”完成。
朱元庄[10]将火麻植物的花叶采摘后,在70~100 ℃下干燥 2~3 h,粉碎,采用亚临界萃取装置进行萃取,以20%~40%乙醇为夹带剂,萃取装置溶剂为正丁烷、乙醇或两者不定比例的混合物,用量为花叶质量的5~8倍,萃取温度35~45 ℃,压力0.4~0.6 MPa,萃取时间40~60 min。通过上述操作可得到富含大麻二酚的粗浸膏,将粗浸膏溶于乙醇溶液(乙醇用量为粗浸膏的5~10倍)后低温冬化处理,温度为 -10 ℃~40 ℃,时间45~60 min,将低温处理后的溶液进行离心(4500~6000 r/min离心20~30 min)或过滤。取上清液,加入活性炭(用量为粗浸膏质量的6%~10%)进行脱色,旋转蒸发除去乙醇,可得富含CBD 的火麻浸膏。
项伟等[11]将大麻花叶在 120 ℃条件下干燥 0.5~4 h,粉碎至50目以上,在30~55 ℃、13~30 MPa 条件下采用CO2超临界萃取1~9 h(采用湿法,上样前先用 1BV 的磷酸缓冲液进行柱平衡,再用 2BV 10% 的乙醇溶液进行柱平衡),回收CO2,得大麻花叶的初提物。将初提物溶解于10倍体积的乙醇或甲醇中,精细过滤除去杂质,蒸干溶剂后备用。再上苯乙烯大孔吸附树脂或层析硅胶,用不同梯度浓度的乙醇洗脱(浓度分别为25%、35%、45%、55%、65%、75%、85%、95%),收集洗脫液,蒸干后得CBD粗品。在此工艺技术条件下,不仅提高了CBD的含量,同时也降低了THC的含量。
高宝昌等[12]将汉麻成熟期的花叶在自然条件下晾干或在30~60 ℃条件下烘干1~4 h去除水分,粉碎,用超临界CO2萃取CBD,在45 ℃,压力30 MPa条件下萃取3 h,得到大麻二酚浸膏。将大麻二酚浸膏溶解于无水乙醇,离心处理并收集上清液,加入大孔吸附树脂(NKA-Ⅱ、H-103、DM-130、X-5、D101 的一种或几种)中,在25 ℃下震荡12 h,用60%乙醇洗脱。重复以上步骤,浓缩后得大麻二酚浓缩液。将浓缩液装入硅胶分离柱,以石油醚/乙酸乙酯比例95∶5进行洗脱,收集CBD馏分,减压浓缩后得CBD纯化液。
孙川[13]取工业大麻的花、叶子、麻糠(去除麻籽)中的一种或几种作为原料,将其粉碎至40~100目,然后在80~160 ℃下干燥 0.5~1 h,再将粉碎原料进行超临界CO2萃取,其萃取温度为30~50 ℃,压力10~30 MPa,萃取1~4 h得大麻二酚初提浸膏。将初提浸膏加热至40~100 ℃,分子蒸馏(加热温度80~200 ℃,真空度1.33~1999.8 Pa)得CBD富集物。最后。以大孔树脂或 MCI 树脂(或 C18 硅胶)为固定相,超临界CO2为流动相,乙醇为夹带剂,超临界二氧化碳和乙醇质量比为85∶15至98∶2,分离纯化,得到无THC且纯度大于99%的CBD。
1.3 超声辅助溶剂法提取 将有机溶剂作为提取溶剂加入到大麻植物原料中,在超声条件下混合数分钟,可以使大麻素等转移到有机溶剂中,对大麻酚类物质进行提取。
高宝昌等[14]为了确定超声辅助溶剂法提取大麻二酚的最佳条件,考察了该提取方法中多种因素对提取率的影响,最终确定最优条件为:以无水甲醇作为提取溶剂,超声时间15 min,料液比为1∶20,提取次数为3次。该方法操作简单且高效、提取完全。将提取物上ODS柱,以甲醇∶水=78∶22为流动相进行等度洗脱,分离出大麻二酚。
赵立宁等[15]将大麻植株干燥后粉碎后,溶于正己烷-乙酸乙酯 (v/v=9∶1) 的混合溶剂中进行超声提取,按提取液:KOH溶液(质量分数为5%或10%)=5∶1体积比混合,萃取静置后得到上、中、下三层分别为有机相、沉淀相和水相,上下两层均含有CBD。将上层有机相在60 ℃条件下旋干2~3 min,下层水相在80 ℃条件下旋干10~20 min后得到固体,水洗即得CBD。该方法简单,易于实现工业化,且目标产物的纯度可达84%~90%,富集率可达80%。
时圣岩[16]将从大麻花叶中提取的粗品溶于水或乙腈中,经超声、过滤后,取其滤液。将滤液泵入以十八烷基键合硅胶为固定相,以乙腈和水的混合溶液(乙腈和水的体积比为 20∶80至40∶60)为流动相的动态轴向压缩柱进行分离,利用紫外检测器在220 nm检测,并收集保留时间在155~240 min的馏分,该馏分就是CBD。将收集到的馏分进行减压旋蒸浓缩,冷却干燥后经HPLC分析,CBD纯度高达 99%。
1.4 热回流提取法提取 将有机溶剂作为提取溶剂加入到大麻植物中,热回流数小时,使大麻中部分成分转移到有机溶剂中,从而对大麻植物中的活性物质进行提取。
王昆华等[17]将大麻粉碎,用60%~70%乙醇溶液回流提取2~3次,第一次提取加样品质量7~8倍体积的乙醇溶液,后两次可加5~6倍质量体积的乙醇溶液,每次提取时间均为1.5~2.5 h,合并提取液并进行浓缩,即得流浸膏。加入流浸膏体积2~3倍的水,再用NaOH、三乙胺、氨水或三乙醇胺水溶液等碱性溶剂调pH=11~12,回流提取2~3次。弃濾渣,合并滤液,再加稀HCL调pH=7,再加入等体积的氯仿-石油醚(v/v=1∶1-1∶2)萃取3~4次,将CBD萃取到有机相中,回收有机溶剂得大麻二酚粗膏。加入20%~30%乙醇,过聚酰胺柱,依次用纯净水、40%~50%乙醇、70%~80%乙醇洗脱,收集含大麻二酚洗脱液,浓缩后得聚酰胺层析大麻二酚浓缩物。再上氧化铝柱,依次用体积比为1∶3的氯仿-石油醚和体积比为8∶1∶1或10∶0.5∶2的氯仿-甲醇-四氢呋喃洗脱,收集含CBD的洗脱液进行浓缩得CBD粗品。甲醇溶解所得CBD粗品,过氨基键合硅胶柱(氰基键合硅胶柱或苯基键合硅胶柱),加压后进行柱层析。首先,用20%甲醇平衡、40%~50%甲醇洗脱2~3个体积柱后,用65%~70%甲醇洗脱,将收集含CBD的洗脱液浓缩。最后,浓缩物用丙酮溶解,加入冰醋酸,结晶、过滤,低温干燥得CBD。运用此方法得到的产品纯度高,可达98%,回收率高,可用于工业化推广。
栾云鹏[18]以工业大麻为原料,干燥后粉碎至花叶粗粉,将粗粉加入3~10倍体积无水乙醇、95%乙醇、石油醚中的一种或几种,60~80 ℃条件下热回流,每次回流提取1~3 h,提取2~3次。合并提取液,浓缩,得工业大麻流浸膏。将流浸膏进行大孔树脂层析(大孔树脂包括D101型、AB-8型、XAD-2型等),依次用30%~40%、60%~80%的乙醇洗脱,合并含大麻二酚部分洗脱液,浓缩后得大麻二酚富集物。将富集物进行正相硅胶柱层析,以石油醚:二氯甲烷=(4~15)∶1洗脱,合并含大麻二酚的洗脱液,减压浓缩干燥,得大麻二酚纯品。
高哲等[19]以大麻叶进行热回流法提取CBD,并对其提取工艺进行了优化。通过单因素试验和正交试验分析得出CBD热回流法的最佳提取工艺条件为:火麻叶在60 ℃下烘干至恒重,粉碎过20目筛,以正己烷作为提取溶剂,其料液比为1∶15,在80 ℃下提取3 h,然后冷却,抽滤,旋蒸浓缩得浸膏。优化后此工艺浸膏得率为5.24%,浸膏中CBD的含量为46.16 mg/g。
1.5 分子蒸馏纯化 普通蒸馏和精馏的原理是利用混合物物料体系沸点差来实现液体混合物的分离,其气体与液体一直处于平衡状态。而分子蒸馏是一种特殊的非平衡态蒸馏,它依赖于不同物质平均自由程的差异,可远离沸点操作大幅度节约能耗,同时减少热敏物质的热损伤避免物质分解或聚合。分子蒸馏相较于普通蒸馏相对挥发度更高,更容易实现物质分离,在高真空度下工作时,能有效脱色并去除溶剂、有害金属和化学残留物,在提纯物质等方面更具优势。因此,采用分子蒸馏法对超临界CO2萃取所获得的大麻二酚粗提物进行富集和分离纯化,富集大麻二酚后样品的纯度可达80%[20]。
1.6 树脂吸附法纯化 工业色谱柱是利用普通液相色谱分离原理设计工业色谱柱设备系统,并根据原料分离纯化要求从混合物中提取纯物质,它能够将分子蒸馏得到的CBD产品纯度进一步提高。它在大口径液相色谱柱和大流量进样系统基础上,采用DDS系统多项因素进行优化以达到良好的分离效果,相较于传统柱层析设备其自动化程度、分离效率和生产能力都得到了大幅提升。采用该方法对大麻二酚富集物进行分离纯化时,可以通过调整其工艺参数以获得不同品质的CBD产品,也可获得纯度 99%以上的精品CBD产品[20]。当然,设备目前的主要缺点在于其投资较高,不利于大规模进行生产。
2 化学合成
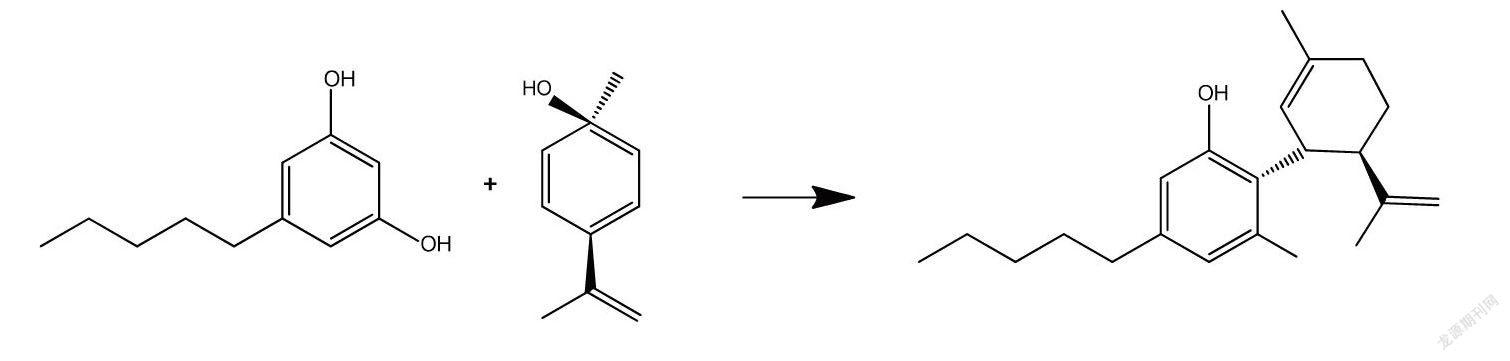
2.1 全合成法 合成大麻二酚最经典是Mechoulam报道[21]的方法,该法的原理是在三氟化硼的催化下,用1,3-二羟基-5-戊基苯和对薄荷-2,8-二烯-1-醇缩合得到CBD,具体如下为:
此方法原料易得,反应简单,故而该方法一直被视作提取CBD产品的经典方法并在较长一段时间内沿用。但该反应体系复杂,有较多异构体和二聚体,后处理麻烦,需要柱层析纯化且收率较低,不宜于放大生产。
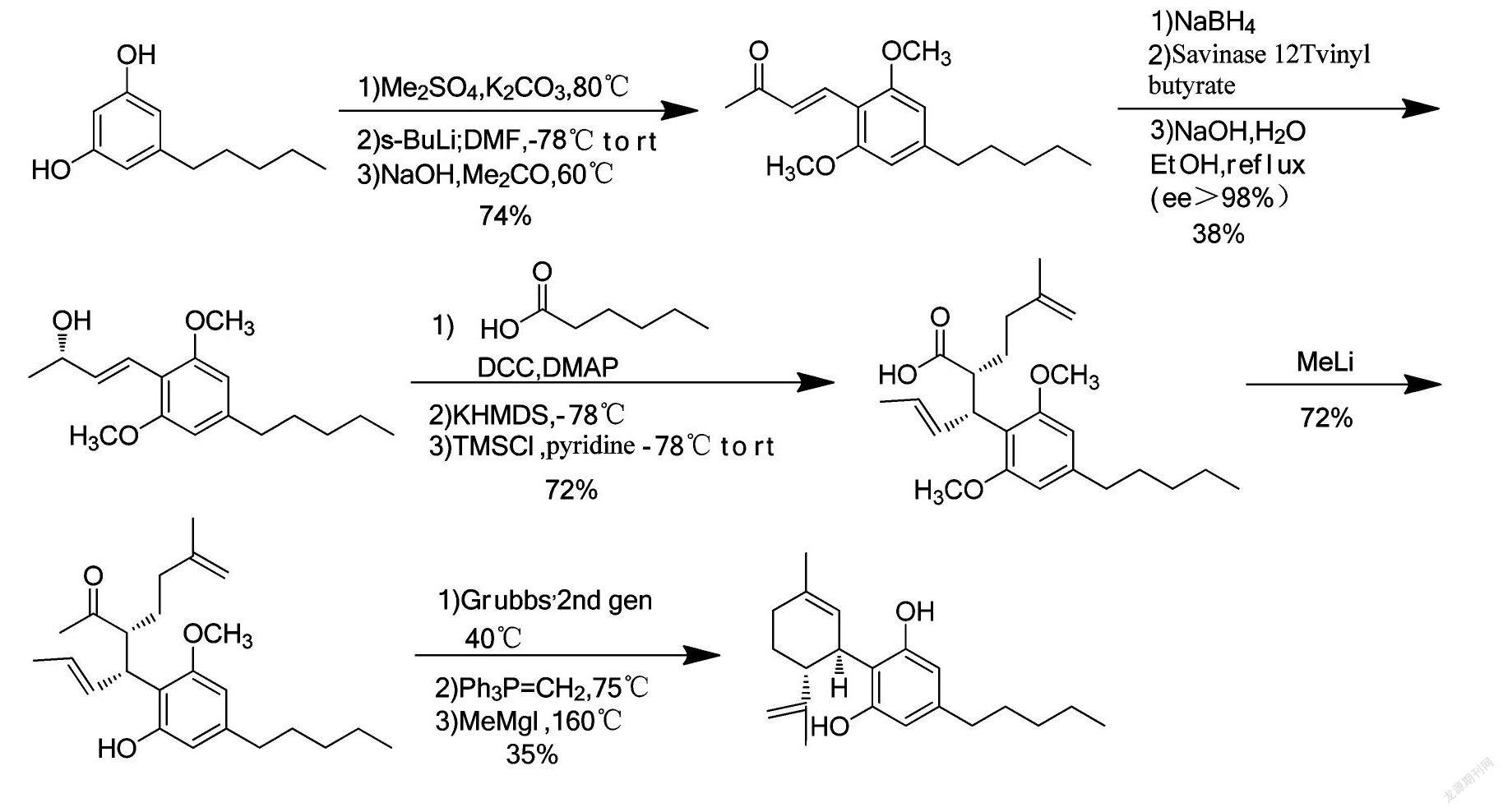
陈剑戈等[22]以2,4-二羟基-6-戊烷基苯甲酸甲酯为原料,在氢氧化钾催化下与N,N-二烷基醇胺进行酯交换后与(1S,4R)-1-甲基-4-(1-甲基乙烯基)-2-环己烯-1-醇在Lewis酸催化下发生偶联反应,经酸碱萃取和重结晶后得到高纯度关键中间体产品,最后经过水解脱羧获得粗品大麻二酚。该方法得到的粗品经过一次重结晶即可得到符合原料药质量要求的大麻二酚,并且制得CBD纯度可达99.88%~99.98%。同时此方法原料及试剂价格低廉,商业获得方式简单,总产率最高可达35%~40%,工艺明显提高。合成路线如下:
Zachary P.Shultz等[23]以1,3-二羟基-5-戊基苯为原料,通过一系列化学反应得到CBD,合成路线如下图所示:
2.2 半合成法
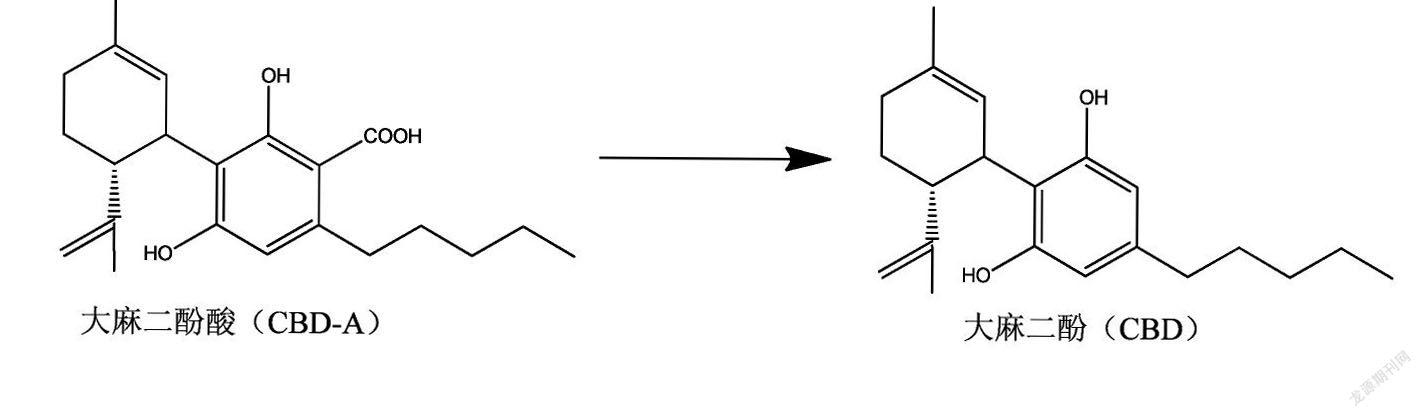
文献报道[24],将食品级氧化物(如ZnO,MgO,CaO或盐、Na2SO4)与粉状大麻生物质混后加热至60 ℃至7 5℃,几天时间大多数大麻生物质中的CBD-A将会转化为CBD。同时,如果将这些试剂加入到CO2大麻提取物中加热至约50 ℃,24 h左右即可完成脱羧。如果将大麻提取物与水、MgSO4和少量苛性碱混合,该混合物75 ℃条件下加热后可在2小时内进行脱羧,转化为大麻二酚。
大麻素类主要的化学形式为大麻酚和大麻酚酸,新鲜大麻组织中大麻素均以酸的形式存在;大麻植株及其提取物在干燥、陈化、加热或焚烧后,大麻酚酸通过非酶促反应脱羧基转化为大麻酚[25] 。
3 生物合成
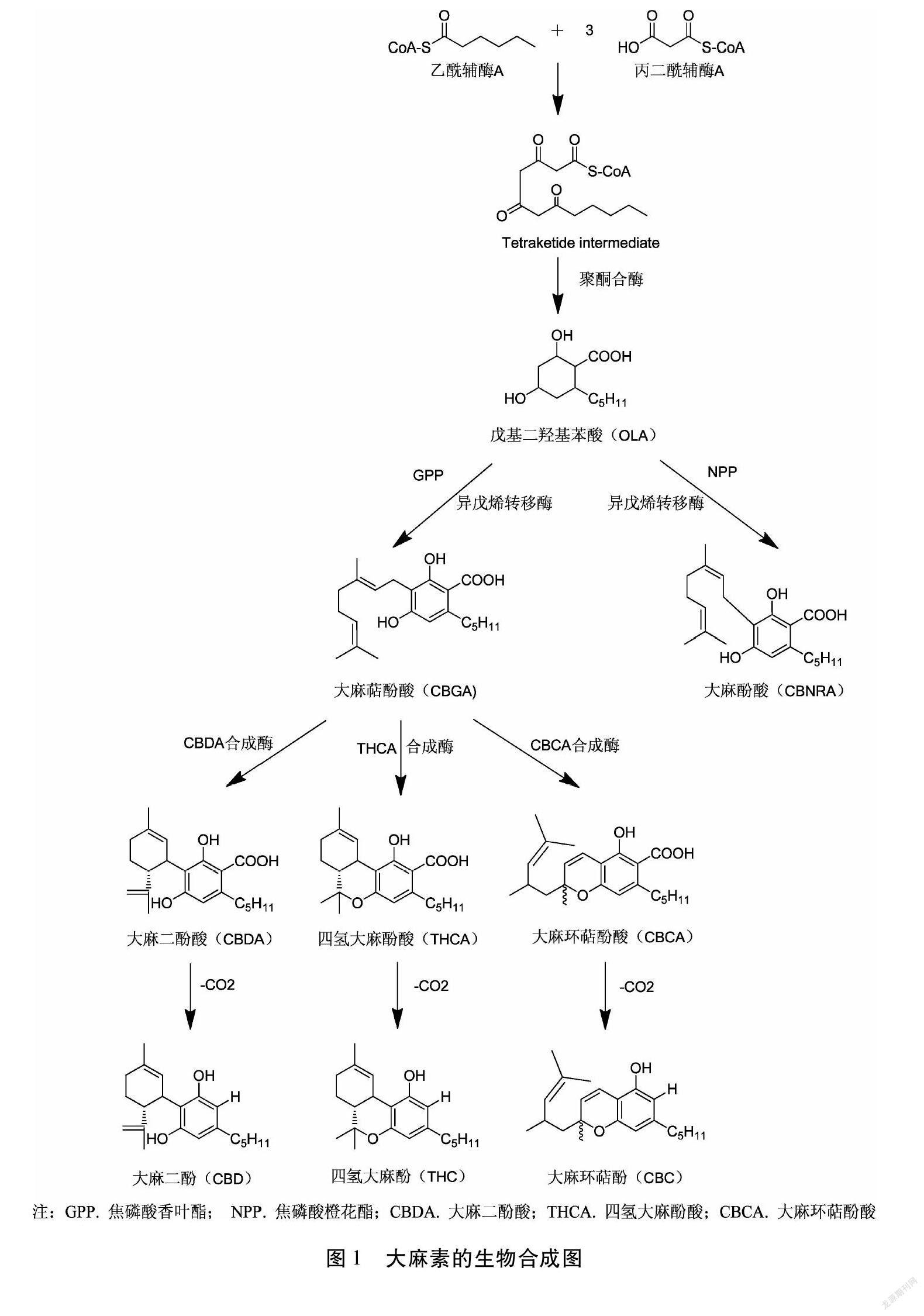
我国对于大麻的种植已经有几千年的历史,但至今才探索出大麻素的生物合成途径(图1)。大麻素的生物合成依赖于聚酮化合物[26]和脱氧木酮糖-5-磷酸/2-甲基赤藓醇磷酸(DOXP/MEP)[27]。这种着聚酮化合物由聚酮合酶(polyketide synthase, PKS)在催化条件下生成,并在生物体中广泛存在。大麻植株中的聚酮合酶首先催化己酰辅酶A(hexanoyl-CoA),隨后与酶活性位点结合,经丙二酰辅酶A(malonyl-CoA)的一系列脱羧缩合后聚酮链延长,酶中间产物闭环并芳构化形成聚酮化合物——戊基二羟基苯酸(olivetolic acid, OLA),它也是大麻素合成的起始底物。DOXP/MEP途径产生的异戊烯基焦磷酸(isopentenyl diphosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP)在合成酶作用下生成焦磷酸香叶酯(geranyl pyrophosphate,GPP);在异戊烯转移酶(prenyltransferase)作用下,OLA既可以接受GPP也可接受GPP的异构体焦磷酸橙花酯(neryl pyrophosphate,NPP),分别形成以下两种单萜类化合物:大麻萜酚酸(CBGA)和大麻酚酸(CBNRA)[28]。同时,由于GPP的活性远大于NPP,因此大麻植株中CBGA含量远大于CBNRA[29]。
CBGA是THCA、CBDA、CBCA三种合成酶的共同底物[30-33],经氧化还原后分别形成THCA、CBDA和CBCA(图1)。Sirikantaramas等人[34]对THCA和CBDA两种合成酶分别进行深入研究后,发现两种酶在功能和结构上具有很高的相似性。两者的相似之处在于其催化反应过程都需要在氧分子的参与下结合FAD,同时释放H2O2。二者的区别在于质子的转移方法,THCA合成酶与CBDA合成酶二者分别从羟基和末端甲基上转移1个质子,通过空间闭合环化形成THCA和CBDA。
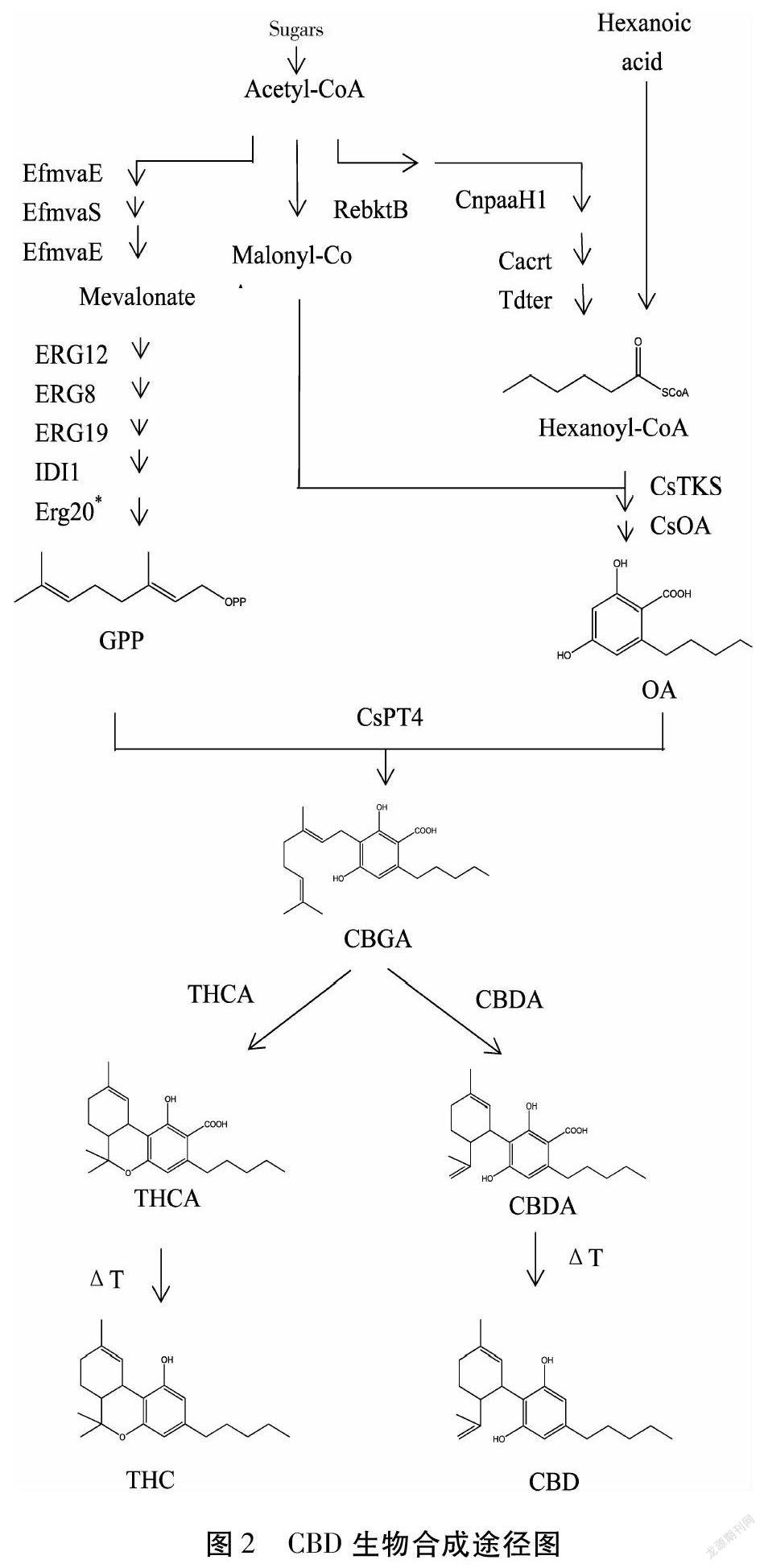
加州大学Jay Keasling课题组罗小舟博士等[35]阐述了CBD生物合成的相关研究。通过酵母菌进行基因改造,将植物体内表达CBD相关的基因片段倒入酵母菌,实现了大麻素的生物全合成。该研究以半乳糖为起始材料,对酵母自身的甲羟戊酸途径(mevalonate pathway)进行改造,引入一条合成己酰辅酶A(hexanoyl-CoA)的代谢途径,在多种不同的外源基因及催化酶的作用下,在酵母中完成大麻素生物合成途径的异源重构,实现了包括CBGA、THCA、CBDA等多种主要大麻素及其衍生物的生物全合成。这个代谢途径如图2。
4 结语
CBD提取技术在较低成本上尽可能提高其提取率和纯度,同时尽可能去除THC残留、避免毒性有机溶剂的使用,确保产品的安全性和环保性。热回流提取法的优点是提取规模容易放大、提取过程容易控制、经济简单,缺点是提取不完全;超临界二氧化碳萃取法提取完全,但设备昂贵、不利于规模放大、且操作复杂、提取成本高。工业化生产一般采用热回流提取法对CBD进行提取。目前的CBD合成方法里,化学合成面临成本高、工艺复杂等诸多挑战,生物合成报道较少,因其具有反应条件温和、反应专一、非资源依赖、环保等优势,是一个新的且具有前景的研究方向,值得进一步探索。
参考文献
[1]
郭丽,王明泽,王殿奎,等.工业大麻综合利用研究进展与前景展望[J].黑龙江农业科学,2014(8):132-134.
[2]孔剑梅,沈琰.工业大麻花叶提取大麻二酚工艺技术综述[J].云南化工,2019(8):1-4.
[3]卢延旭,董鹏,崔晓光,等.工业大麻与毒品大麻的区别及其可利用价值[J].中国药理学通报,2007,23(8):1112-1114.
[4]夏训明.FDA批准大麻二酚用于治疗Lennox—Gastaut综合征和Dravet综合征[J].广东药科大学学报,2018,34(5):642.
[5]吴俊锋,杨晓泉.酶辅助溶剂法提取火麻叶中大麻二酚工艺条件的优化[J].中国酿造,2016(4):79-82.
[6]润贝(安徽)饮料食品有限公司.一种提取工业大麻叶中大麻二酚的方法:CN,201810949509.9[P].2018-08-20.
[7]黑龙江阳光工业大麻研究院.一种酶法结合膜法提取大麻二酚的方法:CN,201910198916.5[P].2019-03-15.
[8]广州市德力渔业有限公司.一种大麻二酚的提取方法:CN,201711488495.7[P].2017-12-30.
[9]大兴安岭林格贝寒带生物科技股份有限公司.从工业大麻中提取大麻二酚(CBD)的新方法:CN,201910358996.6[P].2019-04-22.
[10]晋城市汉恩生物科技有限公司.一种富含大麻二酚的火麻浸膏及其制备方法:CN,201610087327.6[P].2016-02-16.
[11]云南汉木森生物科技责任有限公司.一种富集大麻二酚的方法:CN,201710314318.0[P].2017-05-06.
[12]黑龙江省科学院大庆分院. 一种从汉麻中提取纯化大麻二酚的方法:CN, 201710754364.2[P]. 2017-08-28.
[13]开远伯盛科技有限公司. 一种从工业大麻中提取大麻二酚的方法:CN, 201910369908.2[P]. 2019-05-06.
[14]高宝昌, 孙宇峰, 张旭,等. 工业大麻叶中大麻二酚含量分析研究[J]. 黑龙江科学, 2018(1):61-63.
[15]中国农业科学院麻类研究所. 一种分离大麻二酚的方法:CN, 201910137611.3[P]. 2019-02-25.
[16]凤阳县小岗村永和营养保健品有限公司. 一种采用动态轴向压缩柱制备高纯度大麻二酚的方法:CN,201910265882.7[P]. 2019-04-03.
[17]昆明医科大学第一附属医院. 一种大麻二酚的提取分离方法:CN, 201810111141.9[P]. 2018-02-05.
[18]栾云鹏. 一种大麻二酚的提取分离方法:CN,201910360071.5[P]. 2019-04-30.
[19]高哲,张志军,李晓君,等. 火麻叶中大麻二酚的热回流法提取工艺研究 [J]. 中国油脂,2019,44(3):107-111.
[20]云南化工设计院有限公司. 云南化工设计院有限公司工程开发设计技术资料[Z] .
[21]MECHOULAM R,HANUS L. Cannabidiol:an overview of some chemical and pharmacological aspectes. PartⅠ:chemical aspects[J]. Chem Phys Lip,2002,121(1-2):35-43.
[22]陈剑戈, 张喜通, 文小伟,等. 一种大麻二酚的合成方法:中国,106810426[P].2007-06-09.
[23]SHULTZ Z P,LAWRENCE G A, JACOBSON J M, et al. Enantioselective Total Synthesis of Cannabinoids—A Route for Analogue Development[J]. Organic Letters, 2018,20(2):381-384.
[24]杰里米·莱克尔,约翰·保罗·梅.大麻生物质和大麻提取物中大麻二酚酸的脱羧:CN,109803643[P].2019-05-24.
[25]陈璇, 杨明, 郭鸿彦. 大麻植物中大麻素成分研究进展[J]. 植物学报, 2011(2):71-79.
[26]SHOYAMA Y, YAGO M,NISHIOKA I, et al. Biosynthesis of cannabinoid acids[J]. Phytochemistry, 1975, 14(10):2189–2192.
[27]FELLERMIER M, EISENREICH W, BACHER A, et al. Biosynthesis of cannabinoids. Incorporation experiments with (13)C-labeled glucoses.[J]. Febs Journal, 2010, 268(6):1596-1604.
[28]FELLERMEIER M, ZENK M H . Prenylation of olivetolate by a hemp transferase yields cannabigerolic acid, the precursor of tetrahydrocannabinol[J]. Febs Letters, 1998, 427(2):283–285.
[29]TAURA F, MORIMOTO S, SHOYAMA Y. Cannabinerolic acid, a cannabinoid from Cannabis sativa[J]. Phytochemistry, 1995, 39(2):457-458.
[30]TAURA F, MORIMOTO S, SHOYAMA Y, et al. First Direct Evidence for the Mechanism of DELTA.1-Tetrahydrocannabinolic Acid Biosynthesis[J]. Journal of the American Chemical Society, 1995, 117(38):9766-9767.
[31]TAURA F, MORIMOTO S, SHOYAMA Y. Purification and Characterization of Cannabidiolic-acid Synthase from Cannabis sativa L. [J]. Journal of Biological Chemistry, 1996, 271(29):17411-17416.
[32]MORIMOTO S, KOMATSU K,TAURA F, et al. Enzymological Evidence for Cannabichromenic Acid Biosynthesis[J]. Journal of Natural Products,1997, 60(8):854-857.
[33]MORIMOTOT S, KOMATSU K,TAURA F, et al. Purification and characterization of cannabichromenic acid synthase from Cannabis sativa[J]. 1998, 49(6):1525-1529.
[34]SIRIKANTARAMAS S, MORIMOTOT S, SHOYAMA Y, et al. The Gene Controlling Marijuana Psychoactivity[J]. Journal of Biological Chemistry, 2004,279(38):39767-39774.
[35]LUO X Z, MICHAEL A, REITER, et al. Complete biosynthesis of cannabinoids and their unnatural analogues in yeast[J]. Nature, 2019, 567(7746):123-126.
(收稿日期:2021-06-01 編辑:刘 斌)
