滨海沼泽湿地转化为养殖塘对其碳储量的影响
2022-03-29黄佳芳
曹 琼,黄佳芳,2,罗 敏,谭 季,仝 川*
滨海沼泽湿地转化为养殖塘对其碳储量的影响
曹 琼1,黄佳芳1,2,罗 敏3,谭 季1,仝 川1*
(1.福建师范大学地理科学学院,湿润亚热带生态-地理过程教育部重点实验室,福建 福州 350007;2.福建师范大学,福建省植物生理生态重点实验室,福建 福州 350007;3.福州大学环境与安全工程学院,福建 福州 350116)
以闽江河口为研究区域,配对采集芦苇()湿地、短叶茳芏()湿地和互花米草()湿地的植物、土壤(0~100cm)及由其围垦而成的水产养殖塘沉积物(0~100cm)样品,测定其有机碳含量,计算生态系统碳储量,并估算沼泽湿地围垦造成的碳释放量.结果表明,闽江河口芦苇湿地、短叶茳芏湿地、互花米草湿地生态系统碳储量分别为(152.85±8.88),(151.63±6.33),(155.85±10.82)Mg C/hm2,其转化成的养殖塘沉积物碳储量分别为(112.69±4.26),(128.24±15.81),(118.59±8.26)Mg C/hm2,转化后生态系统碳储量分别下降26.3%、15.4%和23.9%,引发的碳排放分别为(145.49±33.00),(120.66±26.49),(136.76±27.61)Mg CO2-eq/hm2.上述生态系统碳储量下降的64%来自植物碳库的损失,36%来自土壤碳库的减少.滨海沼泽湿地围垦为养殖塘明显降低滨海湿地碳储量,因此,退塘还湿生态恢复可对滨海湿地固碳增汇起到重要作用.
沼泽湿地;养殖塘;碳储量;碳损失;闽江河口
研究表明,滨海湿地是世界上最有效的碳封存环境之一[1].尽管滨海湿地的面积在全球湿地总面积占比仅为3.4%[2],但其年均碳积累速率高达250~ 500g C/m2[3],滨海湿地生态系统在全球碳循环等方面发挥重要作用[4].同时,滨海湿地又是脆弱的生态系统,在全球范围内伴随着气候变化及人类活动的增强,许多滨海湿地已被不可逆转地开发或利用,面积不断萎缩,造成生态系统服务功能的重大损失[5-6].中国自然岸线在70a时间内(1940~2012)下降至原先的40%左右,20世纪90年代以来,为适应发展需要,大量滨海湿地被围垦为水产养殖塘,或经围填海转化为港口码头等其他土地利用方式[7].黄海和渤海地区围填海等开发活动导致50a间潮滩湿地面积消失约65%[8].土地利用方式的转变会直接影响土壤有机碳含量[9].滨海湿地转变为养殖塘后自然植被的消失造成植物生产力的消失,进而造成土壤有机碳储量的降低等[10-11].Kauffman[12-14]提出根据生态系统土地利用/覆盖变化造成的碳储量变化进而评估其造成的碳释放量(Mg CO2-eq/hm2)的计算方法,根据红树林土壤顶部1m的生物量损失当量,墨西哥地区红树林转化为牧牛场所产生的碳储量损失保守估计为1464Mg CO2eq/hm2[12],加勒比海地区废弃虾塘的碳储量仅为红树林碳储量的11%,红树林转化为养虾塘的潜在碳释放量为2244~3799Mg CO2eq/ hm2[13],巴西东北部红树林向虾池转化产生的平均潜在排放量为1390Mg CO2eq/hm2,红树林围垦为养虾塘导致的生态系统碳储量损失达58%~82%,养虾塘的建设造成的土壤碳流失相当于改造区域182a的土壤碳累积量[14].
目前的科学研究虽已对一些土地利用变化对生态系统碳库的影响做了不少研究,但目前的研究内容主要集中在农田[15]、森林[16]、草地[17]等土地利用类型之间,或是红树林的土地利用变化[12-14],对沼泽湿地生态系统内部因产业结构调整和土地利用方式变化后土壤理化性质及有机碳储量变化的研究还鲜见报道.其次,植物碳库作为滨海湿地生态系统碳库中重要的一部分,在目前估算滨海湿地生态系统碳库的研究中仍未得到足够的重视.因此,滨海沼泽湿地转化为养殖塘对滨海生态系统碳库的具体影响仍有待进一步研究.
闽江河口地处我国东南沿海,是中国亚热带区域代表性河口之一.受人类活动的影响,闽江口湿地被大量围垦,其中很大部分转化为水产养殖塘[18].本研究以闽江河口为研究区,选取3种不同优势湿地植物群落形成的滨海感潮沼泽湿地,以及由它们围垦转化成的养殖塘,进行植物和土壤/沉积物采样,陆地生态系统土壤有机碳含量和储量的测定深度多设置为0~1m,这是因为土壤有机碳主要分布在0~ 1m深度范围内[19].Jarvio等[20]开展的红树林转化为养虾塘对土壤有机碳储量和碳排放量的影响研究也是基于IPCC设定的0~1m土壤深度,本研究土壤/沉积物的采样深度也设定为0~1m.本研究通过测定和计算不同植物群落感潮沼泽湿地生态系统地上、地下植物碳库、土壤碳库及养殖塘沉积物碳库,以期揭示感潮沼泽湿地围垦成养殖塘后生态系统碳储量的变化,为河口区退塘还湿固碳增汇及温室气体减排提供基础数据.
1 材料与方法
1.1 研究区概况和采样点分布
以福建省闽江河口区作为研究区(图1).闽江河口地处中亚热带和南亚热带海洋性季风气候区的过渡区.气候温暖湿润,年平均气温为19.7℃,年降水日数的153d,年降水量约为1346mm[21].研究区的湿地土壤类型为滨海盐土.闽江河口区内分布着不同植物群落占优势的滨海感潮沼泽湿地,主要包括短叶茳芏湿地、芦苇湿地、互花米草湿地等,同时分布着大量的由以上沼泽湿地围垦而成的水产养殖塘.本文中采用潮滩沼泽湿地与围垦养殖塘配对采样策略.潮滩沼泽湿地和对应的养殖塘(养虾塘,养殖年限约为10a)的采样点分布在闽江河口的鳝鱼滩、琅岐岛和蝙蝠洲等地(图1)

图1 研究区地理位置及采样点位置
1.2 植物样品采集与群落特征调查
在闽江河口区分别选择短叶茳芏湿地、芦苇湿地和互花米草湿地的样地各2个,以及分别由以上湿地围垦转化成的水产养殖塘样地各2个,植物及土壤/沉积物采集时间为2019年9~10月.在每个沼泽湿地样地内随机选取3个1m×1m的样方,共18个样方,测定样方内植物的株高、密度、盖度等群落指标,用剪刀将样方内的植物齐地面剪下,带回实验室,洗净,将植物地上部分按茎、叶片、叶鞘、穗等不同器官进行分装,105℃杀青30min后,70℃烘干72h后至恒重,计算各植物群落地上生物量.地上部分齐地剪下后,在每个样方利用直径为10cm的土钻采集深度为100cm的土芯,以0~10,10~20,20~30,30~40,40~50, 50~70,70~100cm进行分层.分袋带回实验室,使用孔径为1mm尼龙布将采集的土芯冲洗,收集其中的植物根系并洗净,按不同深度进行分装,于105℃杀青30min后,70℃烘干72h后至恒重,计算各植物群落湿地土壤不同深度的植物地下生物量.
1.3 土壤/沉积物样品采集与基本理化性质测定
分别采集沼泽湿地样方内土壤样品,采样深度和分层同植物根系.水产养殖塘沉积物样品在每个养殖塘内分别随机采集3个沉积物柱芯,共18个柱芯.采样深度和分层同沼泽湿地样地.采用pH400便携式土壤pH计(Spectrum Technologies,美国)测定土壤/沉积物pH值,采用2265FS电导仪(Spectrum Technologies,美国)测定土壤/沉积物电导率;使用环刀法测定土壤/沉积物容重[22];用失重法在105℃烘干至恒重测定土壤/沉积物含水率[22].
1.4 有机碳含量测定
将植物地上各器官样品及不同深度植物根系样品研磨后,使用植物碳氮元素分析仪(VARIO ELIII,德国)测定植物有机碳含量.土壤/沉积物样品带回实验室自然风干,去除碎石、植物根系等杂物,研磨后过100目筛,使用10%的盐酸(HCl)洗除无机碳/碳酸盐,直至无气泡产生,再用蒸馏水洗酸至中性,风干后研磨备用[23-24],采用土壤碳氮元素分析仪(Elementar Vario MAX CN,德国)测定土壤/沉积物有机碳含量.
1.5 生态系统碳储量的计算
沼泽湿地生态系统蓝碳储量是沼泽植被地上生物量碳库、沼泽植被地下生物量碳库和一定深度土壤有机碳库的总和.
单位面积植被(地上和地下)碳库的计算公式:
植被碳储量=植被单位面积生物量´植物有机碳含量 (1)
一定深度、单位面积土壤有机碳库的计算公式:
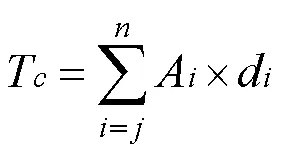
式中:T为单位面积、一定深度的(~层)碳储量,Mg C/cm2;A为土壤剖面第层的碳密度,mg/cm3;d为第层厚度,cm.
碳密度的计算公式:

式中:M为第层土壤碳含量,mg/g.
1.6 沼泽湿地转化为养殖塘后造成的碳释放量的估算
基于IPCC报告以及文献[12-14]提出的根据生态系统土地利用/覆盖变化造成的碳储量变化进而评估其造成的碳释放量(Mg CO2-eq/hm2)的计算方法,估算潮汐沼泽湿地生态系统围垦成养殖塘后其碳释放量,碳储量变化的具体计算公式如下:

式中:DCLU为土地利用变化引起的碳储量变化值;DCAB为植物地上生物量碳储量变化值;DCBB为植物地下生物量碳储量变化值;DCSOC为土壤/沉积物有机碳储量变化值.
为了便于与目前碳释放研究的表达方式相一致,Kauffman等[12-14]将生态系统碳储量变化造成的碳释放进一步表征为二氧化碳排放量,表达为Mg CO2-eq/hm2,计算方法为将碳储量变化值乘以3.67 (二氧化碳和碳的分子比),本研究也采用该方法.
1.7 数据处理与分析
在数据分析前,先进行正态分布检验和方差齐次性检验,不符合正态分布的数据采用log转置后分析,采用SPSS 22.0软件中独立样本检验分析滨海湿地围垦前后土壤理化性质、植物碳储量、土壤碳储量等的差异.采用Tukey事后检验进行不同植物相同器官之间,相同植物不同器官之间有机碳含量,不同转化方式间DCLU、DCAB、DCBB、DCSOC和释放的差异分析.数据分析显著性水平为=0.05,数据均以平均值±标准差的形式表示.
2 结果与分析
2.1 土壤/沉积物环境因子的变化
闽江河口芦苇湿地0~100cm土壤pH值为(5.72± 0.69),含水率为(47.03±5.19)%,容重为(0.76±0.12)g/ cm3,电导率为(6.42±1.80)mS/cm;短叶茳芏湿地0~ 100cm土壤pH值为(5.42±0.33),含水率为(43.79± 4.12)%,容重为(0.79±0.10)g/cm3,电导率为(4.12± 0.50)mS/cm;互花米草湿地0~100cm土壤pH值为(6.72±0.71),含水率为(42.18±4.43)%,容重为(0.81±0.09) g/cm3,电导率为(5.76±1.41)mS/cm.3种植物群落沼泽湿地围垦为养殖塘后土壤/沉积物环境因子发生显著的变化(图2).围垦养殖塘沉积物pH值、容重、电导率显著上升(<0.05),pH值上升至(7.14±0.28),容重上升至(0.90±0314)g/cm3,电导率上升至(9.08±2.52)mS/ cm,含水率显著下降至(40.00± 6.05)%(<0.05).

图2 不同潮汐沼泽湿地和围垦养殖塘的土壤/沉积理化性质的比较
*表示数据在滨海湿地土壤和养殖塘沉积物间具有显著差异(检验,<0.05)
2.2 植物生物量的分配
闽江河口湿地不同优势植物群落生物量构成有所不同.芦苇湿地地上生物量76.17%来自植物茎器官、13.96%来自叶器官、5.66%来自植物鞘器官、4.22%来自植物穗器官;短叶茳芏98.19%地上生物量来自植物茎器官,其他植物器官总和不到地上植物生物量的2%;互花米草地上各器官(茎、叶、鞘和穗)分别占地上植物生物量的51.83%、30.12%、10.35%、7.69%(图3).芦苇地下生物量随深度增加逐渐减少,变化速度较均匀,变化范围为(2.97~10.24)Mg/hm2;短叶茳芏和互花米草地下生物量聚表性较明显,短叶茳芏56.51%地下生物量聚集在0~10cm土层内,变化范围为(0.88~13.64) Mg/hm2,互花米草70.23%地下生物量聚集在0~20cm土层内,变化范围为(1.70~19.22)Mg/hm2.

2.3 植物、土壤/沉积物有机碳含量的分布
如图4所示,3个植物群落沼泽湿地土壤有机碳含量在0~100cm土层范围内的变化趋势为随着深度的增加而降低.芦苇湿地、短叶茳湿地、互花米草湿地土壤0~100cm土层有机碳含量范围分别为(13.30~20.65), (15.04~20.38),(14.25~22.70)mg/g,平均值分别为(16.53± 1.65),(17.05±1.26),(16.53±2.13) mg/g.芦苇、短叶茳芏、互花米草3种沼泽湿地转化成的养殖塘沉积物有机碳含量随深度变化不明显,其变化范围分别为(10.84~ 15.83),(9.45~17.81),(10.37~14.88)mg/g,平均值分别为(13.30±1.31), (13.72±2.17),(12.87±1.91) mg/g(图4a、b、c).养殖塘沉积物有机碳含量与其围垦前的潮滩沼泽湿地有机碳含量差值表现为表层差值大,底层差值小,两者的差值呈现随深度的增加而减小的趋势(图4d、e、f).
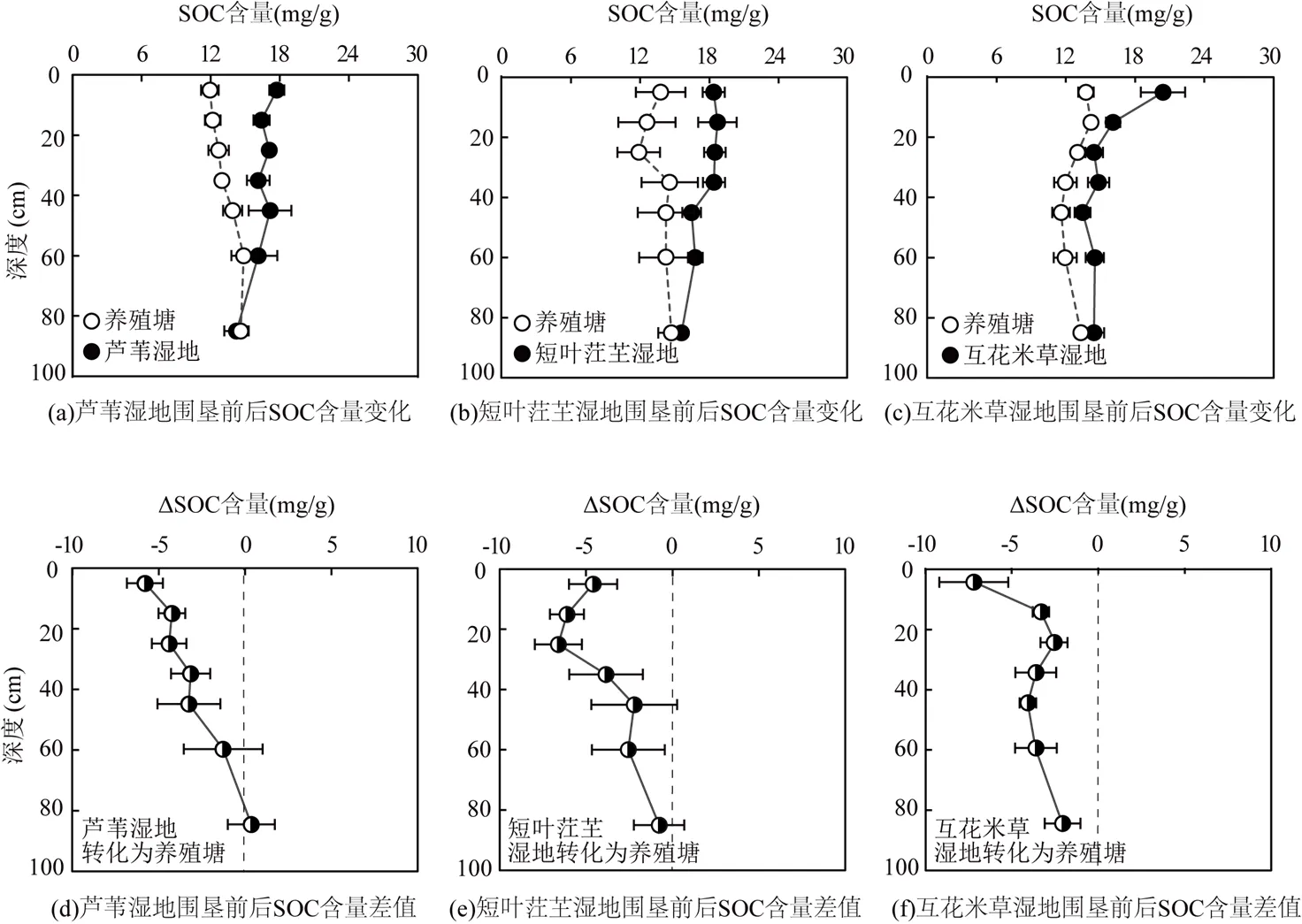
图4 不同潮汐沼泽湿地与围垦养殖塘的土壤/沉积物有机碳含量的比较

图5 不同植物各器官机碳含量
如图5所示,芦苇各植物器官有机碳含量(根、茎、叶、鞘、穗)均值分别为405.91,431.13,430.24, 398.97,434.21mg/g;短叶茳芏各植物器官有机碳含量(根、茎、叶、鞘、穗)均值分别为398.20,396.71, 409.36,399.38,437.42mg/g;互花米草各植物器官有机碳含量(根、茎、叶、鞘、穗)均值分别为387.41, 415.54,402.44,411.60,439.40mg/g.整体而言,不同植物相同器官间有机碳含量差异不显著(>0.05),相同植物不同器官间有机碳含量差异也不显著(>0.05).
2.4 滨海沼泽湿地转化为养殖塘造成的碳储量变化
潮滩沼泽湿地围垦前后生态系统碳储量具有显著差异(<0.05).芦苇湿地生态系统有机碳储量为(152.85±8.88)Mg C/hm2,其中植物有机碳占生态系统有机碳储量的17.12%;植物有机碳储量69.50%来自地下植物生物量,30.50%来自地上植物生物量(图6a).芦苇湿地围垦成的养殖塘的沉积物有机碳储量为(112.69±4.26)Mg C/hm2,相较芦苇湿地土壤有机碳储量(126.16±6.01Mg C/hm2)有所减少,与芦苇湿地生态系统碳储量相比,围垦成的养殖塘沉积物有机碳储量减少了26.28%.
闽江河口短叶茳芏湿地生态系统有机碳储量为(151.63±6.33)Mg C/hm2,其中植物有机碳占生态系统有机碳储量的11.32%;植物有机碳储量57.37%来自地下生物量,42.63%来自地上植物生物量(图6b).短叶茳芏湿地围垦成的养殖塘的沉积物有机碳储量为(128.24±15.81)Mg C/hm2,相较短叶茳芏湿地土壤有机碳储量(134.47±8.59Mg C/hm2)有所减少,与短叶茳芏湿地生态系统碳储量相比,围垦成的养殖塘沉积物有机碳储量减少15.43%.
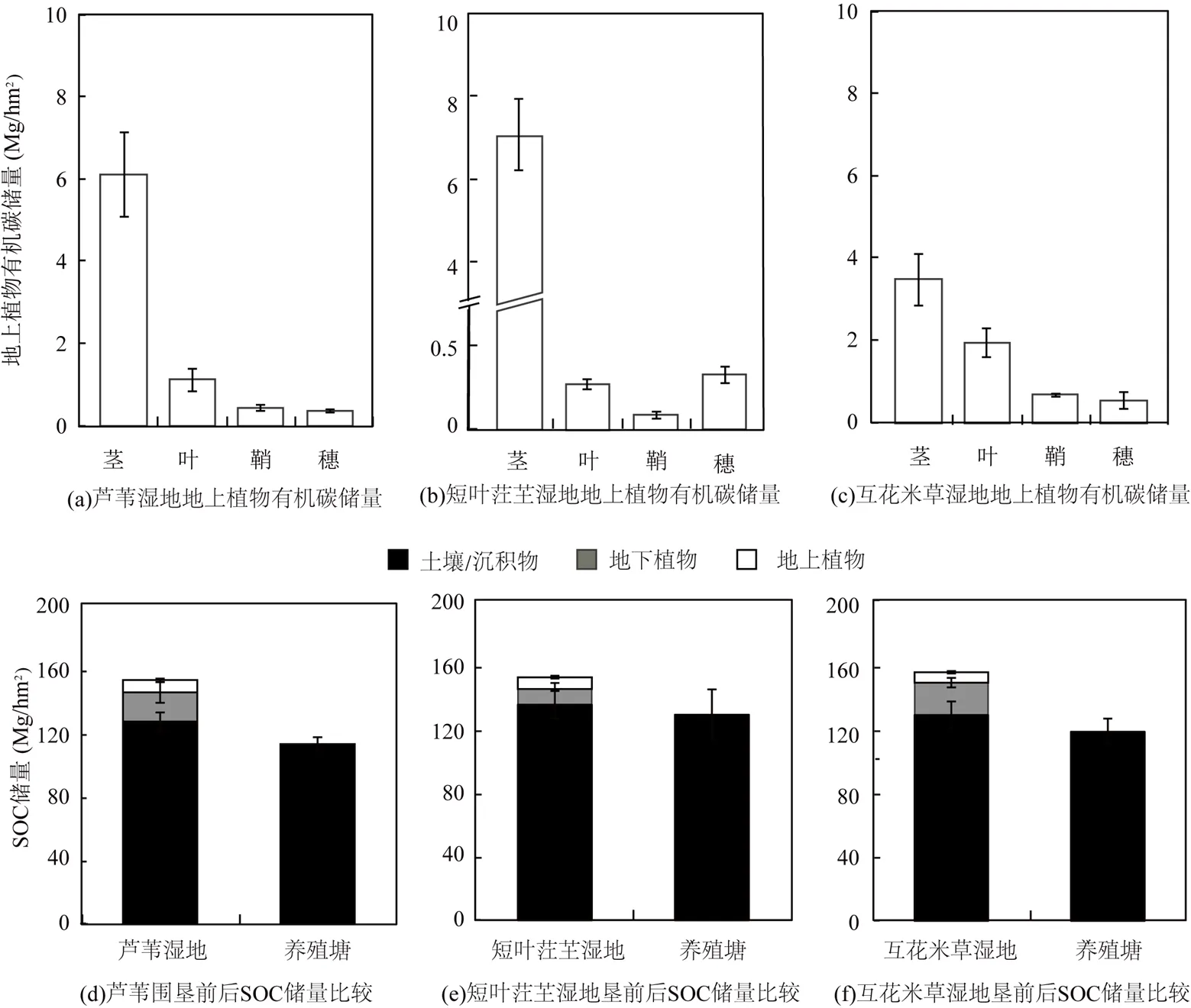
图6 不同潮汐沼泽湿地与围垦养殖塘的有机碳储量的比较
闽江河口互花米草湿地生态系统有机碳储量为(155.85±10.82)Mg C/hm2,其中植物有机碳占生态系统有机碳储量的17.21%;植物有机碳储量75.13%来自地下生物量,24.87%来自地上植物生物量(图6c).互花米草湿地围垦成的养殖塘的沉积物有机碳储量为(118.59±8.26)Mg C/hm2,相较互花米草湿地土壤有机碳储量(129.03±8.47)Mg C/hm2有所减少,与互花米草湿地生态系统碳储量相比,围垦成的养殖塘沉积物有机碳储量减少23.91%.
2.5 滨海沼泽湿地转化为养殖塘造成的碳释放
闽江河口芦苇湿地、短叶茳芏湿地和互花米草湿地围垦为养殖塘导致的碳损失分别为(39.64± 8.99),(32.88±7.22),(37.26±7.52)Mg C/hm2(表1),将碳转化为CO2形式,则碳释放量相当于(145.49±33.00), (120.66±26.49),(136.76±27.61)Mg CO2-eq/hm2,其中大部分释放的碳来源于自然植被的消失,芦苇湿地、互花米草湿地、短叶茳芏湿地自然植被的消失分别引起66.00%、52.20%、71.97%的CO2释放,其余34.00%、47.80%、28.03%的排放量来源于土壤.沼泽湿地转化为养殖塘后植物地上生物量碳储量的变化、植物地下生物量碳储量的变化和土壤/沉积物有机碳储量的变化及其各自造成的碳释放量见表1.不同沼泽湿地转化为养殖塘引起的碳储量及碳释放量变化差异不显著性.
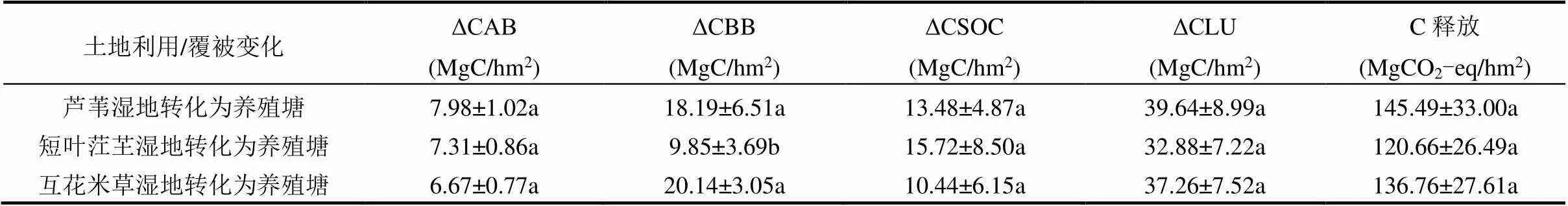
表1 沼泽湿地转化为养殖塘引起的碳储量变化及相应的碳释放量
注:同一列中不同小写字母表示不同转化间差异显著,<0.05.
3 讨论
3.1 滨海潮滩沼泽湿地生态系统蓝碳碳库
本文中,闽江河口芦苇湿地、短叶茳芏湿地、互花米草湿地生态系统蓝碳储量分别为(152.85± 8.88),(151.63±6.33),(155.85±10.82)Mg C/hm2,整体平均生态系统碳储量为(153.44±8.53)Mg C/hm2.与我国其他地区的潮滩沼泽湿地,如长江口崇明东滩[25]、黄河口[26-28]、盐城[29]、广西大风河口[30]相比,闽江河口潮滩沼泽湿地生态系统碳储量均处在较高水平.但低于IPCC公布的全球潮汐盐沼生态系统碳储量平均水平(255Mg C/hm2)[31].
闽江河口沼泽湿地植被平均碳储量为(23.38± 6.24)Mg C/hm2,对比我国盐城滨海互花米草湿地植物碳储量为12.40Mg C/hm2[29]、黄河三角洲芦苇湿地植物碳储量4.90Mg C/hm2[32],闽江河口沼泽湿地植被碳储量处于较高水平.闽江河口不同植物群落各植物器官(茎、叶、鞘、穗、根)之间含碳量并无显著差异(>0.05),闽江河口沼泽湿地植物碳库在不同器官间的分配主要由生物量在不同器官内的分配所决定.
芦苇和互花米草均为多年生禾本科植物,植株高,净光合作用速率高并具有较大的生物量,其固碳作用比较明显.地下根茎部分是闽江河口芦苇湿地和互花米草湿地植被碳储存的主要场所,于彩芬等[33]研究也表明互花米草地下植物碳储量是地上植物碳储量的4倍以上,此外,本研究中芦苇植株碳储量分配的结果与梅雪英等在长江口崇明东滩研究得出的芦苇湿地植物碳储量分配的结果十分接近[34].短叶茳芏作为莎草科植物,地下根系较不发达,近60%的地下生物量集中在0~10cm范围土壤,表聚现象显著.由于湿地植物根系产生的分泌物和有机质是湿地土壤有机碳的主要来源,短叶茳芏植物根系向土壤深处延伸能力较弱不仅使自身植物有机碳库小于芦苇和互花米草,也在一定程度上降低了短叶茳芏土壤有机碳储量,这也证明植物生物量是影响河口湿地沉积物有机碳含量及储量的一个重要因素.
滨海潮滩沼泽湿地生态系统蓝碳碳储量主要集中在土壤碳库,本研究中3个沼泽湿地植物碳库所占比例仅为12.76%~20.79%.植物碳库所占比例较小,这与多数沼泽湿地的研究结果相同[25,30].国内外较多数研究关注了沼泽湿地土壤碳库[28,35-37].本研究中闽江河口潮滩沼泽湿地土壤碳库平均为(130.06±7.98)Mg C/hm2,高于国内长江口[25]、黄河口[27-28]、盐城滨海沼泽[29]等研究区域,与国外相关研究相比,低于澳大利亚西部10个温带河口沼泽和墨西哥湾的研究结果[38-39],与德国易北河口及阿拉伯联合酋长国58个河口相比,本研究中碳储量在其数值范围内[36,39](表2).本研究中不同植物群落沼泽湿地土壤剖面有机碳含量都在表层(0~10cm)出现最大值,且随土壤加深而减少,这一结果与国内其他滨海沼泽的研究结果相似.大丰滨海互花米草沼泽湿地土壤有机碳含量随深度增加而递减[40].崇明东滩的芦苇群落、混生植物群落下土壤有机碳也随深度增加不断递减[25].本研究中短叶茳芏湿地土壤有机碳含量随深度增加的变化趋势较为和缓,Yuan等[25]研究发现莎草科植物湿地土壤有机碳储量随深度增强的变化也不明显.Jobbagy等[41]的研究指出地下生物量是土壤有机碳含量变化的重要原因之一,植物根系的分布会影响土壤有机碳的垂直分布,大量死根的腐解归还为土壤提供了丰富的碳源,因此在植物根系分布最密集处有机碳含量往往也较大,此外,土壤表层的凋落物往往也比较多,使得土壤有机碳累积量增大.

表2 不同滨海沼泽湿地生态系统蓝碳储量
注:土壤碳储量后括号内的数据为土壤深度.
3.2 湿地围垦对土壤/沉积物环境因子的影响
滨海沼泽湿地转化为养殖塘后土壤/沉积物pH值、容重、电导率显著上升,土壤/沉积物含水率显著下降.闽江河口沼泽湿地土壤呈弱酸性,围垦后沉积物呈中性至弱碱性.Jayalath等[42]在实验室条件下开展模拟实验,对湿地土壤投加不同种类的有机物,研究发现土壤中有机物含量的增加可以刺激硫酸盐还原反应,使土壤pH值升高.养殖塘在养殖过程中投放的饵料中富含大量有机质[43],未被食用的残饵经过分解在表层沉积物中蓄积[44],这可能是造成围垦后养殖塘沉积物pH值明显上升的主要原因.潮滩沼泽湿地转化为养殖塘导致土壤压实,从而导致土壤/沉积物容重增加和孔隙度降低.Batey等[45]的研究也表明,自然植被的消失会造成土壤体积密度增加、土壤孔隙度降低、渗透率和导水率降低,本研究结果进一步证明以上结论.养殖塘沉积物电导率显著高于潮滩沼泽湿地,即围垦使土壤盐度显著增高,原因可能是:一方面,养虾过程中引入了海水中的钙、镁、钾、钠等元素,缺乏潮水冲刷和蒸发使得盐分在沉积物种残留引发盐结晶和积累[46-47];另一方面,在养殖过程中,随着饵料等物质的连续投入,大量的残饵和对虾的排泄代谢物直接排入水中,使营养盐和有机质在水体及底泥中不断富集,易形成富营养化的养殖环境[48].潮滩沼泽湿地围垦为养殖塘,土壤pH值、容重、含水率和电导率都发生了显著变化,表明土壤环境因子对土地利用变化的响应十分敏感.
3.3 滨海沼泽湿地土壤与养殖塘沉积物的碳含量和碳储量的比较
Wasige等[49]为寻找影响土壤有机碳含量的主控因子,以卢旺达南部湿润地区为研究区域开展了相关研究,结果表明,土壤有机碳含量与土地利用类型相关性最高.赵娣[50]对南四湖区土地利用变化对土壤有机碳的影响研究也得到了类似结果.有研究认为沼泽湿地转变为养殖塘后,相对于沼泽湿地表层土壤,养殖塘表层沉积物有机碳含量显著增加.一方面,滨海湿地干湿交替的环境相对易于有机质分解,而养殖塘长期处于淹水环境中,厌氧的环境抑制了沉积物有机质的分解.另一方面,大量富含有机质的饵料未被食用,经分解后蓄积在养殖塘表层沉积物中[51],然而,本研究中3个沼泽湿地围垦为养殖塘后,养殖塘表层沉积物有机碳含量显著低于沼泽湿地表层土壤有机碳含量(图4).闽江河口感潮沼泽湿地转化为养殖塘造成生态系统蓝碳碳库减少了21.90%,消失的碳库中63.89%来自绿色植被的消失引起的植被碳库的消失,36.11%来自土壤碳库有机碳的减少.然而,本研究中沼泽湿地围垦为养殖塘造成的闽江河口区湿地生态系统碳损失有可能被低估.Suárez-Abelenda等的研究结果发现,围垦活动还会影响养殖塘以外的碳动态,养殖塘排放废水对周围沼泽湿地的土壤有机碳储存有显著影响,未受养殖塘废水排放影响的滨海沼泽湿地0~40cm深度土壤有机碳储量较暴露于废养殖塘废水排放影响的滨海湿地高出2.2倍[52].总之,滨海沼泽湿地围垦为水产养殖塘后将造成滨海区域湿地生态系统的碳汇及碳中和功能下降,因此,退塘还湿生态恢复是一项十分紧迫的任务.
4 结论
4.1 闽江河口芦苇湿地、短叶茳芏湿地、互花米草湿地生态系统均具有很高水平的滨海湿地蓝碳碳库,3个沼泽湿地生态系统碳储量平均值为(153.44± 8.53)Mg C/hm2;滨海沼泽生态系统蓝碳碳库的组成主要以土壤碳库为主,土壤碳储量(130.60±7.98)Mg C/hm2占生态系统总碳储量的84.76%,植物碳储量仅占生态系统总碳储量的15.24%.
4.2 在闽江河口区,与潮滩沼泽湿地生态系统蓝碳碳储量相比,由其围垦转化成的养殖塘沉积物碳储量减少21.90%,减少碳储量的63.89%来自绿色植被的消失,36.11%来自土壤碳库有机碳的减少.滩沼泽湿地围垦为养殖塘,土壤pH值、容重、含水率和电导率均发生显著变化,其原因很可能是围垦造成了水环境的变化及养殖过程中饲料的投入及鱼虾的排泄物的沉积.
[1] Sandi S G, Rodriguez J F, Saco P M, et al. Accelerated sea-level rise limits vegetation capacity to sequester soil carbon in coastal wetlands: A study case in Southeastern Australia [J]. Earth's Future, 2021,9(9).
[2] Howe A J, Rodriguez J F, Saco P M. Surface evolution and carbon sequestration in disturbed and undisturbed wetland soils of the Hunter estuary, southeast Australia [J]. Estuarine Coastal and Shelf Science, 2009,84(1):75-83.
[3] 肖 颖,杨继松.辽河口滨海湿地土壤有机碳矿化及其与盐分的关系 [J]. 生态学杂志, 2015,34(10):2792-2798.
Xiao Y, Yang J S. Soil organic carbon mineralization and its relation with salinity in coastal wetland of Liaohe estuary [J]. Chinese Journal of Ecology, 2015,34(10):2792-2798.
[4] Spivak A C, Sanderman J, Bowen J L, et al. Global-change controls on soil-carbon accumulation and loss in coastal vegetated ecosystems [J]. Nature Geoscience, 2019,12(9):685-692.
[5] Xu X F, Thornton P E, Post W M. A global analysis of soil microbial biomass carbon, nitrogen and phosphorus in terrestrial ecosystems [J]. Global Ecology and Biogeography, 2013,22(6):737-749.
[6] Mitsch W J, Gosselink J G. The value of wetlands: importance of scale and landscape setting [J]. Ecological Economics, 2000,35(1):25-33.
[7] Wu T, Hou X Y, Xu X L. Spatio-temporal characteristics of the mainland coastline utilization degree over the last 70years in China [J]. Ocean & Coastal Management, 2014,98:150-157.
[8] Murray N J, Clemens R S, Phinn S R, et al. Tracking the rapid loss of tidal wetlands in the Yellow Sea [J]. Frontiers in Ecology and the Environment, 2014,12(5):267-272.
[9] 余 健,房 莉,卞正富,等.土壤碳库构成研究进展 [J]. 生态学报, 2014,34(17):4829-4838.
Yu J, Fang L, Bian Z F, et al. A review of the composition of soil carbon pool [J]. Acta Ecologica Sinica, 2014,34(17):4829-4838.
[10] Davidson E C, Ackerman I L. Changes in soil carbon inventories following cultivation of previously untilled soils [J]. Biogeochemistry, 1993,20(3):161-193.
[11] Post W M, Kwon K C. Soil carbon sequestration and land-use change: processes and potential [J]. Global Change Biology, 2000,6(3):317- 327.
[12] Kauffman J B, Trejo H H, Garcia M D J, et al. Carbon stocks of mangroves and losses arising from their conversion to cattle pastures in the Pantanos de Centla, Mexico [J]. Wetlands Ecology and Management, 2016,24(2):203-216.
[13] Kauffman J B, Heider C, Norfolk J, et al. Carbon stocks of intact mangroves and carbon emissions arising from their conversion in the Dominican Republic [J]. Ecological Applications, 2014,24(3):518- 527.
[14] Kauffman J B, Bernardino A F, Ferreira T O, et al. Shrimp ponds lead to massive loss of soil carbon and greenhouse gas emissions in northeastern Brazilian mangroves [J]. Ecology and Evolution, 2018, 8(11):5530-5540.
[15] 刘梦云,常庆瑞,杨香云.黄土台塬不同土地利用方式下土壤碳组分的差异[J]. 植物营养与肥料学报, 2010,16(6):1418-1425.
Liu M Y, Chang Q R, Yang X Y. Soil carbon fractions under different land use types in the table lands of the Loess Plateau [J]. Journal of Plant Nutrition and Fertilizer, 2010,16(6):1418-1425.
[16] 张 帅,许明样,张亚锋,等.黄土丘陵区土地利用变化对深层土壤活性碳组分的影响[J]. 环境科学, 2015,36(2):66-68.
Zhang S, Xu M Y, Zhang Y F, et al. Effects of land use changes on soil active organic carbon in deep soil in hilly Loess Plateau region [J]. environmental science, 2015,36(2):66-68.
[17] 彭佳佳,胡玉福,蒋双龙,等.生态恢复对川西北沙漠化草地土壤活性有机碳的影响[J]. 水土保持学报, 2014,28(6):251-255.
Peng J J, Hu Y F, Jiang S L, et al. Influences of ecological restoration on soil active organic carbon in sandy grassland in the Northwestern Sichuan [J]. Journal of Soil and Water Conservation, 2014,28(6):251- 255.
[18] 周亮进,由文辉.闽江河口湿地景观格局动态及其驱动力 [J]. 华东师范大学学报(自然科学版), 2007,(6):77-87.
Zhou L J, You W H. Dynamic and driving forces of landscape pattern of estuarine wetland in the Min River [J]. Journal of East China Normal University(Natural Science), 2007,(6):77-87.
[19] 陈庆强,沈承德,易惟熙,等.土壤碳循环研究进展 [J]. 地球科学进展, 1998,(6):46-54.
Chen Q Q, Shen C D, Yi W X, et al. Progresses in soil carbon cycle researches [J]. Advances in Earth Science, 1998,(6):46-54.
[20] Jarvio N, Henriksson P J G, Guinee J B. Including GHG emissions from mangrove forests LULUC in LCA: a case study on shrimp farming in the Mekong Delta, Vietnam [J]. International Journal of Life Cycle Assessment, 2018,23(5):1078-1090.
[21] Tong C, Wang W Q, Huang J F, et al. Invasive alien plants increase CH4emissions from a subtropical tidal estuarine wetland [J]. Biogeochemistry, 2012,111(1-3):677-693.
[22] 鲁如坤.土壤农业化学分析方法 [M]. 北京:中国农业科技出版社, 2000:269-290.
Lu R K. Analytical methods of soil agricultural chemistry [M]. Beijing:China Agricultural Science Press, 2000:269-290.
[23] Luo M, Zeng C S, Tong C, et al. Abundance and speciation of iron across a subtropical tidal marsh of the Min River Estuary in the East China Sea [J]. Applied Geochemistry, 2014,45:1-13.
[24] Fang Y Y, Singh B P, Collins D, et al. Nutrient stoichiometry and labile carbon content of organic amendments control microbial biomass and carbon-use efficiency in a poorly structured sodic-subsoil [J]. Biology and Fertility of Soils, 2020,56(2):219-233.
[25] Yuan Y Q, Li X Z, Jiang J Y, et al. Distribution of organic carbon storage in different salt-marsh plant communities: A case study at the Yangtze Estuary [J]. Estuarine Coastal and Shelf Science, 2020,243: 106900.
[26] Zhao Q Q, Bai J H, Zhang G L, et al. Effects of water and salinity regulation measures on soil carbon sequestration in coastal wetlands of the Yellow River Delta [J]. Geoderma, 2018,319:219-229.
[27] 董洪芳,于君宝,孙志高,等.黄河口滨岸潮滩湿地植物-土壤系统有机碳空间分布特征 [J]. 环境科学, 2010,31(6):1594-1599.
Dong H F, Yu J B, Sun Z G, et al. Spatial distribution characteristics of organic carbon in the soil-plant systems in the Yellow River Estuary tidal flat wetland [J]. Environmental Science, 2010,31(6):1594-1599.
[28] Zhang G L, Bai J H, Zhao Q Q, et al. Soil carbon storage and carbon sources under differentinvasion periods in a salt marsh ecosystem [J]. Catena, 2021,196:104831.
[29] 周 葳.盐城海滨湿地土壤有机碳储量估算及其生态服务价值评估 [D]. 南京:南京师范大学, 2009.
Zhou W. Estimation of soil organic carbon storage and ecological service value of Yancheng Coastal Wetland [D]. Nanjing:Nanjing Normal University, 2009.
[30] 黄 星,梁绍信,陶玉华,等.北部湾大风江口互花米草湿地有机碳储量的分布特征[J]. 广西植物, 2021,41(6):853-861.
Huang X, Liang S X, Tao Y H, et al. Distribution characteristics of organic carbon stocks ofin Dafeng River Estua [J]. Guihaia, 2021,41(6):853-861.
[31] IPCC. Climate change 2013: The Physical Science Basis. Contribution of working group I to the fifth assessment report of the intergovernmental panel on climate change [EB/OL]. https://www. ipcc.ch/report/ar5/wg1/2013-09-27.
[32] 于君宝,王永丽,董洪芳,等.基于景观格局的现代黄河三角洲滨海湿地土壤有机碳储量估算 [J]. 湿地科学, 2013,11(1):1-6.
Yu J B, Wang Y L, Dong H F, et al. Estimation of soil organic carbon storage in coastal wetlands of modern Yellow River Delta based on landscape pattern [J]. Wetland Science, 2013,11(1):1-6.
[33] 于彩芬,陈鹏飞,刘长安,等.互花米草湿地碳储量及碳汇研究进展 [J]. 海洋开发与管理, 2014,31(8):85-89.
Yu C F, Chen P F, Liu C A, et al. Research advance in research on carbon storage and carbon sink inwetland [J]. Ocean Development and Management, 2013,11(1):1-6.
[34] 梅雪英,张修峰.长江口典型湿地植被储碳、固碳功能研究——以崇明东滩芦苇带为例 [J]. 中国生态农业学报, 2008,16(2):269-272.
Mei X Y, Zhang X F. Carbon storage and fixation by a typical wetland vegetation in Changjiang River Estuary-A case study ofin east beach of Chongming Island [J]. Chinese Journal of Eco-Agriculture, 2008,16(2):269-272.
[35] Thorhaug A L, Poulos H M, Lopez-Portillo J, et al. Gulf of Mexico estuarine blue carbon stock, extent and flux: Mangroves, marshes, and seagrasses: A North American hotspot [J]. Science of the Total Environment, 2019,653:1253-1261.
[36] Hansen K, Butzeck C, Eschenbach A, et al. Factors influencing the organic carbon pools in tidal marsh soils of the Elbe estuary (Germany) [J]. Journal of Soils and Sediments, 2017,17(1):47-60.
[37] Gorham C, Lavery P, Kelleway J J, et al. Soil carbon stocks vary across geomorphic settings in Australian temperate tidal marsh ecosystems [J]. Ecosystems, 2021,24(2):319-334.
[38] Simpson L T, Osborne T Z, Duckett L J, et al. Carbon storages along a climate induced coastal wetland gradient [J]. Wetlands, 2017,37(6): 1023-1035.
[39] Schile L M, Kauffman J B, Crooks S, et al. Limits on carbon sequestration in arid blue carbon ecosystems [J]. Ecological Applications, 2017,27(3):859-874.
[40] Yang W, Qiao Y J, Li N, et al. Seawall construction alters soil carbon and nitrogen dynamics and soil microbial biomass in an invasivesalt marsh in eastern China [J]. Applied Soil Ecology, 2017,110:1-11.
[41] Jobbagy E G, Jackson R B. The vertical distribution of soil organic carbon and its relation to climate and vegetation [J]. Ecological Applications, 2000,10(2):423-436.
[42] Jayalath N, Mosley L M, Fitzpatrick R W, et al. Addition of clayey soils with high net negative acidity to sulfuric sandy soil can minimise pH changes during wet and dry periods [J]. Geoderma, 2016,269: 153-159.
[43] Funge-Smith S J, Briggs M R P. Nutrient budgets in intensive shrimp ponds: implications for sustainability [J]. Aquaculture, 1998,164(1-4): 117-133.
[44] Molnar N, Welsh D T, Marchand C, et al. Impacts of shrimp farm effluent on water quality, benthic metabolism and N-dynamics in a mangrove forest (New Caledonia) [J]. Estuarine Coastal and Shelf Science, 2013,117:12-21.
[45] Batey T, Mckenzie D C. Soil compaction: identification directly in the field [J]. Soil Use and Management, 2006,22(2):123-131.
[46] Towatana P, Voradaj C, Panapitukkul N. Changes in soil properties of abandoned shrimp ponds in southern Thailand [J]. Environmental Monitoring and Assessment, 2002,74(1):45-65.
[47] Banerjee K, Sengupta K, Raha A, et al. Salinity based allometric equations for biomass estimation of Sundarban mangroves [J]. Biomass & Bioenergy, 2013,56:382-391.
[48] Boyd C E, Wood C W, Chaney P L, et al. Role of aquaculture pond sediments in sequestration of annual global carbon emissions [J]. Environmental Pollution, 2010,158(8):2537-2540.
[49] Wasige J E, Groen T A, Rwamukwaya B M, et al. Contemporary land use/land cover types determine soil organic carbon stocks in south-west Rwanda [J]. Nutrient Cycling in Agroecosystems, 2014, 100(1):19-33.
[50] 赵 娣.南四湖区土地利用变化及其对土壤有机碳储量的影响 [D]. 济南:山东大学, 2020.
Zhao D. The change of land-use types and its influence on soil organic carbon storage in Nansi Lake [D]. Jinan: Shandong University, 2020.
[51] 陈宏友,徐国华.江苏滩涂围垦开发对环境的影响问题 [J]. 水利规划与设计, 2004,(1):18-21.
Chen H Y, Xu G H. The impact on environment by the inning of beach land in Jiangsu Province [J]. Water Resources Planning and Design, 2004,(1):18-21.
[52] Suarez-Abelenda M, Ferreira T O, Camps-Arbestain M, et al. The effect of nutrient-rich effluents from shrimp farming on mangrove soil carbon storage and geochemistry under semi-arid climate conditions in northern Brazil [J]. Geoderma, 2014,213:551-559.
Effect of conversion of coastal marsh into aquaculture ponds on ecosystem carbon stocks in the Min River estuary.
CAO Qiong1, HUANG Jia-fang1,2, LUO Min3, TAN Ji1, TONG Chuan1∗
(1.Key Laboratory for Humid Subtropical Eco-geographical Processes of the Ministry of Education, School of Geographical Science, Fujian Normal University, Fuzhou 350007, China;2.Fujian Provincial Key Laboratory for Plant Eco-physiology, Fujian Normal University, Fuzhou 350007, China;3.College of Environment and Safety Engineering, Fuzhou University, Fuzhou 350116, China)., 2022,42(3):1335~1345
In order to scientifically assess the impact of land use/land cover changes on blue carbon pool of coastal tidal marsh, it is valuable to determine the changes of ecosystem carbon stock following conversion of coastal marsh to aquaculture ponds. In the Minjiang River estuary zone, we collected the samples of the aboveground and belowground plants, and the soils(0~100cm) from theandmarshes, and the top 100cm sediment ofthe aquaculture ponds reclaimed from above three different marshes. The organic carbon content of plants, and soil / sediment samples were measured. The blue carbon storage ofmarsh ecosystem,marsh ecosystem andmarsh ecosystem was (152.85±8.88), (151.63±6.33), and (155.85±10.82)Mg C/hm2, respectively,and the sediment carbon storage of the aquaculture ponds was (112.69±4.26),(128.24±15.81), and (118.59±8.26)Mg C/hm2, respectively.The blue carbon storage ofmarsh ecosystem,marsh ecosystem andmarsh ecosystem decreased by 26.3%, 15.4%, and 23.9%,respectively, resulting in (145.49±33.00), (120.66±26.49), and (136.76±27.61)Mg CO2-eq/hm2carbon emissions. Our results showed that conversion of coastal marsh into aquaculture ponds greatly decreasedecosystem carbon storage. We suggested that ecological restoration of aquaculture pond into marsh ecosystem will play an important role in coastal wetland carbon sequestration.
tidal marsh;aquaculture pond;carbon stock;carbon loss;Min River estuary
X131
A
1000-6923(2022)03-1335-11
曹 琼(1995-),女,福建南平人,福建师范大学硕士研究生,主要从事湿地生物地球化学循环研究.
2021-08-11
福建省林业科技项目(201916,2021FKJ30);福建省自然科学基金资助重点项目(2019J02008);国家自然科学基金资助项目(41877335, 41801070)
*责任作者, 教授, tongch@fjnu.edu.cn
