基于心脏CT血管造影的三维形态学分析在左心耳封堵术中的应用
2022-03-29吴大虎张波田为中张继朱莉陈各才
吴大虎,张波,田为中,张继,朱莉,陈各才
1.大连医科大学研究生院,辽宁 大连 116044;2.泰州市人民医院医学影像科,江苏 泰州 225300;*通信作者 张波tzzb008@163.com
左心耳封堵术(left atrial appendage occlusion,LAAO)主要在经食管超声心动图(trans-esophageal echocardiography,TEE)和透视下进行,也有少数选择心内超声代替TEE[1]。左心耳的解剖形态和大小差异很大,使得LAAO具有挑战性[2-3]。在左心耳封堵的早期临床研究中,介入医师平均使用1.8个封堵器才能达到满意的封堵效果,成功率约为82%,表明TEE在左心耳测量上准确性有限,且频繁更换封堵器会增加罹患并发症的风险;左心耳封堵器尺寸不当会导致更换次数增加,而尺寸过大和过小均有潜在的并发症风险,如装置移位或栓塞、心脏穿孔、心包积液甚至心脏压塞[4-5]。因此,术前最佳选择封堵器的大小对于提高一次封堵成功率尤为重要,可以改善安全性,包括最大限度地减少左心房内的装置和导管交换,同时也可以缩短手术时间及X线曝光时间,减少放射剂量。本研究拟对比分析术前心脏CT血管造影(cardiac CT angiography,CCTA)三维重建及形态学分析在引导Watchman装置进行LAAO的可行性,以及是否可以简化封堵过程、提高封堵效率。
1 资料与方法
1.1 研究对象 回顾性分析泰州市人民医院2019年1月—2021年5月因心房颤动(简称房颤)拟行LAAO的50例患者,男26例,女24例;年龄48~82岁,平均(71±7)岁,行标准LAAO(对照组)25例和经术前CCTA心脏三维重建引导的LAAO(研究组)25例。所有LAAO手术均由同一团队具有丰富经验的术者完成。对照组封堵患者手术于2019年1月—2020年3月进行,CT引导组封堵患者手术于2020年3月和2021年5月进行。纳入标准:①年龄≥40岁的非瓣膜性房颤患者,卒中风险评估系统(CHA2DS2-VASc)评分[6]≥2分(女性≥3分);②存在华法林使用禁忌或不能长期使用华法林者;③术后无阿司匹林和氯吡格雷/替格瑞洛使用禁忌。排除标准:①左心耳内存在血栓;②术前心脏CT发现无合适尺寸Watchman封堵器;③LAAO+消融“一站式”患者。封堵术后3个月均行心脏CT复查。手术成功定义为Watchman装置安全置入左心耳,置入深度合适,压缩比约8%~20%,术后残余漏<5 mm。
本研究获得泰州市人民医院临床研究伦理委员会批准(KY 202008001),并获得患者知情同意。
1.2 一般资料收集 收集患者房颤类型、手术方式、CCTA术前检查和术后复查日期、封堵器尺寸、用药情况、左心室射血分数、既往有无高血压、糖尿病、脑梗死史等。
1.3 CCTA图像采集与后处理
1.3.1 CT图像采集 采用双源CT(Siemens Somatom Force),非离子型对比剂80 ml(Iomeron 350),速度4~5 ml/s。扫描参数:电压100~120 kV,有效管电流800~1 235 mA,准直器宽度256×0.625 mm,机架旋转时间270 ms,间距0.2。采用双期扫描,第一期扫描结束后延迟60 s行第2次扫描,用于评估延迟的LAAO后对比剂填充情况。双源CT在双期扫描中均未见低密度充盈缺损或一期见充盈缺损但二期60 s延迟像充盈缺损消失,则为无血栓;一期见低密度充盈缺损且二期60 s延迟像充盈缺损持续存在,则为存在血栓。
1.3.2 CCTA三维重建后处理及术前引导操作 将数据传输至Syngo.VB10工作站,采用MM Reading软件进行图像后处理分析,主要行多平面重组(MPR)、容积再现(VR)及最大密度投影(MIP),获得多方位左心耳及Watchman封堵器图像,测量左心耳口部长短径及周长。左心耳口定义为左心房下交界处上方的肺静脉嵴与旋支水平的左心耳连接平面。左心耳着陆区被定义为进入左心耳主叶的入口,封堵设备可以安全地放置于附属物结构范围内。第1步通过血管打开方式多平面重组左心耳,剪辑左心耳的VR图,旋转到合适的三维角度(通常选择右前斜30°/尾侧20°或40°)(图1A),然后将VR图转换为MIP图,调节合适亮度,模拟术中透视(图1B)。第2步固定三维角度将MIP图转换成MIP薄,选择合适的断层块厚度,
选择显示左心耳口部最大径的切面,测量其最大径及深度(图1C),然后以三维旋转左心耳,将左心耳口部着陆区横断面展示,测量口部长短径及周长(图1D),选择合适尺寸的Watchman装置型号,若无合适尺寸的装置,则选择另外类型的封堵器(如Lambre封堵器);第3步勾画模拟Watchman封堵器于左心耳VR及MIP图着陆区的位置,模拟术中Watchman封堵器的释放位置(图1E、F),最大限度地提高装置与左心耳的同轴性,以左心耳MIP图模拟术中数字减影血管造影(DSA)造影下Watchman装置的释放(图2)。
1.4 术中TEE图像采集与分析 采用Philips EPIQ 7C,术前口咽部局部麻醉或术中全身麻醉下,将X7-2T探头轻轻插入患者食管中上段,TEE在手术过程中进行,用于选择初始装置的类型和尺寸,并为手术提供指导。以0°、45°、90°、135°测量左心耳开口最小和最大直径,取其中最大值作为TEE测量值,由1名经验丰富的超声科主任医师采用盲法对TEE数据进行分析。
1.5 统计学方法 使用SPSS 26.0软件,正态分布的计量资料用±s表示,组间比较采用独立样本t检验;计数资料以例(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组基本临床资料特征 50例患者手术期间未发生装置栓塞、围术期卒中/TIA或全身性栓塞;对照组中3例术中因无合适Watchman装置尺寸而更换LAmbre封堵器装置,均封堵成功;术后出现心包积液6例,2例心包积液成功经皮引流治疗,4例出现少量心包积液,无需干预,仅保守治疗。两组患者基线数据比较,差异均无统计学意义(P>0.05),见表1。
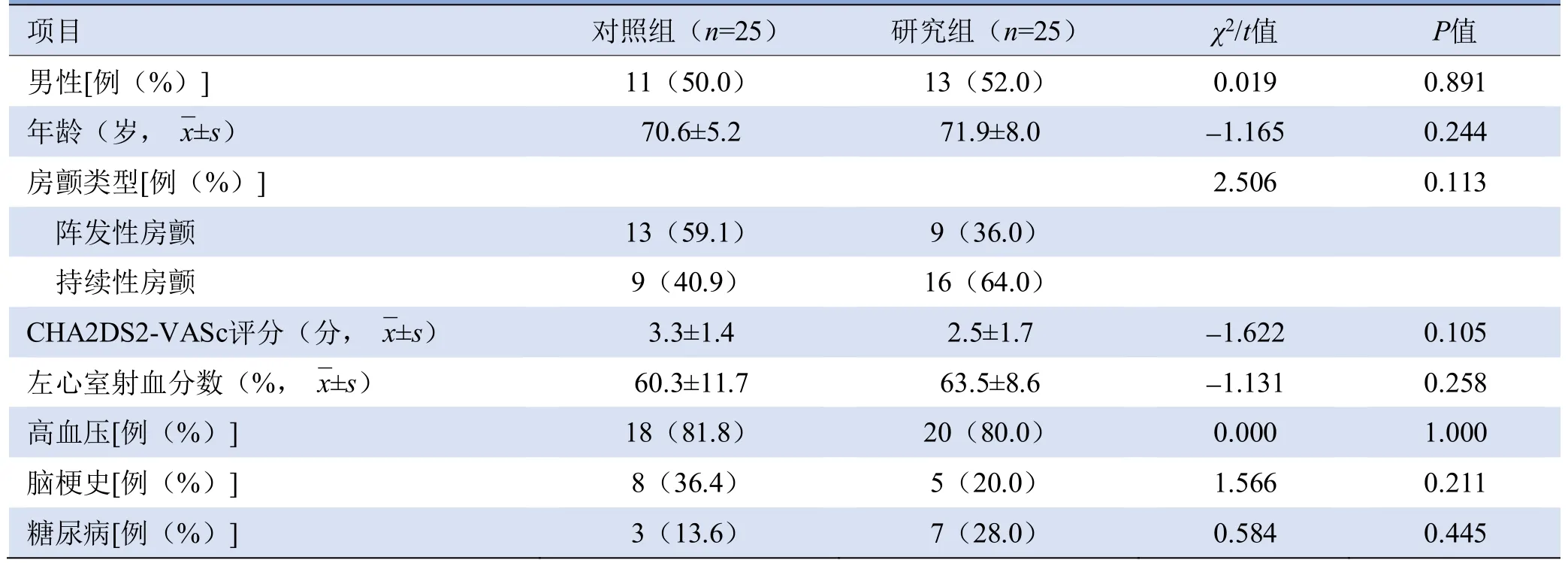
表1 对照组和研究组患者临床基线参数比较
2.2 两组左心耳相关参数比较 对照组和研究组的Watchman装置封堵成功率分别为88.0%和100.0%(P=0.234);对照组和研究组左心耳形态分布、封堵器压缩比、CT及DSA测量左心耳口部长径、左心耳深度和平均装置大小差异均无统计学意义(P>0.05);与对照组比较,研究组手术时间、X线曝光时间较短(P<0.001),且术中装置均一次性选择成功,更换装置数量较少(P=0.006)(表2)。
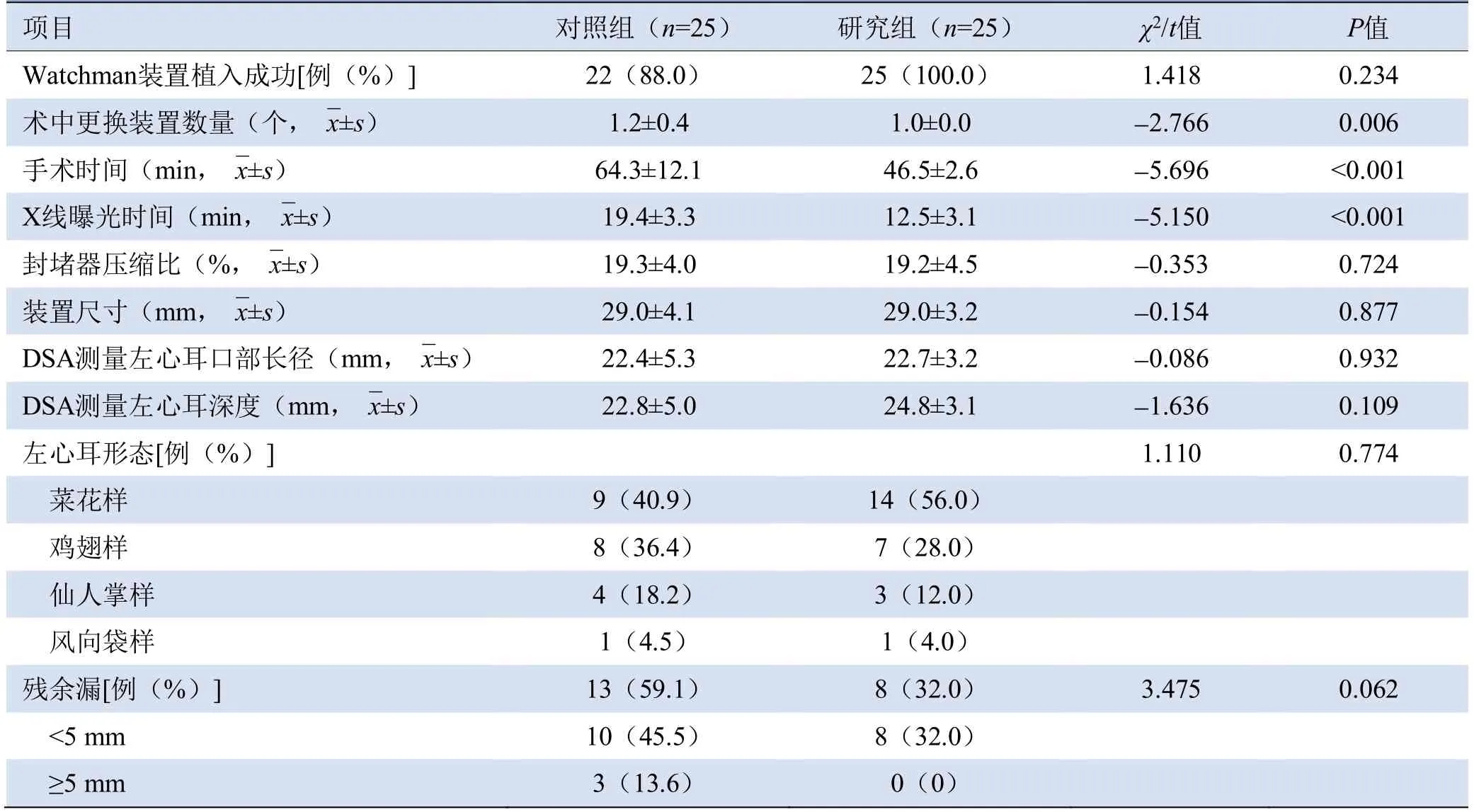
表2 对照组和研究组患者左心耳相关参数比较
2.3 术后CCTA随访结果 术后3个月CCTA复查发现所有封堵器均无移位、脱落;对照组出现13例(59.1%)残余漏(图3),8例(36.4%)残余漏<5 mm,3例(13.6%)>5 mm,研究组出现8例(32.0%)残余漏,且均<5 mm;两组各发现2例封堵器心房侧器械血栓,均见于内皮化不全患者,继续抗凝治疗后复查,2例血栓缩小,2例血栓消失。
3 讨论
欧洲心脏病学会指南和专家共识小组认为,对于口服抗凝药物禁忌证和高卒中风险的房颤患者,LAAO为ⅡB类推荐建议[7]。目前越来越多的房颤患者选择LAAO减少血栓栓塞性脑卒中的发生,Watchman封堵器已成为我国最常用的左心耳封堵器械[8]。LAAO是一个不断发展的领域,充分获得和使用不同的成像方式是心脏病学中大多数结构性干预的关键前提,由于导管技术的不断改进和对侵入性更小的心血管干预需求的增加,结构性手术的数量和复杂性近年一直上升。本研究通过对比研究证明术前CT心脏三维重建引导Watchman装置LAAO对简化封堵过程及提高封堵效率的可行性。
目前术中主要通过TEE和DSA联合成像进行LAAO,但其可行性和安全性仍有限。TEE可以充分排除心内血栓,评估左心耳的大小和形状,显示跨间隔穿刺的房间隔的特征,并确定有无心包积液,但TEE是一种侵入性检查,需要麻醉镇静,可能会导致误吸和食管损伤,且无法用于有TEE检查禁忌证的患者[9]。心腔内超声作为TEE的替代检查越来越多地用于LAAO,且临床研究证明安全有效[10]。DSA常用于术中选择装置尺寸,且DSA下测得的左心耳最大直径比在TEE下测量的最大直径大10%~20%[11-12]。既往研究报道,术中DSA 及TEE 下选择封堵器型号的失败率高达17%~25%,且术后装置残余漏发生率约为30%[9,13]。MRI在评估心脏血栓方面与TEE同样有效[14],但其用于LAAO术前评估的数据有限,较低的空间分辨率和较长的检查时间是MRI检查的重要挑战。因此,需要更好的方式提前预测装置尺寸。CT具有高空间分辨率、良好的时间分辨率、大视场、多平面重建能力和快速旋转时间的优势,在评价血栓方面可与TEE相当,但在提供复杂多变的左心耳大小和形状的全面信息、准确确定装置大小以及评价心外结构方面优于TEE。与TEE不同,CT是一种非侵入性技术,无需麻醉镇静,成为TEE术前和术后成像的一种侵入性较小的选择。
本研究中,对照组和研究组的Watchman装置封堵成功率分别为88.0%和100.0%,对照组3例因左心耳口部过大没有合适的Watchman封堵器,术中更换为LAmbre盘式封堵器,术中因首次封堵器尺寸不合适而更换了6次不同Watchman封堵器型号。精确的测量对于优化选择LAAO设备尺寸至关重要,设备尺寸大小调整不准确可导致严重并发症,尺寸过小可能导致设备栓塞和设备周围泄漏,而尺寸过大可能导致设备侵蚀邻近心肌或使设备变形。术前心脏CT三维成像能够准确评估左心耳的大小和形状,预测封堵器型号,当左心耳口部过大或深度过浅而无合适尺寸的封堵器类型时,可以术前决定更换其他类型封堵器;若术中更换封堵器,则手术时间延长、对比剂剂量增加,手术风险也随之增加。张涛等[15]报道CT三维重建对于封堵器型号的选择更具有指导意义。三维CT引导下的LAAO不仅更准确,而且比单独使用透视或TEE成像为患者提供更快、更安全和个性化的治疗。
Reddy等[16]报道,在美国Watchman封堵器批准后的3 822例手术中,平均手术时间为50 min,与本研究对照组手术时间相似。本研究中,对照组平均手术时间及X线曝光时间均较研究组长,证实术前心脏CT三维成像引导Watchman封堵器进行封堵可以简化LAAO,同时也减少了对比剂用量,这对患者和介入医师均具有临床意义。LAAO手术通常使用标准角度的透视,如右前斜30°/尾侧20°,但透视很难准确评估左心耳解剖结构,因此并不能准确显示每一种左心耳口部的长短径及深度。LAAO术中通常需要多角度进行投影,从而选择最合适的角度进行Watchman装置的安装固定,使得手术时间和曝光时间均延长;通过术前CT引导,三维重建可以对左心耳选择最合适的角度进行预判,术中可以在短时间内选择好角度,从而缩短手术时间、减少曝光量。Ebelt等[17]研究证明联合成像简化LAAO术是可行的,该课题组利用TEE和X线联合成像研究显示,治疗组较研究组的平均手术时间缩短15 min(P<0.001),并且联合成像也减少了对比剂的用量(较对照组减少20.6 ml,P<0.045),能较好地改善手术结果。与使用CT或TEE相比,3D打印模型的使用与最终植入装置的大小相关性更好,在设备选择的准确性和程序效率方面的优势更加突出;3D-CT打印可以提前进行预手术,尤其是非典型左心耳,术前行3D打印有利于评估手术难度,并做出合适的手术策略[5,10,18],从而减少了装置的更换,缩短了手术时间,降低了造影剂和辐射剂量,并减少了装置残余漏和内皮化不全等手术后并发症。
术后3个月CT随访发现,所有使用Watchman设备封堵成功的患者封堵器均无移位、脱落,研究组的残余漏较单纯封堵组少,且仅对照组中出现1例>5 mm的残余漏。尽管简化手术过程是否能提高手术的安全性尚未得到证明,但是减少设备和导管交换可以降低心脏穿孔、空气栓塞和设备栓塞等并发症发生的可能性。CT的高空间分辨率是一个关键的优势,它可以在手术前和手术后对心脏进行全面的可视化,再现性高,并且采集图允许重复处理。CCTA除能够更好地预测装置大小以确定LAAO的可行性外,在LAAO术后随访检测残余漏和评估装置位置方面也具有更高的敏感度[14,19]。CT三维重建技术的广泛应用可以进一步提高封堵植入的安全性,不仅是对于Watchman设备,对于越来越多的左心耳可用的封堵设备也是如此。
本研究的局限性:本研究为回顾性研究,可能存在选择偏倚,其次本研究纳入样本量相对较少,有必要进行更大规模的多中心联合研究验证;此外,建议进行较长时间的随访,以分析两组患者的长期疗效。
CCTA三维重建术前引导Watchman装置LAAO能术前进行封堵预手术,提前评估封堵器型号,判断封堵器的理想位置,可以明显提高器械选择的准确性和操作效率,显著减少了接受LAAO患者的手术时间和X线曝光时间,减少了医师和患者的辐射剂量和造影的放射剂量,对于有TEE禁忌证患者是一个较好的选择方案。尽管目前未统一标准化,但其优势依然十分显著,具有广泛的临床应用价值,不仅适用于Watchman装置封堵器,同样适用于其他类型的封堵器。
