感染性心内膜炎致脓毒性肺栓塞的多层螺旋CT诊断
2022-03-29周忠春侯化东刘慧王丽娟孙桂芳董学敏刘丽琼
周忠春,侯化东,刘慧,王丽娟,孙桂芳,董学敏,刘丽琼
1.昆明医科大学附属延安医院放射科,云南省心血管疾病重点实验室,云南省心脏疾病临床医学中心,云南 昆明 650051;2.昆明医科大学附属延安医院呼吸与危重症医学科,云南省心血管疾病重点实验室,云南省心脏疾病临床医学中心,云南 昆明650051;*通信作者 刘丽琼 chinallq888@126.com
脓毒性肺栓塞(septic pulmonary embolism,SPE)是一种不常见但严重的疾病,临床表现多无特异性,血培养阳性率低,采用组织病理学确诊通常不可行,且临床常忽视感染性心内膜炎与SPE的内在联系,从而延误诊治,影响预后。因此,大多数SPE的诊断主要依靠临床病史和CT特征。
近年关于感染性心内膜炎致SPE的CT影像报道较少,且多为小样本病例与个案报道,研究多集中于肺内病灶分析,缺乏全面总结肺动脉影像特点[1-4]。本研究拟分析感染性心内膜炎致SPE的多层螺旋CT(MSCT)特点,重点分析肺动脉影像特点,进一步提高对本病的认识和CT诊断能力。
1 资料与方法
1.1 研究对象 回顾性纳入2012年6月—2020年11月就诊于昆明医科大学附属延安医院收治的感染性心内膜炎致SPE患者34例,其中女21例,男13例,年龄3~51岁,平均29.5岁。纳入标准:感染性心内膜炎致SPE诊断明确,并行1次及以上胸部CT检查。排除标准:①临床资料(包括年龄、性别、原发病、血培养、超声检查)不完整;②图像伪影较大,病变显示不清。本研究经过本院医学伦理委员会批准(批号:2020-115-01)。
1.2 诊断标准 感染性心内膜炎诊断标准参照欧洲心脏病学会公布的2015版《感染性心内膜炎管理指南》[5],主要标准:①血培养阳性;②感染性心内膜炎影像呈阳性。次要标准:①易患因素;②发热;③血管现象;④免疫征象;⑤微生物学证据。确诊需满足2项主要标准,或1项主要标准+3项次要标准,或5项次要标准。
SPE诊断采用Cook等[6]的临床诊断标准,必须同时具备以下4项:①局灶或多灶性肺浸润影;②存在可作为脓毒性栓子来源的活动性肺外感染灶;③排除其他可能引起肺浸润影的疾病;④经合理抗菌药物治疗后肺浸润影吸收。
1.3 仪器与方法 采用Siemens Somatom Definition Flash双源CT、Philips Ingenuity 64排CT。所有患者均行胸部CT平扫,范围自肺尖至肺底,肺窗窗宽1 200~1 500 Hu,窗位-600 Hu,纵隔窗宽250~350 Hu,窗位40~50 Hu。
17例行心电门控全胸心脏大血管CT血管成像(双源CT),对比剂采用碘克沙醇,320 mgI/ml,双流注射,3~14岁用量1.0~1.5 ml/kg,流速1~3 ml/s,以四腔心层面左心房为触发层,触发阈值80 Hu;14~55岁用量0.8~1.2 ml/kg,流速4~5 ml/s,以升主动脉根部层面为触发层,触发阈值100 Hu,Bolus Tracking触发,管电压80~100 kV,采用自动毫安秒,准直宽度0.6,螺距0.17,重建层厚1.0 mm,重建间隔0.8 mm,矩阵512×512。
10例行胸部增强检查(64排CT),对比剂采用碘海醇,350 mgI/ml,用量1.0~1.2 ml/kg,流速3~4 ml/s,以气管隆突下2 cm升主动脉层面为触发层,触发阈值100 Hu,Bolus Tracking触发。管电压120 kV,采用自动毫安秒,准直宽度0.625,螺距0.918,重建层厚1.0 mm,重建间隔1.0 mm,矩阵512×512。
1.4 图像分析 由1位主任医师和1位主治医师采用双盲法共同阅片,意见不一致时协商确定。观察内容,①肺动脉表现:肺动脉栓塞特点;是否合并霉菌性肺动脉瘤(mycotic pulmonary artery aneurysm,MPAA):动脉瘤平扫特点、数目、好发部位、形态、瘤内赘生物分布情况、随病程变化特点、抗炎治疗是否好转;动脉导管未闭(patent ductus arteriosus,PDA)并肺动脉内膜炎特点。②心脏原发疾病及赘生物显示。③肺部表现:肺内病灶形态、分布部位、大小、数目、边缘;是否合并滋养血管征、空洞或气囊;随病程变化特点。
2 结果
2.1 患者一般情况 本组34例患者主要临床表现:发热31例,低蛋白血症30例。PDA 9例,肺动脉异物1例,心脏先天畸形2种或以上4例,室间隔缺损12例,主动脉窦破入右心房3例,心脏起搏器置换更换术后1例,三尖瓣赘生物4例。34例心脏超声均检出赘生物,包括右心系统赘生物28例,左、右心赘生物5例,PDA伴左心赘生物1例。
34例中误诊为肺隔离症1例,结核4例,常规肺栓塞3例,肿瘤2例,卡氏肺孢子虫感染1例,漏诊2例,其余均诊断为普通肺炎。19例2 d~8个月后行1次及以上复查。
28例经手术证实,4例行抗感染治疗,1例行介入治疗,1例自动出院。所有患者均行1次及以上血培养,其中19例阳性,包括链球菌属12例、真菌3例、葡萄球菌3例、革兰阳性菌1例。
2.2 SPE的肺动脉表现 12例出现MPAA,共18个,血培养阳性7例,包括链球菌3例、金黄色葡萄球菌2例、真菌2例,其中多发4例,肺叶分布部位见表1。双肺下叶外基底段、右肺中叶内侧段好发,均为3个,肺段动脉近、中、远段各9个、8个、1个。
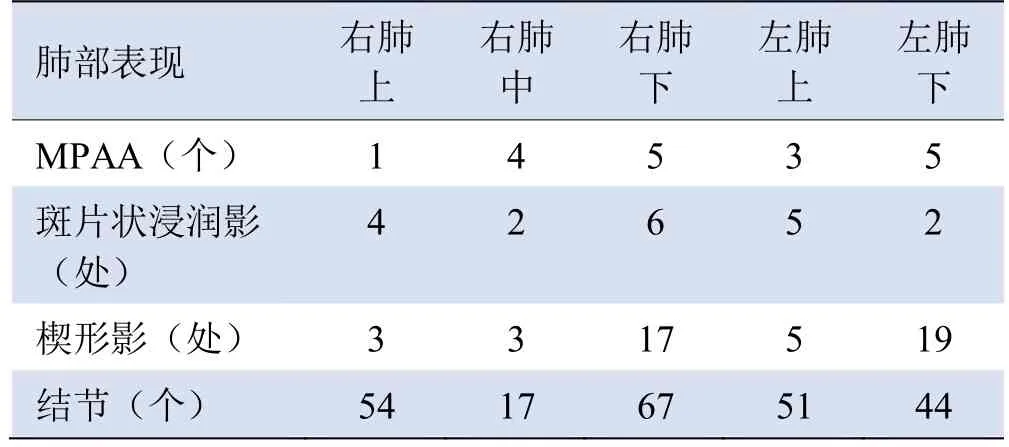
表1 MPAA 及SPE 肺部表现肺叶分布部位
4例5 个动脉瘤平扫示周围晕征(图1),13个呈囊状、5个呈梭形,12个边缘不规则,8个瘤壁增厚伴附壁充盈缺损,3个充盈缺损于远端呈界面改变,动脉瘤直径约0.3~2.5 cm,平均1.2 cm,6例急性期肺动脉瘤快速增大(图2),其中3例抗炎治疗后缩小、变细,2例无变化,1例8个月后动脉瘤增多;治疗前8例栓塞肺动脉稍增粗(图2B)。
2.3 SPE心脏原发疾病及赘生物的显示 17例行心电门控全胸心脏大血管CT血管成像均能清晰显示心脏病变。
10例表现为肺动脉内膜炎,包括1例肺动脉内异物尖旁肺动脉、8例PDA及1例含PDA复杂先天性心脏病未闭动脉导管血流前方肺动脉壁毛糙、不规则增厚(图3)。分布于肺动脉主干左上壁4例、前上壁2例、左侧壁2例、右侧壁1例、左肺动脉内上壁1例,局部膨隆6例(图4)。11例显示赘生物,存在于肺动脉内7例,表现为点、条、片状充盈缺损,三尖瓣3例;肺动脉瓣和三尖瓣1例,表现为瓣膜增厚、部分钙化。
10例行胸部增强扫描,6例显示心脏病变。6例显示赘生物,位于三尖瓣5例,位于肺动脉瓣和三尖瓣1例。
2.4 SPE的肺部表现 34例双肺均存在2种及以上多发、多种形态影(图5),各形态影肺叶分布部位见表1。11例19处出现斑片状浸润影、边缘模糊,其中2处伴空洞、气囊。27例47处出现楔形影,以宽基底贴近胸膜,尖端指向肺门,未见强化;14处伴空洞、气囊,10处伴滋养血管征。30例233个出现结节,以肺周分布为主,直径0.4~3.6 cm;90个伴空洞、气囊,92个伴滋养血管征,25例出现胸膜下索条。
2.5 SPE的肺部表现转归 19例复查患者中,11例出现部分病变吸收、部分病变增大或新增病变(图2),2例短期快速进展,3例无明显变化,3例稍有吸收。
3 讨论
SPE是由于肺外感染致含有病原体的栓子脱落后栓塞肺动脉,导致肺栓塞(或梗死)和局灶性肺脓肿。除肺栓塞常见的呼吸系统症状外,SPE还常伴有发热、肺内浸润影及原发病表现等[7]。SPE多与感染性心内膜炎、血栓静脉炎及中央静脉置管后感染、肝脓肿、静脉应用毒品成瘾者或血液系统恶性病变免疫抑制剂治疗后改变等相关,其中感染性心内膜炎以右心最常见[8-9],少数左心系统的菌栓可以通过心脏解剖结构畸形进入右心系统,引起SPE。本组28例为右心感染性心内膜炎,发生率与既往研究报道一致[10]。
SPE典型的CT表现为结节、胸膜下楔形影,伴或不伴空洞形成和滋养血管征,是诊断SPE的重要线索,但无特异性[4]。
3.1 SPE的肺动脉表现 MPAA是罕见的右心感染性心内膜炎并发症,是SPE的特异征象,也是感染性心内膜炎DUKE诊断次要标准之一,死亡率高于50%[11]。MPAA用于描述任何涉及动脉壁并导致动脉壁扩张的感染过程[12],其发生机制包括:①肺动脉脓毒栓子直接侵犯血管壁;②肺部感染性病灶直接延伸至邻近肺动脉。最常见的病原体为葡萄球菌和链球菌,本组7例MPAA血培养阳性菌包括链球菌、金黄色葡萄球菌、真菌,与既往研究[13]报道类似。
本组MPAA多为单发、囊状、边缘不规则、壁增厚。充盈缺损多分布于周边,部分分布于远端,可能与动脉瘤内血流形式改变和方向有关。动脉瘤周晕征可能是动脉瘤周出血所致[14],急性期肺动脉轮廓快速增大,表明肺动脉瘤发展迅速,破裂风险高,抗炎治疗后部分可缩小。MPAA好发于下叶外基底段、右肺中叶内侧段及肺段动脉近段、中段。平扫表现为肺混浊,无法与感染、肿瘤区分,漏诊率和误诊率较高,既往研究报道MPAA误诊为支气管内肿块活检引起致命大出血[15],因此对于可疑病灶,应首选CT血管成像检查。
治疗前8例栓塞肺动脉稍增粗,与炎症侵犯肺动脉壁有关。
PDA好发肺动脉内膜炎,表现为肺动脉壁毛糙、不规则增厚,部分伴赘生物,6例局部膨隆,多发生于肺动脉主干左上壁、前上壁、左侧壁,与胚胎发育PDA解剖偏于左肺动脉开口一侧有关[16],PDA左向右高速血流冲击肺动脉内膜使其损伤、胶原暴露,导致易形成赘生物[17]。一些圆锥形PDA肺动脉末端呈线性模样结构,在无其他临床证据的情况下,不应误诊为动脉内膜炎[18]。1例肺动脉内异物尖端旁肺动脉主干右侧壁发生肺动脉内膜炎,可能与异物随心脏大血管搏动损伤肺动脉壁有关。
3.2 SPE心脏原发疾病及赘生物显示 以上肺动脉内膜炎细微影像征象均由心电门控全胸心脏大血管CT血管成像显示,本组行心电门控全胸心脏大血管CT血管成像患者均能清晰显示心脏病变及大部分赘生物,优于胸部CT增强扫描,对于诊断SPE具有重要提示作用。心电门控全胸心脏大血管CT血管成像能显示整个胸部、冠状动脉和其他可移动心脏结构[19],可用于识别心脏大血管病变和赘生物,如冠状动脉瘘[20]。本研究认为,高时间和空间分辨率心电门控全胸心脏大血管CT血管成像是感染性心内膜炎致SPE的最优CT检查方法。
3.3 SPE的肺部表现 本组所有患者双肺均表现为多发性、多形性、外周分布为主,以斑片状浸润影、楔形影、结节为特征,结节和楔形影较多,发生率分别为88%(30/34)、79%(27/34),病变后期表现为索条,与既往研究报道一致[4]。病变具有形成空洞倾向,结节更常见,有效抗感染后呈薄壁空洞或气囊,与治疗时机及机体自身免疫力有一定的相关性[6]。右肺中叶、下叶较少发生斑片状浸润影,右肺上叶、中叶楔形影较少见,右肺中叶较少发生结节。19例复查病例中,11例病变迁延。
病理改变可能是由于菌栓间断、反复脱落栓塞肺小动脉,造成病灶多发、迁延,部分呈游走性。感染从肺动脉壁向周围扩散,形成结节或斑片状浸润影,如局部肺梗死呈楔形影,是较大的脓毒栓子阻塞肺动脉大分支引起的较大实变[21]。
本组21%(10/47)楔形影及39%(92/233)结节伴滋养血管征,表现为一支血管影连接病变中心,发生率较既往研究[22]略低,可能与不同CT扫描技术、观察者偏倚有关。小鼠模型中,Sawai等[23]证明SPE是由围绕小肺动脉的炎症细胞和纤维蛋白链构成的多个肺脓肿形成,这可能是滋养血管征的病理基础。
总之,对于先天性心脏病、右心感染性心内膜炎或感染性血栓静脉炎等高危患者,胸部CT除表现为多发性、多形性、外周分布及滋养血管征外,出现特异的MPAA、栓塞肺动脉增粗、肺动脉内膜炎,可及时诊断SPE。心电门控全胸心脏大血管CT血管成像是感染性心内膜炎致SPE的最优CT检查方法,可尽早明确病因,及时治疗。
