子宫平滑肌肉瘤次全切除术后病情控制不佳者的综合治疗1例
2022-03-29黄高廷姚晓雯杨静梁梦珊黄婷
黄高廷,姚晓雯,杨静,梁梦珊,黄婷
510095广州,广州医科大学附属肿瘤医院 妇瘤科(黄高廷、姚晓雯、杨静);510630广州,暨南大学附属第一医院 妇科(梁梦珊、黄婷)
子宫平滑肌肉瘤主要来源于子宫平滑肌细胞, 是子宫肉瘤最常见的类型,常表现为异常子宫出血、迅速增大的盆腔包块或腹痛等,预后差,且易以良性子宫肌瘤误诊而误治。全子宫联合或不联合双附件切除手术是治疗的标准术式,而术前以良性子宫肌瘤制定的肿瘤剔除或部分子宫部分切除等不全术式,是导致其复发率高、治疗棘手的原因之一[1]。现报道子宫平滑肌肉瘤次全切除术后病情控制不佳者的综合治疗一例。
1 临床资料
患者女,40岁,因“子宫平滑肌肉瘤子宫次全切除术后4月”于2020年5月9日首次入院。患者因“阴道不规则出血1+月”至当地县中医院查B超示多发性子宫肌瘤,于2020年1月10日行“腹式次全子宫切除+左侧输卵管切除术”,术中见:子宫明显增大,(浆膜下)宫体多发肌瘤样包块凸起,剖视肿瘤内见黄褐色液体流出。术后病理示:1)子宫平滑肌肉瘤;2)左侧输卵管化脓性炎。免疫组化:ER(2+), PR(2+), P16(+), Ki67(+,60%), p53(-),CK(-), CD10(-), Actin(+), Desmin(+), CK(-), H-caldesmon(+), CD34(血管+)。2月20日至外院复查,盆腔增强MRI示:阴道内肿物(92×80 mm),考虑复发,累及双侧卵巢、右侧输卵管,伴双侧髂总、髂内静脉多发癌栓,盆腔多发转移淋巴结。患者因新冠疫情原因,未进一步治疗。4月20日开始出现阴道持续性出血,量少,不可自止,4月28日复查B超示:盆腔巨大肿物(117 mm×89 mm)。5月8日至我院就诊,查增强MRI示:盆腔肿物(113 mm×87 mm×109 mm),考虑子宫肉瘤复发并侵犯阴道伴巨大癌灶空洞脓腔,多发肿大转移性淋巴结,左侧肾盂及输尿管扩张、积液,不除外右侧输尿管下段受侵(图1)。会诊外院病理示:中低分化子宫平滑肌肉瘤。入院诊断:1)子宫平滑肌肉瘤IB期次全子宫切除术后病情控制不佳; 2)重度盆腔炎性疾病; 3)中度贫血。既往史:高血压2级3+年,口服拜新同缓释片,自诉控制可。孕3产3,顺产。查体:贫血貌。妇检示:宫颈丧失原型,阴道内见分块状肿物突出,大小约5 cm,局灶坏死呈脓絮须状伴脓液流出,恶臭。三合诊:盆底扪及实性肿块镶嵌,固定,压迫直肠前壁,直肠黏膜光滑。入院查血常规示:WBC 13.08×109/L, Hb 78 g/L,肿瘤标记物未见异常,给予莫西沙星静滴,阿奇霉素口服,高锰酸钾盆浴等抗炎、静脉营养及纠正贫血等治疗后好转,于5月13日、6月17日给予2程化疗(方案:多柔比星脂质体+顺铂)。7月9日盆腔增强MRI示:盆腔肿物未见明显缩小,侵犯阴道较前稍好转,其余如前。7月13日行剖腹探查术,术中见盆腔包块与膀胱致密广泛粘连,并增生侧枝血管交错,局部粗隆,左侧附件被肿物包裹,无法完整切除盆腔肿物,告知其家属后同意行腹式右侧附件肿物切除+肠粘连松解术(图2)。术后病理示(图3):平滑肌肉瘤,侵及卵巢及输卵管肌层,免疫组化:ER(+), PR(+), SMA(+), Ki67(60%), Caldesmon(+), Actin(+), Desmin(+), p53(-), CD117(-), CD10(-), Dog-1(-), CD34(血管+)。8月5日盆腔增强MRI示:盆腔巨大肿物,大小同前(图4),经放疗科医师会诊,考虑巨大实性肿物,伴癌脓腔,放疗效果差,不宜放疗,遂予继续姑息性化疗1程(方案同前),建议后续增加内分泌治疗+抗血管生成治疗(安罗替尼),患者要求转诊至外院治疗。
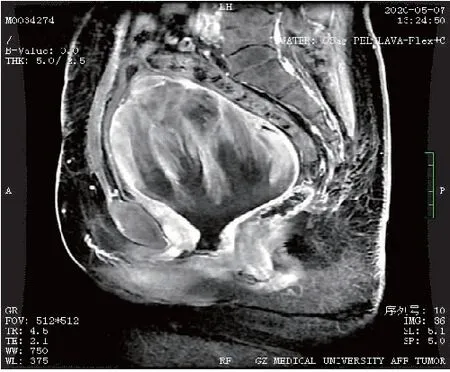
图1 患者行次全子宫切除术后复发的盆腔增强MRI检查(矢状面)
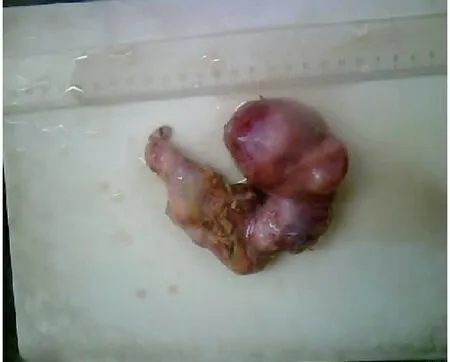
图2 右侧附件肿物
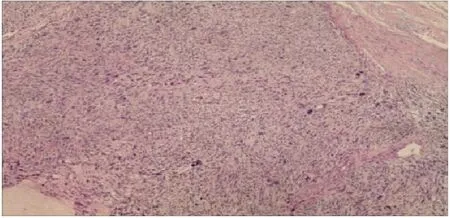
图3 右侧附件肿物切除术后病理(HE×100)
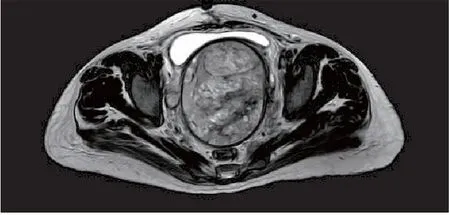
图4 患者行右侧附件肿物切除术后的盆腔MRI增强检查(水平面)
随访情况:9月12日患者至外院(广州某民营医院)行盆腔肿瘤氩氦刀冷冻消融术+右肾盂穿刺置管术,9月29日起行靶向治疗联合免疫治疗(安罗替尼8 mg/d+卡瑞利珠单抗200 mg Q3W)共1程,11月5日出现前下腹壁正中皮肤破溃并感染,复查盆腔MRI增强示:盆腔肿瘤局部消融术后改变,较前增大(15.3 cm×10.0 cm),侵犯邻近周边脏器受压,盆腹腔多发淋巴结较前增大,下腔、髂总及髂内外静脉内多发癌栓等;予抗炎治疗后,继续口服安罗替尼+卡瑞利珠单抗共2程,病情未见好转,2021年1月患者放弃治疗,于2021年2月24日死亡。
2 讨 论
子宫肉瘤为女性生殖道恶性肿瘤之一,约占1%,其中平滑肌肉瘤约占63%,预后差,易被误诊为良性子宫肌瘤治疗而误治,而二者尚无特异性肿瘤指标或影像学检查精准鉴别。子宫平滑肌肉瘤的临床症状并不典型[1],目前多通过阴道异常流血、生长速度或方式异常的盆腔包块,或伴盆腔疼痛等病史来初步辨别。尽管超声、CT或PET-CT等影像学可从血管增生数量、生长方式、血流阻力等方面辅助诊断,但缺乏特异性;术前增强MRI、术中剖视及冰冻病理有一定的临床意义,尤其是直径≥10 cm,实性肿物呈“鱼肉状”、合并囊内液或液性坏死等特征。而子宫肌瘤在影像学检查时大多界限清楚,实质内稀疏、分布规则或无血流信号,MRI检查在显示肌瘤数量、大小、位置及与宫腔的关系更具优势。对于局限于子宫的子宫平滑肌肉瘤,首选全子宫联合或不联合双附件切除手术,因其为非激素依赖型肿瘤,对于ER/PR为阴性且病变处于早期的年轻患者可考虑保留卵巢;而对于以子宫良性疾病接受治疗但术后确诊为肉瘤的患者,首选再次手术切除残留子宫、宫颈或附件等。盆腔淋巴是否需清扫仍存在争议,对可疑转移或术中探查肿大淋巴结可进行切除,存在宫外转移病灶应切除干净。对于Ⅰ期患者充分手术后亦可观察,并不建议常规辅助放化疗;Ⅱ~Ⅳ期患者术后辅助治疗包括化疗或放疗,或增加内分泌治疗(ER/PR阳性者)、抗血管生成靶向治疗或免疫治疗等。FNCLCC/NCI分级系统可用于辅助评估预后,筛选适合化疗的患者;对于病情控制不佳或复发的子宫平滑肌肉瘤,治疗目的是缓解症状、延长生存期。对于孤立病灶,尽可能手术完整切除盆腹腔转移灶,达到满意减瘤。本文中,患者因良性子宫肌瘤行子宫次全切除术,术后快速进展、病情控制不佳而形成盆腔巨大包块,且合并开放性癌灶脓腔,再次手术无法切除的病例,治疗棘手,目前国内外对其最佳治疗方案更无定论,多为探索性临床试验。
在子宫平滑肌肉瘤术后的辅助治疗方面,该病对放化疗均不太敏感,其中放疗仅有助于控制局部复发,不能改善总生存率。Pellanda等[2]对110例原发性子宫平滑肌肉瘤的治疗预后分析显示,辅助放疗在局部控制(88%)或区域控制(72%)方面治疗效果良好,但在远处转移率以及OS方面并未得到明显的改善。运用SEER数据库[3-4]的回顾性研究提示放疗对早期平滑肌肉瘤并无生存益处,但对于II期及以上患者,与单纯手术相比,联合放疗的患者生存率更高预后更好 (HR, 0.89; 95%CI, 0.83~0.95;P<0.001)。目前指南推荐适形或调强外照射放疗+近距离放疗以减少对正常组织的损伤,对于手术无法切除的肿瘤,宜评估、采用图像引导的外照射或近距离放疗。
化疗方面,大多数研究使用异环磷酰胺、阿霉素、吉西他滨和多西紫杉醇单药或联合药物治疗,反应率为17%~36%,但对于晚期患者,化疗的益处并不明显(5年生存率<30%)[5]。目前多推荐异环磷酰胺或多柔比星脂质体联合顺铂,吉西他滨加多西他赛等方案[1]。Hensley等[6]通过单臂SARC005研究发现,吉西他滨和多西他赛联合阿霉素的方案有助于治疗完全切除的高级别子宫平滑肌肉瘤患者,平均复发时间为27个月,2年及3年内无进展生存率分别高达78%、57%。然而,多西他赛联合吉西他滨化疗联合抗血管生成药物如贝伐珠单抗并不能提高疗效[5, 7],ORR分别为35.8%、31.8%,PFS分别为4.2、6.2个月,OS分别为23.3、26.9个月,差异均无统计学意义。
子宫平滑肌肉瘤靶向治疗是近年来的研究热点,主要有曲贝替定(trabectedin)、帕唑帕尼、安罗替尼等药物。2015年开始FDA批准曲贝替定用于不能手术切除或晚期(转移性)的子宫平滑肌肉瘤[5,8]。2020年一项西班牙多中心研究显示曲贝替定对晚期患者效果良好,中位PFS和OS分别为5.4月、18.5月,应用于≤2线治疗,患者中位OS达25.3个月,且安全性可控,而接受联合辅助性放化疗的患者的预期OS可达106.7个月[9]。但亦有研究认为其并无明显优势[5],例如2012年帕唑帕尼的Ⅲ期试验[10]显示与安慰剂相比,软组织肉瘤患者无进展生存期有所延长(4.6个月vs1.6个月), 总生存期未增加。亚组分析[11]显示帕唑帕尼在子宫肉瘤的效果(mPFS 3.0个月,mOS 17.5个月)与非子宫肉瘤类型无明显差别(mPFS 4.5月,mOS 11.1月)。帕唑帕尼、安罗替尼可抑制生长因子受体和激酶受体(如VEGFR、PDGFR、FGFR和c-KIT)等多个靶点,抑制肿瘤血管生成及肿瘤细胞增殖等,具有较好疗效和耐受性,两者分别经FDA和CFDA批准用于子宫平滑肌肉瘤的靶向治疗,而索拉非尼或舒尼替尼(酪氨酸激酶抑制剂)则在晚期和/或复发性子宫平滑肌肉瘤中的应答率最低(分别为 2.7%和8.7%),NCCN指南并未推荐其在此领域的应用[1, 5]。其他VEGF信号通路抑制剂(如贝伐单抗、西地尼布等)虽有治疗前景,然而目前循证医学证据提示其缓解疗效较低。另外,相比多柔比星,安那霉素在肺内蓄积水平高6~34倍,提示其有助于软组织肉瘤治疗,尤其是肺转移患者,2020年FDA授予其“孤儿药”称号,也为子宫肉瘤治疗化疗药物的选择带来新的研究方向。本病例中,在剖腹探查手术前后,全身化疗不敏感,未见明显获益,考虑患者巨大实性肿瘤合并开放性癌灶脓腔,不适宜近距离(腔内)或外照射放疗,治疗相当棘手。目前国内外指南推荐对子宫平滑肌肉瘤ER、PR阳性的患者行内分泌治疗,期待其在缓解临床症状,控制晚期进展或降低复发的疗效。除此之外,应积极探索靶向治疗、免疫治疗对此类患者可能带来的获益。
免疫治疗应用于子宫肉瘤治疗具有巨大的潜力,目前多聚焦在抗PD-1免疫治疗方面的探索性临床试验或个案报道。研究显示[12-13],平滑肌肉瘤可高表达PD-L1,约30%~70%,提示抗PD-L1抗体免疫治疗可能带来获益,临床亦有“抗PD-L1抗体联合放疗”治疗方案促使平滑肌肉瘤消退的报道[14-15],患者接受“化疗联合免疫治疗”或许能取得更高的抗肿瘤反应率同时延长生存期[16]。Monga等[17]通过回顾性分析对比多种免疫疗法,认为抗PD-1治疗在晚期、转移性平滑肌肉瘤的疗效和安全性显著,其中45%的患者(9/20)达到了PR,也有研究显示部分抗PD-1抗体(如纳武单抗)单药对晚期子宫平滑肌肉瘤患者未见获益[18]。奥拉单抗在治疗包括子宫平滑肌肉瘤在内的晚期软组织肉瘤临床试验中,初期取得明显的疗效,而在Ⅲ期ANNOUNCE研究证实其对改善患者的总生存率并无获益,也因此FDA取消其对软组织肉瘤治疗适应症的批准,该试验仍在进行当中。目前国内外对子宫平滑肌肉瘤的免疫治疗仍在不断探索,对于晚期复发、转移或难治性子宫平滑肌肉瘤,尤其是无法手术完整切除患者,应鼓励参加临床试验,以期改善症状,延长生存期。
影像学检查(如超声、CT、MRI等)引导下射频消融或海扶刀等治疗手段多在转移性、直径小的软组织肉瘤或肌瘤、腺肌症等疾病探索应用,如腹膜后、肝肺转移、骨肉瘤等,具有良好的应用前景[19-20],而在本病例中,盆腔巨大肿物合并脓腔的子宫平滑肌肉瘤方面的应用仍缺乏有力的循证医学证据,目前并不适用。另外,需强调的是,氩氦刀冷冻消融术在妇科肿瘤领域的应用和疗效尚无循证医学证据,应避免该治疗方式。本病例中,患者初次手术前有可能为子宫肉瘤(IB期),治疗预后相对较好,但却因术后控制不佳而病情发展迅速且综合治疗无效,于术后1年余死亡,值得我们妇科肿瘤医师反思并积极探索更有效的治疗方案。同时,该病例的经验再次提醒我们妇瘤医师在治疗考虑良性的子宫肿瘤时,应术前充分评估是否能保留宫颈或子宫,并强调术中冰冻病理的重要临床意义。鉴于本文患者的治疗教训,笔者强烈呼吁在妇科肿瘤领域取消以“良性肿瘤”行“子宫次全切除”的术式,或严格把控其指征,尤其是在基层医院。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
