PSMA-CAR慢病毒颗粒包装浓缩及感染CIK细胞的研究*
2022-03-29王丙萍段金凯高凤英高艳伟高维实
王丙萍,段金凯,高凤英,高艳伟,高维实
010017 呼和浩特,内蒙古自治区人民医院 肿瘤研究所(王丙萍),腹部肿瘤外科(高艳伟、高维实);010070 呼和浩特,内蒙古建筑职业技术学院 公共课教学部(段金凯);010010 呼和浩特,内蒙古医科大学 临床医学院(高凤英)
恶性肿瘤无论是在发生时还是在发展时都与宿主的免疫状态密切相关,而抗肿瘤免疫主要为细胞免疫。近年来,利用基因改造技术表达肿瘤特异性嵌合抗原受体(chimeric antigen receptor,CAR)的T细胞治疗技术在肿瘤治疗方面的研究进展迅猛,其在体内、体外和临床试验中均显示出良好的靶向性、杀伤性和持久性,为解决过继性细胞免疫治疗的局限提供了新的有效方案,并且展示了巨大的发展前景和应用潜力[1]。CAR技术不仅仅只是修饰T细胞,它还可以修饰CIK细胞、NK细胞以及γδT细胞等[2-4]。
前列腺癌是危害老年男性健康的常见癌症之一。前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)是一种比前列腺特异性抗原更具敏感性和特异性的前列腺癌标记物[5],目前已经被公认为是前列腺癌基因治疗中最具有意义的抗原及靶点。
病毒载体可以有效地将目的基因整合进靶细胞基因组,并且稳定表达,被认为是最有希望的基因治疗载体且较为常用[6]。相较于其它病毒载体,慢病毒载体具有致癌风险低、随机整合基因风险低、生产成本相对较低[7-8]以及高效转导非分裂细胞等特点,是安全有效且灵活制备CAR相关细胞的最佳选择[9]。为了临床实验或后期基因功能研究,获得高滴度的病毒以及高的感染效率是十分必要的。因此,本研究通过比较不同条件下PSMA-CAR慢病毒颗粒感染CIK细胞的效率,探讨PSMA-CAR慢病毒颗粒的最佳浓缩方法以及提升感染CIK细胞效率的方法。
1 材料与方法
1.1 实验材料
人胚肾细胞株HEK-293FT细胞购自中国科学院上海细胞所;慢病毒载体 PSMA-CAR为前期实验构建保存;空载体 PCDH-CAR(SBI,日本);包装质粒 PsAX2、OG(华西病理重点实验室惠赠)。质粒小提试剂盒(OMEGA,美国);聚乙烯亚胺(Polyethylenimine,PEI)(Ploysciences,美国);DMEM高糖培养基、胎牛血清(fetal bovine serum, FBS)、胰酶、opti-MEM 培养液(Gibco,美国);超滤管Millipore 100 kDa(Merck,德国);聚凝胺(Polybrene;Solarbio,中国);荧光标记单克隆抗体CD3-FITC、CD8-FITC、CD56-PE(BD,美国)。
1.2 实验仪器
二氧化碳培养箱及生物安全柜(Thermo,美国);倒置荧光显微镜(Leica,德国);FACSCalibur流式细胞仪(BD,美国);高速离心机(Eppendorf,德国);超速离心机(Beckman,美国);超净工作台(苏州泰安空气技术有限责任公司,中国)。
1.3 实验方法
1.3.1 慢病毒包装 将HEK-293FT细胞以1~2×106个/孔的密度接种于10 mm培养皿中,培养液为10%FBS+DMEM高糖,37℃、5% CO2培养箱中培养过夜。病毒包装前用新鲜预热的DMEM高糖培养基换液,继续培养2 h。以空载体PCDH-CAR(空载体)作为阳性对照,PSMA-CAR慢病毒载体的用量为20 μg,慢病毒包装质粒PsAX2和OG的用量为各10 μg。将2 mg/mL的PEI溶液于60 ℃水浴5 min,溶解后放至室温,将三种质粒和PEI溶液(质粒总量∶PEI的比例为1∶9)分别加入到opti-MEM培养液中,每管溶液总量为1.5 mL,轻轻混匀,在室温下放置5 min;将含有PEI的opti-MEM培养液缓慢加入到含质粒的培养液中,轻轻混匀,室温放置20 min,将混合液轻柔逐滴加入到10 mm培养皿中,轻轻混匀,于37 ℃、5%CO2培养箱中培养6 h后更换为含10%FBS的DMEM高糖培养液,培养24 h后用倒置荧光显微镜观察荧光情况,并用流式细胞仪检测转染效率。
1.3.2 慢病毒颗粒的浓缩 收集48 h及72 h的HEK-293FT转染细胞的上清培养液,4 ℃、3 000 rpm,低速离心10 min,将上清用0.45 μM滤膜进一步去除细胞碎片。此后分3种方法浓缩病毒颗粒:1)超速离心法:将过滤后的培养液分装在无菌干燥的超速离心管中,放置于超速离心机中4 ℃、30 000 rpm,离心3 h。离心完成后弃培养液,加入300 μL的培养液,在4 ℃下溶解沉淀物6 h,每小时轻轻震荡离心管数次,100 μL/管分装并冻存于-80 ℃;2)超滤管浓缩法:将过滤后的培养液分装在无菌干燥的超滤管中,每管13 mL,于4 ℃,5 000 g离心35 min,将滤膜上方剩余液体分装100 μL/管,冻存于-80 ℃;3)PEG-8000浓缩法:将过滤后的培养液30 mL加入5×PEG-8000+NaCl母液7.5 mL,放于4 ℃,每20~30 min混合一次,5~6次后,于4 ℃过夜。次日4 ℃,4 000 g离心20 min,弃上清,加入300 μL DPBS溶解病毒,100 μL/管分装并冻存于-80 ℃。
1.3.3 CIK细胞的培养 健康人静脉采血15 mL,生理盐水稀释1倍,淋巴细胞分离液与血液体积比为1∶2.5的比例分离外周血单个核细胞(peripheral blood mononuclear cell,PBMC)。培养基为GT-551,调整细胞浓度为2×106个/mL,第0天加入干扰素-γ 1 000 U/mL,37 ℃,5%CO2培养箱中培养。第1 d加入100 U/mL的IL-1α,50 μg/mL的CD3单抗,300 U/mL的IL-2。此后每隔2 d加入培养基及300 U/mL的IL-2,调整细胞浓度。FITC-CD3和PE-CD56抗体染色,流式细胞仪鉴定CIK细胞。
1.3.4 慢病毒感染CIK细胞 将培养5~7 d生长状态良好的CIK细胞接种于12孔板,密度为2×106个/孔,加入浓缩的病毒300 μL/孔,4 ng/mL的聚凝胺。此后分为两种方法:1)直接放入37 ℃,5% CO2培养箱中培养;2)室温(26 ℃)、150 g低速离心4 h后再于37 ℃,5% CO2培养箱中培养。感染48 h后通过荧光显微镜观察并通过流式细胞仪检测感染效率。
1.3.5 流式细胞检测 1)包装效率检测:转染24 h后,0.25%胰蛋白酶消化转染后的HEK-293FT细胞。以PCDH-CAR载体转染后的HEK-293FT细胞为阳性对照,检测PSMA-CAR载体转染后的HEK-293FT细胞,阳性细胞发绿色荧光;2)CIK细胞鉴定:CIK细胞培养3~4 d后聚集成团,出现集落;取出部分用DPBS洗涤,移液器将细胞吹散后用荧光标记单克隆抗体染色(CD3-FITC,CD56-PE;CD56-PE,CD8-FITC),洗涤细胞去除游离的荧光抗体后,上机检测;3)CIK细胞感染效率检测:慢病毒颗粒感染CIK细胞48 h后,取出部分细胞洗涤,移液器吹散后,用流式细胞仪的荧光素异硫氰酸盐(fluorescein isothiocyanate,FIT)C通道检测绿色荧光蛋白(green fluorescent protein,GFP),从而检测出CIK细胞感染效率。
1.4 统计学方法
应用SPSS 19.0进行数据统计分析,采用单因素方差分析,在P<0.05时被认为差异具有统计学意义。
2 结 果
2.1 PSMA-CAR慢病毒载体的包装结果
转染24 h后,可明显观察到细胞发绿色荧光(图1),这说明目的质粒转染成功,目的基因正常表达。通过流式细胞仪检测GFP的表达情况(图2),测定PSMA-CAR慢病毒表达载体转染效率为67.71%±4.47%,对照组空载体的转染效率为77.74%±4.98%(F=6.729,P=0.060),两组之间的差异无统计学意义。

图1 HEK-293FT细胞包装慢病毒载体的明场图和荧光图

图2 慢病毒包装效率检测流式细胞图
2.2 CIK细胞的培养结果
健康人外周血分离PBMC后,经细胞因子诱导为CIK细胞,第0 d为散落的颗粒状细胞,3~4 d后聚集成团,出现CIK细胞集落(图3)。培养5~7 d,经流式细胞仪鉴定(图4),CD3+细胞为85.28%±17.67%,CD3+CD56+细胞为22.02%±2.68%,CD8+CD56+细胞为23.09%±6.85%,确定为CIK细胞后,进行下一步的慢病毒感染实验。
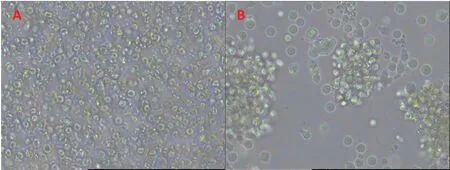
图3 CIK细胞培养

图4 CIK细胞鉴定
2.3 慢病毒感染CIK细胞不同感染方法的比较
用超速离心法获得的PSMA-CAR慢病毒浓缩颗粒感染CIK细胞,倒置荧光显微镜下观察结果显示:无论从CIK细胞的绿色荧光亮度上还是从感染效率上,室温+长时间低速离心步骤的加入都明显提高了慢病毒感染CIK细胞的效率(图5)。流式细胞仪的检测结果显示(图6):未加入离心步骤时,感染效率为2.73%±0.75%,加入离心步骤后,感染效率可达32.04%±1.66%,差异有统计学意义(F=766.84,P<0.01)。

图5 不同方法感染CIK细胞的明场图和荧光图

图6 不同方法感染CIK细胞的流式细胞比较
2.4 不同方法浓缩的慢病毒颗粒感染CIK细胞的比较
本研究应用了3种方法对慢病毒颗粒进行浓缩,用浓缩后的慢病毒颗粒感染CIK细胞,结果表明(图7、8),获得的慢病毒浓缩颗粒的感染CIK细胞效率3种方法分别为超滤管浓缩法6.98%±0.77%,超速离心法32.04%±1.66%,PEG-8000浓缩法53.47%±4.72%(F=189.70,P<0.01),3种方法之间的差异有统计学意义。
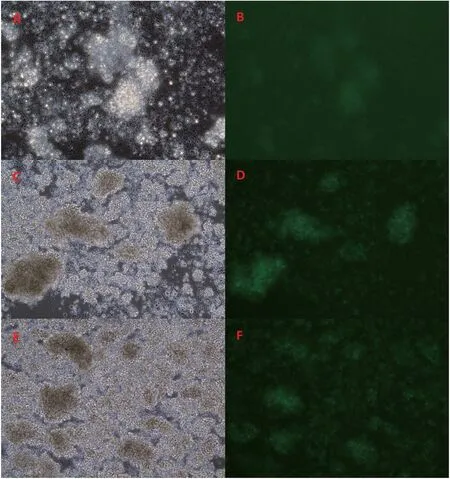
图7 不同浓缩方法获得的慢病毒颗粒感染CIK细胞的明场图和荧光图

图8 不同浓缩方法获得的慢病毒颗粒感染CIK细胞的流式细胞比较
3 讨 论
前列腺癌是危害老年男性健康的常见癌症之一,其发病率在我国呈明显的逐年上升趋势。前列腺癌具有潜伏期长、发病率高的特点,但临床上其早期诊断率却很低,因此大多数患者失去了早期手术根治的机会。PSMA是存在于前列腺腺上皮细胞且横跨细胞膜的II型固有膜蛋白,由于其在前列腺癌上皮细胞尤其是在雄激素非依赖性前列腺癌及其转移灶中有最高的表达[10],明显高于正常前列腺上皮细胞内的表达,并且在前列腺外的实体肿瘤供应营养物质的新生血管的内皮细胞中也有表达,但在前列腺外的正常组织中不表达或少量表达[11],因此可以作为前列腺组织的标记物。
目前CAR-T细胞技术在淋巴瘤[12]、卵巢癌[13]、神经母细胞瘤[14]、白血病[15]、多发性骨髓瘤[16]、乳腺癌[17]等恶性肿瘤患者的治疗中均显示出良好的抗肿瘤效应[18-20]。CAR-T的发展十分迅速,然而应用仍然还面临许多困难,比如:临床上使用的CAR-T疗法所带来的脱靶毒性、器官毒性等;肿瘤微环境的免疫抑制、抗原表达缺失或下调以及CAR-T细胞持久性不足等导致仍有患者复发;治疗实体瘤效果不佳,不能够有效地浸润到肿瘤组织内部;CAR-T细胞生存时间不长。
基于CAR-T疗法的原理,研究人员通过CAR修饰CIK细胞、NK细胞以及γδT细胞等,以期解决CAR-T疗法所面临的难题。CIK细胞是以T细胞为主的非均质细胞群,兼具有T淋巴细胞强大的抗肿瘤活性和NK细胞的非限制性杀瘤等优点。相较于CAR-T,选用CIK这种异质混合型的细胞[21]对于治疗时易产生的严重副反应有减轻作用。除了血液肿瘤之外,CAR-CIK细胞在实体瘤研究中也取得一定的效果。通过Her-2、EGFR[22]、CEA[23]等肿瘤潜在靶点,可以实现对实体瘤的靶向杀伤。
免疫细胞转染效率不高一直是困扰其基因改造的一个难题,慢病毒载体可以像转导分裂细胞一样,高效转导非分裂细胞,因此其可以转导更为广泛的细胞,包括那些难转导的血液前体细胞、神经细胞、淋巴细胞和巨噬细胞[24]。本研究结果表明,在应用慢病毒颗粒感染CIK细胞时,仅仅加入转染增强剂聚凝胺并不能提高其感染效率,只有在加入转染增强剂的同时,通过室温(26 ℃)+长时间(4 h)+低速离心(150 g)处理才能使转染效率达到可观的目标,这与此方法增加了病毒颗粒与CIK细胞接触的紧密度可能相关。
为了临床实验或后期基因功能研究,获得高滴度的病毒是十分必要的。而通过研究不同慢病毒载体质粒的包装能力,发现随着插入目的片段的增长,病毒滴度则呈现半对数形式下降,目的质粒愈长则包装有活力病毒颗粒的能力愈下降[25]。因此当研究的目的基因较大时,选择优化后的病毒包装体系才可能得到高效率的病毒颗粒。为了产生足够数量的基因工程化免疫细胞用于临床实验,生产大量的慢病毒并进行浓缩处理是必要的。本研究结果表明,相较于超滤管浓缩慢病毒的方法,超速离心法和PEG-8000浓缩法更能提高PSMA-CAR慢病毒的浓缩效率,并且PEG-8000浓缩法的效率远远高于超速离心法。在进行少量病毒浓缩时,超滤管浓缩法是方便快捷的方法,但需要浓缩病毒量较多时,则需要较多耗材,费用巨大;应用超滤管浓缩慢病毒时需要根据包装出慢病毒的大小选择超滤管的型号,型号选择不准确也可能是导致浓缩效率不高的原因之一;此外,超滤管不只浓缩了慢病毒颗粒,还浓缩了培养液中的盐离子及酸碱指示剂等成分,浓缩这些成分可能是导致感染后CIK细胞凋亡较多,造成感染效率不高的主要原因。超速离心法对设备和耗材的要求很高,但目前中国没有国产的超速离心机,进口超速离心机价格都很贵,并不是一般实验室所能配备,并且和设备相匹配的超速离心管价格也很昂贵,属于一次性耗材,因此超速离心法不适用于大量制备慢病毒颗粒。PEG-8000浓缩法所需试剂耗材价格低廉,实验设备要求不高,并且浓缩效率较高,是大量浓缩慢病毒颗粒的首选方法。
本研究的结果显示,在倒置荧光显微镜下观察,CIK细胞的转染效率比流式细胞仪检测结果要高。这可能是由于GFP吸收的光谱,最大峰值为395 nm(紫外线),并有一个峰值为470 nm的副峰(蓝光);发射光谱最大峰值为509nm(绿光),并带有峰值为540 nm的侧峰。GFP的光谱特性与FITC很相似,因此为荧光素FITC设计的荧光显微镜滤光片组合同样适用于GFP观察;但倒置荧光显微镜的蓝光激发滤色片为460~490 nm,其发射片波长为515 nm,而流式细胞仪滤光片的488 nm激光的荧光通道则包括530/30 nm、585/42 nm、670 nm LP。这就导致在倒置荧光显微镜下观察的结果与流式细胞仪检测的结果不一致。由于慢病毒包装时的转染为瞬时转染,目的载体进入细胞中的数量不一致,这就导致细胞表达 GFP时有强也有弱,应用倒置荧光显微镜观察时,可增大激发光的强度,发光较弱的细胞也能观测到,这也可能是导致流式细胞仪检测结果相对低一些的原因。因此,本研究的实际转染效率应高于流式细胞仪所检测的结果。
综上所述,随着肿瘤免疫学理论和技术的发展,利用基因工程修饰免疫细胞的过继性免疫治疗,将成为治疗恶性肿瘤的有效手段。本研究通过比较PSMA-CAR慢病毒颗粒感染CIK细胞的效率,探讨PSMA-CAR慢病毒颗粒的最佳浓缩方法以及提升感染CIK细胞效率的最佳方法,从而为应用CAR 技术治疗前列腺癌奠定基础。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
