晚期非小细胞肺癌特殊人群免疫治疗临床研究进展*
2022-03-29刘铮田鹏李东
刘铮,田鹏,李东
610036成都,中国人民解放军西部战区总医院 肿瘤诊治中心
肺癌在全球范围内发病率和死亡率仍呈上升趋势,在以手术、放化疗为主的传统治疗手段下,肺癌患者整体5年生存率不足21%[1]。近年来随着肿瘤免疫治疗异军突起,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)如程序性死亡受体1(programmed cell death protein 1, PD-1)、程序性死亡配体1(programmed cell death ligand 1, PD-L1)和细胞毒性T淋巴细胞相关抗原4 (cytotoxic T lymphocyte antigen 4 ,CTLA-4)单克隆抗体的单药治疗或联合化疗已成为针对转移性晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的主流一线疗法[2-5]。然而一些特殊人群,例如免疫功能受损(慢性病毒感染和免疫抑制剂使用)、免疫系统失调(自身免疫疾病和移植)、合并严重疾病(器官功能障碍与中枢神经系统转移)、高危(孕妇、高ECOG/PS评分以及高龄)患者往往被排除在ICI药物临床试验之外,在真实世界当中ICI药物治疗对上述特殊人群中的安全性和有效性目前仍有待进一步明确。本文聚焦这部分特殊人群,对目前相关的临床研究进行回顾和综述,旨在为ICI在这些人群中的临床应用提供参考和依据。
1 ICI作用机制
免疫检查点是在特异性细胞免疫中发挥抑制性作用的一类分子,主要通过作用于机体特异性免疫反应通路中的特定位点来抑制T细胞的过度激活,维持免疫耐受,在保护正常组织免受免疫攻击过程中发挥重要作用。肿瘤细胞也可以利用此机制来逃避免疫细胞的杀伤。目前已经发现免疫检查点分子主要包括PD-1/PD-L1、CTLA-4、含免疫球蛋白及ITIM结构域的T细胞免疫受体(T cell immunoreceptor with Ig and ITIM domains,TIGHT)、淋巴细胞活化基因3(lymphocyte-activation gene 3,LAG-3)、TIM-3、T细胞激活抑制物免疫球蛋白可变结构区域(V-domain immunoglobulin suppressor of T cell activation,VISTA)等。其中PD-L1和CTLA-4是目前最重要的两种免疫检查点。PD-1可与PD-L1结合,通过向下调节免疫系统对人体细胞的反应促进T细胞向Treg细胞转化,抑制多种类型免疫活性细胞的活化与增殖,是肿瘤免疫逃逸的重要机制。CTLA-4是一种广泛表达于T淋巴细胞、B淋巴细胞和成纤维细胞表面的受体蛋白,在肿瘤免疫反应抗原提呈早期阶段,T淋巴细胞表面的受体CTLA-4与共刺激受体CD28竞争性结合抗原提呈细胞表面的B7-1(CD80)和B7-2(CD86)配体。然而,CTLA-4受体与B7配体结合亲和力更高,抑制CD28与B7配体的结合,减少细胞因子IL-2的产生,从而抑制肿瘤免疫反应。不同于传统放化疗的直接杀灭作用,ICI类药物通过抑制免疫逃逸、激活自身免疫系统来杀灭肿瘤细胞;目前已经应用于临床治疗的ICI药物主要包括PD-1/PD-L1抑制剂(纳武单抗、帕博利珠单抗、度伐利尤单抗与卡瑞丽珠等)、CTLA-4抑制剂(伊匹单抗、tremelimumab等)。此外,一些其他ICI如TIGHT抑制剂Tiragolumab、LAG-3抑制剂IMP32、TIM抑制剂TSR-022等的临床研究也在进行中,其中Tiragolumab与PD-L1联合治疗晚期NSCLC的二期临床研究展现出良好疗效[6],极具临床应用前景。
2 ICI在免疫功能受损的晚期NSCLC特殊人群的临床应用
2.1 慢性病毒感染者
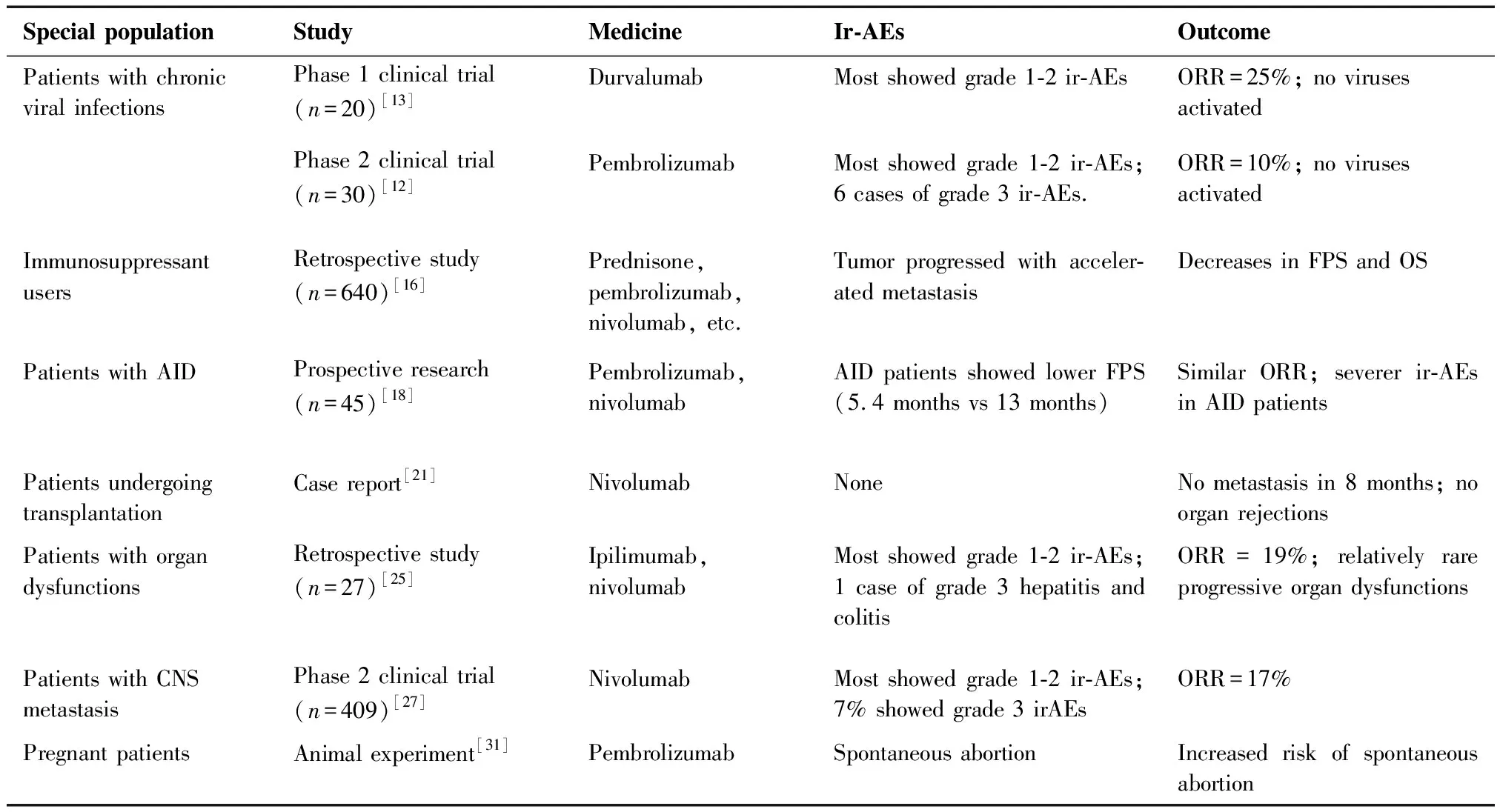
研究表明ICI可以用于晚期NSCLC合并慢性病毒感染患者,但临床应用仍需谨慎。携带乙型/丙型肝炎病毒的肝细胞癌患者应用抗PD-1药物的相关临床研究提示免疫治疗疗效与病毒状态无关,且没有乙型/丙型肝炎爆发的病例出现[7]。Tio等[8]报道1例合并丙型肝炎且接受抗病毒治疗(来迪派韦索磷布韦片)的晚期NSCLC患者在应用纳武单抗后并未出现病毒载量增加等明显毒副作用。另一项前瞻性观察研究显示,在合并丙型肝炎的实体肿瘤患者中,12例(6%)接受了ICI治疗,其中4例患者经过9个月的回访,均未出现丙型肝炎病毒再激活或丙型肝炎病毒相关性肝炎[9]。Byeon等[10]发现,在237例接受抗PD-1药物治疗的晚期NSCLC患者中,14%患者合并乙肝病毒感染,这些合并乙肝病毒感染的患者发生肝炎的几率高于未合并乙肝病毒感染的患者(18.8%vs8.91%,P=0.082),且乙肝病毒感染患者发生3级及以上严重肝炎的几率更高(12.5%vs1.9%,P=0.0021),但这些毒副反应均在可控范围。这些研究表明:对于合并乙型或丙型肝炎感染的NSCLC患者,ICI治疗总体来讲是安全和有效的,但对于这部分患者应用ICI治疗仍需谨慎,尤其是病毒DNA、RNA仍处于复制阶段的患者,我们仍需首先应用抗病毒药物,待病毒DNA载量基本恢复正常后再考虑使用ICI[10]。此外,ICI引起的免疫相关性肝炎与病毒再激活引起的病毒性肝炎在鉴别诊断上可能存在一定困难,尤其免疫相关性肝炎需采用激素或免疫抑制剂治疗,这些药物治疗可能引起病毒再激活,可能需要预防性抗乙肝/丙肝病毒治疗。
目前,合并HIV的肿瘤患者接受ICI治疗疗效资料十分有限。Cook等[11]的回顾性研究发现:73例伴HIV感染的晚期癌症患者中(其中25例为NSCLC患者),62例患者接受抗PD-1治疗,6例接受抗CTLA-4治疗,4例接受抗PD-1/CTLA-4治疗,1例接受伊匹单抗(ipilimumab)和纳武单抗(nivolumab)序贯治疗,结果显示:接受ICI治疗的23例晚期NSCLC人群的总体有效率与普通人群相似,均为30%(7/23),表明HIV病毒状况并不影响ICI的疗效。从副反应发生情况来看,70例患者中仅有6例(8.6%)发生了3级或更高的免疫相关不良反应。仅有极个别患者(7%)发现了病毒异常激活。最近,两项前瞻性研究还表明:对于HIV合并晚期NSCLC患者来说,分别使用帕博利珠单抗和度伐利尤单抗治疗时并没有病毒激活且二者抗肿瘤活性良好[12-13]。这说明在这部分人群中,ICI可能仍是安全有效的治疗选择。同时,在HIV患者中,ICI可能增强HIV患者的特异性免疫应答反应而增强抗病毒治疗效果。对于接受抗逆转录病毒治疗但HIV病毒载量仍持续存在的肿瘤患者,采用ICI治疗方案有可能提供增强病毒清除的特殊免疫反应[14]。但目前尚不确定其是否会导致免疫系统的过度激活,在临床实践中应尽可能持续监测这些患者CD4、CD8的数量。
总之,就现有证据来看,ICI是乙肝、丙型肝炎或HIV感染合并肿瘤的患者的一种安全有效的治疗选择。但仍需要警惕病毒再激活和免疫相关不良反应。未来,还需要进一步进行前瞻性临床试验来明确ICI在合并慢性病毒感染的晚期NSCLC患者中的作用。
2.2 免疫抑制剂使用者
免疫抑制剂(如皮质类固醇)的使用可能通过抑制T细胞功能从而潜在地削弱免疫疗法的疗效。因此,长期、大剂量使用免疫抑制剂的患者往往未被纳入ICI的临床研究中,导致我们对其安全性和有效性知之甚少。由于部分ICI(如伊匹单抗)会引发患者肾上腺功能不全等免疫相关不良反应,临床中广泛应用生理/替代剂量的皮质类固醇来治疗这种副作用,且此类情况下短期应用类固醇不会对ICI疗效产生负面影响[15],而长期接受超生理剂量的类固醇是否会影响ICI治疗效果目前尚有争议。有研究表明:在ICI治疗前应用泼尼松>10 mg/天的患者,其无进展生存期与总体生存期要比应用≤10 mg/天泼尼松的患者短[16],但此类研究相对较少,且均为回顾性数据,尚不足以形成明确结论。
总之,现有研究结果不支持患者在ICI治疗之前停止类固醇治疗,也不支持将类固醇使用者排除在临床研究之外。多数研究支持使用免疫抑制剂来治疗ICI的毒副作用。临床实践中需要根据患者的具体情况来决定是否使用或停止使用类固醇激素。
3 ICI在免疫功能失调的晚期NSCLC特殊人群的临床应用
3.1 自身免疫性疾病(autoimmune disease,AID)患者
NSCLC患者中AID患病率约为14%,但ICI类药物具有潜在的激活患者免疫系统的风险,可能会造成AID的恶化或病毒的大量激活,因此ICI药物的临床试验也很少纳入上述患者[17],ICI对于合并AID的肿瘤患者的疗效和安全性尚不清楚。
AID患者在使用ICI时,自身反应性T细胞针对宿主组织的异常激活可引起ICI相关不良反应,尽管大多数ICI相关不良反应可以通过使用皮质类固醇激素得到控制,但严重患者仍有死亡风险。Danlos等[18]的研究模型表明,合并AID的肿瘤患者在使用ICI时不良反应发生率较普通人群高,但多是轻微可控的,ICI停药率在25%左右,并且3级以上严重不良反应的发生率与普通人群相同。AID与非AID肿瘤患者的无进展生存期和总体生存率相似;但合并活动期AID的患者生存期较短,ICI对其生存期的影响尚不清楚。
总之,现有数据表明ICI可以应用于非活动性AID合并晚期NSCLC患者。在所有纳入研究的AID病例中,有一半存在可控的病情恶化的风险。因此,每一个合并AID的肿瘤患者都应在使用ICI治疗前进行个体化评估,并在使用过程中对这些患者进行密切观察以尽早发现病情变化并处理。此外,我们对于更严重和有症状的AID或特殊类型的AID患者的ICI治疗风险还知之甚少,还需要更深一步的研究之后再考虑将ICI广泛应用[19]。
3.2 移植患者
移植(实体器官或造血干细胞)患者需要适当地用药控制自身免疫系统,以维持同种异体移植的耐受性并防止宿主抗移植物病(host versus graft disease,HVGD)或移植物抗宿主病(graft versus host disease,GVHD)。数据表明,PD-1/PD-L1通路对于维持移植器官免疫耐受性尤为重要,并且PD-1基因的多态性会直接影响移植物存活与否。对于合并晚期NSCLC的器官移植患者来说,使用ICI很可能激活宿主的免疫反应从而引发严重后果[20]。目前对于器官移植患者能否使用ICI以及使用剂量还没有任何指南可供参考。
对于晚期NSCLC患者的应用情况,仅有个别病例报道:接受了心脏移植手术的NSCLC患者接受了纳武单抗治疗后,肿瘤控制良好,且没有出现任何HVGD;且移植术后时间越久,发生排斥的风险相对减小[21]。但也有报道接受肾移植后的NSCLC患者在使用纳武单抗后出现严重的急性血管排斥反应(Banff IIB型)[22]。总之,这方面病例资料十分有限,尚需要积累更多相关病例和治疗经验。
对于造血干细胞移植后的血液系统肿瘤复发患者应用ICI治疗的安全性,目前已有多项研究结果。在一项针对28例干细胞移植后复发性血液系统恶性肿瘤患者的研究中, Davids等[23]以伊匹单抗分别进行3mg/kg或10mg/kg,4疗程诱导治疗后,选取有临床获益的患者每12周额外给药1次至60周。结果表明,在接受10 mg/kg剂量治疗的22例患者中,5例(23%)完全缓解,2例(9%)部分缓解,6例(27%)肿瘤负荷减轻。其中14%的患者会随剂量增加而发生GVHD,21%的患者出现免疫相关的不良事件(包括1例死亡)。因此尽管发生了免疫介导的毒性作用和 GVHD,仍建议在同种异体造血干细胞移植后复发性血液系统肿瘤患者中使用伊匹单抗。
对于血液系统肿瘤接受造血干细胞移植患者而言,ICI应用的安全性和有效性可作为参考,但并不能作为接受器官移植的NSCLC患者使用ICI的直接依据。还需要更加细致、严谨的前瞻性实验来明确器官移植患者罹患NSCLC后ICI的使用风险。
4 ICI在合并严重疾病的晚期NSCLC特殊人群的临床应用
4.1 器官功能障碍者
NSCLC患者中相当一部分患者存在心、肝、肾等慢性器官功能障碍[24]。然而,ICI和其他单克隆抗体主要通过循环吞噬细胞代谢为肽和氨基酸,并非经过肝或肾代谢,避免了药物在此类患者体内蓄积而增加毒性。为了明确ICI在器官功能不全患者中应用的安全性和有效性,Kanz等[25]选择了27例有心、肝或肾功能不全的肿瘤晚期患者(肌酐水平≥176.8 μmol/L或肌酐清除率<30 mL/min、肝酶或胆红素水平为正常值3倍、影像学诊断为肝硬化或心脏射血分数<45%)进行抗PD-1/PD-L1药物治疗。其中3例为NSCLC患者,其中只有1例同时罹患滤泡性淋巴瘤并合并肾功能不全的患者发生了3级肝炎与结肠炎,另外两例并未发生3级以上不良反应。因此,慢性器官功能障碍并不是抗PD-1/PD-L1的绝对禁忌症,可以将ICI纳入合并慢性器官功能障碍的NSCLC患者治疗方案。
4.2 中枢神经系统转移患者
由于血脑屏障的存在,晚期NSCLC中枢神经系统转移患者预后较差。目前已有动物模型实验证明了ICI可以部分穿过血脑屏障,临床研究也提示ICI可以诱发颅内反应,但尚无明确证据表明ICI能否自由穿过血脑屏障[26]。Crinò等[27]对409例有中枢神经系统转移的晚期NSCLC患者选用纳武单抗进行治疗,其中68例患者(17%)出现客观有效反应,仅有27例(7%)的患者出现了3~4级严重不良反应。
同时,研究发现免疫治疗与颅内放疗可能存在协同作用。Chen等[28]在对260例接受立体定向放射治疗的晚期NSCLC脑转移患者的研究中发现,79例同时使用ICI治疗的患者相比于仅接受放射外科/立体定向放射治疗的患者,中位生存期由12.9个月提高至24.7个月。在阿特珠单抗对比多西他赛的随机对照研究中,85例NSCLC脑转移的患者接受了阿特珠单抗治疗,其总体生存期的中位数为20.1个月,而多西他赛组的总体生存期为11.9个月(HR: 0.5,95%CI: 0.31~0.94)[29]。另一项关于帕博利珠单抗II期临床研究的结果表明,33%的晚期NSCLC患者颅内转移灶较前缩小[30]。这些研究数据支持NSCLC中枢神经系统转移患者可单独或联合使用ICI。
5 ICI在高危晚期NSCLC患者中的临床应用
5.1 孕妇
孕妇怀孕期间罹患癌症,胎儿将面临巨大风险。研究表明,胎盘可大量表达PD-L1,PD-1/PD-L1相互作用在维持胎儿耐受性中起着关键作用。此外,PD-1/PD-L1抑制剂作为IgG类抗体能够通过胎盘屏障,可能从母亲直接进入胎儿体内。动物研究已经证实抗PD-1/PD-L1会明显增加自然流产的风险[31]。目前,美国食品药品监督管理局已将抗PD-1药物归为妊娠D类用药。因此抗PD-1/PD-L1药物在妊娠妇女中的使用可能会带来极高的自然流产风险,而对孕产妇的风险尚不明确,胎儿出生后发生先天缺陷的风险也未知,临床中不建议对怀孕的NSCLC患者进行ICI治疗。
5.2 ECOG/PS高评分患者
临床中评估肿瘤患者的体力活动状态常使用PS评分或ECOG评分。高评分患者通常指ECOG/PS≥2分的肿瘤患者。多数研究表明,ECOG评分低的患者在接受ICI、化疗或靶向药物治疗时的临床结果更好[32]。纳武单抗Checkmate 153研究结果表明:包括PS评分为2分的组在内,所有亚组在使用ICI治疗之后的生活质量都有统计学意义上的显著改善,但PS评分为2分的患者的总体中位生存期只有4个月,显著低于总体人群的9.1个月的中位生存期[33]。
从毒副作用发生情况来看,Checkmate 153实验结果发现,PS评分为2分的人群中有3%因为ICI药物毒性而停止治疗,并且在PS评分为2分的群体与0~1之间群体的药物相关不良反应发生率没有明显区别[13/123(11%) in PS=2; 146/1 230(12%) in 0 半数NSCLC患者在诊断时年龄超过70岁,15%患者超过80岁。研究表明:年龄并不能预测应用ICI后总体生存率的高低[34]。Felip等[35]在肺鳞癌患者应用ICI试验中(Checkmate171)发现,老年患者(≥70岁)中位总体生存期与总体人群总生存期一致,均为11.9个月。 对3项对比帕博利珠单抗(pembrolizumab)和化疗在PD-L1表达≥1%人群中疗效的随机临床研究(KEYNOTE-010,024,042)进行综合分析发现:对于≥75岁的患者使用帕博利珠单抗对比传统化疗同样显著提高了总体生存率,老年和非老年患者的1年总体生存率相当。免疫相关不良事件在老年和年轻患者中的发生率没有明显区别[36]。Checkmate153的IIIB/IV期研究同样发现,在1 426例登记的晚期NSCLC患者中,39%的患者年龄在70岁或以上,3~4级治疗相关不良事件的发生率(12%~14%)在各亚组和总体人群中相似;70岁以上患者的中位总体生存期为10.3月,总体人群中位生存9.1个月,二者无显著差异[37]。然而,也有回顾性研究发现,尽管免疫不良事件的发生率没有差异,老年患者的无进展生存期较年轻人更短,总体生存率较年轻人更低[38]。总之,大多数研究表明年龄对于使用ICI的疗效和安全性来讲目前并没有明确影响,老年人和年轻人同样可以从ICI治疗中获益。特殊人群晚期NSCLC ICI治疗结果详见表1。 表1 特殊人群晚期NSCLC ICI治疗结果 Special populationStudyMedicineIr-AEsOutcomePatients with high ECOG/PS scorePhase IIIB/IV clinical trial (n=1,426)[37]Nivolumab12%-14% showed grade 3-4 ir-AEsOS in ECOG≥2 patients: 4.0 months; OS in ECOG<2 patients: 9.1 monthsThe elderlyPhase IIIB/IV clinical trial (n=1,426)[37]Nivolumab12%-14% showed grade 3-4 ir-AEsOS in the elderly: 10.3 months; OS in all patients: 9.1 months 在晚期NSCLC患者中,特殊人群由于自身或药物的原因导致机体免疫微环境的改变使其预后相对较差,ICI在这些人群中应用的疗效和安全性有待进一步明确。目前的研究数据支持在慢性病毒感染、非活动性AID、慢性器官功能障碍、中枢神经系统转移、老年合并晚期NSCLC患者中应用ICI,但仍然需要警惕相关不良反应的发生;对于ECOG/PS评分≥2、器官移植、长期应用免疫抑制剂合并晚期NSCLC的患者应根据患者个体情况谨慎使用,并密切观察患者药物反应与病情变化;对于孕妇合并晚期NSCLC则不建议使用ICI类药物。然而,目前关于特殊NSCLC人群使用ICI药物的研究数据仍十分有限,未来亟需更多前瞻性、大样本临床研究进一步明确治疗的安全性和有效性,回答真实世界临床实践的各类问题。 作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。 学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。 同行评议:经同行专家双盲外审,达到刊发要求。 利益冲突:所有作者均声明不存在利益冲突。 文章版权:本文出版前已与全体作者签署了论文授权书等协议。5.3 老年患者

6 总结与展望
